
9月15日,据CDE官网显示,重庆精准生物技术有限公司(以下称“精准生物”)的“C-13-60细胞制剂”和“MC-1-50细胞制剂”的IND申请均获得了受理。


截图来源:CDE官网
C-13-60是精准生物基于RESCAR和PHICAR平台研发的一款靶向CEA的CAR-T细胞疗法。这一药物的IND申请此前已经获得过CDE批准,用于治疗经标准治疗后进展或不耐受,现已无有效治疗手段的晚期末线恶性实体肿瘤。这也是首个获得CDE受理的CEA CAR-T疗法。笔者猜测本次可能是新适应症申请。
MC-1-50是精准生物基于PRIMCAR平台自主研发的第二代靶向CD19的CAR-T细胞疗法,具有更低剂量、更小副作用、更持久的优势。该候选产品的临床数据曾在2022年ASCO年会上公布,在13例接受治疗的复发/难治性急性B淋巴细胞白血病(r/r B-ALL)患者中,ORR达到100%;在安全性方面,84%的患者发生了CRS,其中1级CRS有7例(54%),2级CRS有4例(30%),未观察到≥3级的CRS,整体安全性较好。
MC-1-50基本信息
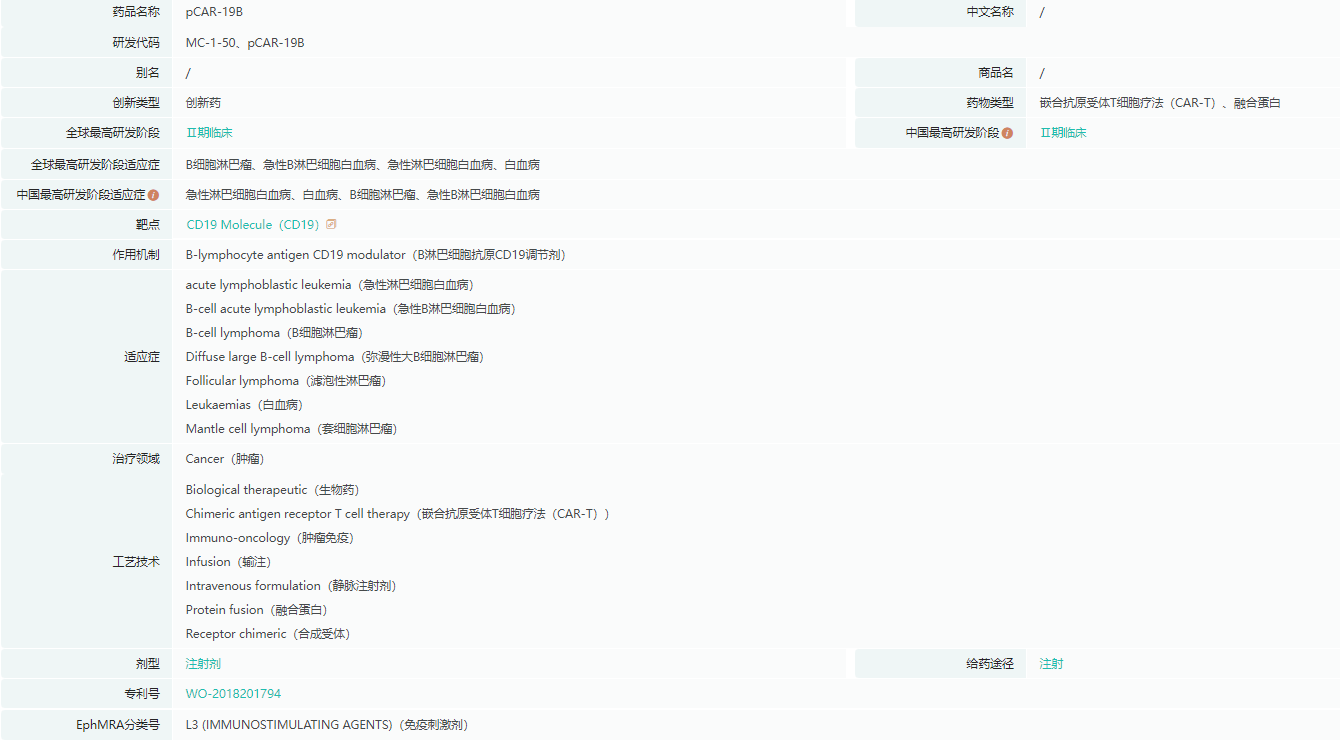
截图来源:药融云全球药物研发数据库
而2023年在ASCO年会上公布的新数据中,19例r/r B-ALL患者的ORR还是保持了100%,超过50%以上的患者在未接受移植的情况下取得了持续性的CR缓解,且安全性明显优于传统制备的同靶点CAR-T产品。此外,MC-1-50治疗复发/难治性B细胞非霍奇金淋巴瘤(r/r B-NHL)患者的1期临床数据显示:13例患者细胞制备时间均为2天左右,5*10^5 CAR+/kg剂量组的所有患者均获得了CR,且取得CR患者能够获得较长久的CR,药物耐受性良好。
关于精准生物
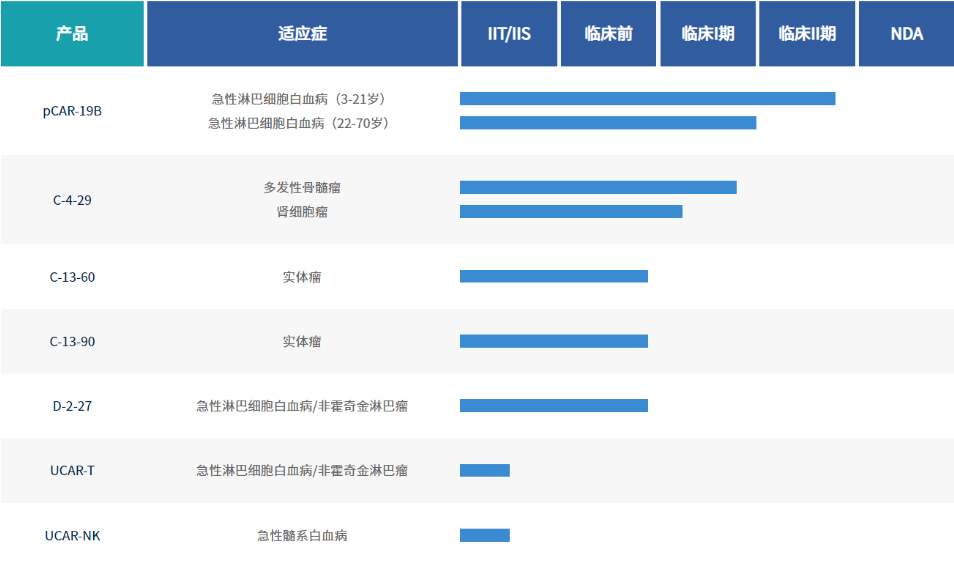
精准生物自2016年成立以来,经过七年深耕厚植的研发,开始向生物制药阶段升级迈进,在CAR-T等细胞药物产业化的道路上实现质的跨越。公司自主研发部署了10余项实体瘤、血液瘤CAR-T产品管线,目前已获得3个CAR-T细胞一类生物新药的6项适应症默示许可,并且实现了CAR-T治疗肾癌、结直肠癌等实体瘤注册临床的国内首创、国际率先突破。
其中,精准生物pCAR-19B产品在ALL(急性淋巴细胞白血病)适应症进展迅速,尤其是儿童难治复发ALL适应症,更是国内最早进入临床II期的CAR-T产品,并取得了优异的疗效成绩。该产品上市后,有望成为中国首个针对该适应症的CAR-T产品。
精准生物研发管线
参考资料:
1.公司官网
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论