
“CNLC(中国肝癌分期方案)IIIa期,甲胎蛋白(原发性肝癌特异性标志物,AFP)水平180,446ng/ml,预留肝体积不足40%……”这些指标对于34岁的原发性肝癌患者程先生来说无异于晴天霹雳,这不仅意味着超出海内外各种肝移植标准使他不适合进行移植手术,而且也无法通过常规手术对肿瘤进行切除,彻底根治的可能性几乎为零。不过,对于程先生和他的家人来说,他们又是幸运的——一种已经在海外有着非常成熟的临床应用经验的治疗手段,成为了扭转程先生病情的关键。
2021年9月,由中国工程院院士、北京清华长庚医院院长董家鸿院士领衔的专家团队,在海南博鳌超级医院为程先生进行了治疗。治疗后7天,程先生就顺利出院,并很快恢复了正常工作。专家团队在去年12月24日正式公布了治疗情况:术后3个多月增强CT及MRI影像检查复查结果显示,患者肿瘤病灶完全缓解,无活性病灶(mRECIST),AFP水平降至335.76ng/ml。也就是说,通过治疗程先生获得了进一步手术的机会和彻底根治的希望。
这就是SIR-Spheres®钇[90Y]微球注射液带来的惊喜!而现在,这一惊喜有望通过特需审批的个案惠及更多的癌症患者。2月9日,远大医药集团发布公告,公司核心产品SIR-Spheres®钇[90Y]微球注射液正式获得国家药监局(NMPA)颁发的药品注册证书,用于经标准治疗失败的不可手术切除的结直肠癌肝转移患者的治疗。远大医药放射性药物诊疗平台最重磅的产品钇[90Y]微球注射液成为2022年NMPA批准上市的首款治疗性放射性药物,也是中国首个获得批准用于治疗结直肠癌肝转移灶的产品。
至此,继2021年9月在海南自由贸易港博鳌乐城国际旅游医疗先行区依托境外已上市医疗器械先行先试政策开展临床应用后,钇[90Y]微球注射液获得NMPA上市许可,正式进入中国大陆市场。
据了解,目前国内多家医院已经具备钇[90Y]微球注射液使用条件或正在积极准备,包括中国人民解放军总医院、北京大学肿瘤医院、复旦大学附属中山医院、复旦大学附属肿瘤医院、中山大学附属第一医院、中山大学附属肿瘤医院、华中科技大学同济医学院附属协和医院等。
钇[90Y]微球注射液为中国患者带来全新的治疗方案
国际癌症研究机构(IARC)最新癌症数据库数据显示,2020年中国结直肠癌新发病例超过55万人,死亡病例超过28万人;中国结直肠癌肝转移诊断和综合治疗指南(2020)显示,在中国,肝转移是直接导致结直肠癌患者死亡的重要原因,约30-50%的结直肠癌患者会发生肝转移,80-90%的肝转移灶初始无法获得根治性切除,肝转移灶无法切除的患者的5年生存率低于10%,对患者、医疗人员和卫生服务机构造成了巨大的负担。
为了给予更多肝癌患者、结直肠癌肝转移患者带来新的治疗机会,2018年,远大医药联手鼎晖收购了全球唯二的靶向放射治疗企业之一——Sirtex,获得了钇[90Y]微球注射液的全球权益。
自2002年钇[90Y]微球注射液获美国FDA及欧洲EMA批准上市以来,该产品仍是全球唯一一款用于结直肠癌肝转移选择性内放射治疗“SIRT”的产品。上市20年以来,钇[90Y]微球注射液已在全球超过50个国家和地区累计治疗超过12万人次,其安全性和有效性已经得到充分验证。正是基于在全球范围内大量的真实世界的成功应用案例及临床研究数据,此次钇[90Y]微球注射液在国内使用海外数据申报上市,获得国家药监局的认可与支持。
钇[90Y]微球注射液在欧美及中国香港、中国台湾地区开展的多项高质量、大样本量临床研究结果显示,钇[90Y]可以显著提高肿瘤反应率,使患者肿瘤缩小、降期并重获肝切除术机会;并可显著延长肝脏无进展生存期,控制患者肝脏肿瘤进展,增加等待肝移植手术的时间。同时,钇[90Y]微球注射液副作用较小、患者生活品质较高,有望成为中晚期肝癌的一线治疗方法。
目前,钇[90Y]微球注射液已被欧洲肿瘤内科学会(ESMO)、美国国立综合癌症网络(NCCN)、英国国家健康照护专业组织(NICE)等机构发布的指南推荐作为治疗原发性肝癌以及结直肠癌等肝转移瘤的治疗方式之一,并进入了《原发性肝癌诊疗指南(2022版)》、《中国结直肠癌肝转移诊断和综合治疗指南(2018版)》、《中国肝癌肝移植临床实践指南(2018版)》等中国指南,临床认可度高。其中,今年初国家卫健委发布的《原发性肝癌诊疗指南(2022年版)》在上一版(2019年版)基础上,新增了桥接与降期治疗的用法推荐。此外,在治疗原发性肝癌(HCC)方面,钇[90Y]微球注射液也于2021年3月获得美国FDA批准,开展HCC临床试验并于5月完成首例患者给药。
深度布局放射性药物诊疗,远大医药打造核药物航母
自2018年开始,通过坚持全球化布局的发展战略,远大医药联合Sirtex、参股公司Telix以及日前合作的德国ITM公司,在抗肿瘤领域逐渐搭建了具有国际化一流水平的核药诊疗平台,在全球核药领域实现了全产业链——研发、生产、销售、监管资质等多领域的全方位布局。抗肿瘤领域产品管线方面,远大医药已储备16款全球创新产品,涉及肿瘤介入、放射性核素偶联药物(RDC)以及免疫治疗三个方向,其中公司重点布局的放射性药物诊疗平台现已拥有10款全球创新产品,包括钇[90Y]微球注射液及其余9款RDC药物,涵盖68Ga、177Lu、131I、90Y、89Zr、99mTc在内的6种核素,适应症覆盖肝癌、前列腺癌、透明细胞肾细胞癌、胶质母细胞瘤、胃肠胰腺神经内分泌瘤及恶性肿瘤骨转移等。产品种类涵盖诊断和治疗两类核素药物,管线丰富且癌种覆盖面广,为患者提供多癌种、多手段且诊疗一体化的全球领先的抗肿瘤方案。
远大医药公告显示,上述10款产品中,钇[90Y]微球注射液是FDA也是NMPA批准的第一款放射性微球产品;用于诊断前列腺癌的RDC药物TLX591-CDx于日前在美国和澳大利亚获批上市,并在巴西获得特别授权,准许在正式获批前先投入临床应用;用于诊断透明细胞肾细胞癌的TLX250-CDx已获FDA批准突破性疗法并于澳大利亚完成I期临床研究首例患者给药;用于治疗胶质母细胞瘤的TLX101已获FDA孤儿药资质认定;用于治疗前列腺癌的TLX591已于澳大利亚获批开展III期临床研究;用于诊断胃肠胰腺神经内分泌瘤的TOCscan®已于2018年在德国、奥地利、法国获批上市;用于治疗胃肠胰腺神经内分泌瘤的ITM-11获得FDA和欧洲药品管理局(EMA)的孤儿药资格,海外正在开展III期临床研究;用于治疗恶性肿瘤骨转移的ITM-41目前处于I期临床研究阶段。多款RDC药物在中国的注册工作也在积极的推进中,其中TLX591-CDx预计将于2022年第一季度向NMPA递交临床研究申请(IND)。

▲远大医药肿瘤领域管线布局
此次远大医药钇[90Y]微球注射液产品正式在国内获批上市,正是远大医药多年持续、深入经营核药物领域的重要成果。从“特许准入”发展到大规模的临床应用,我国越来越多的肝癌患者将会从这款创新性、全球领先药品中受益,同时也有望加速我国核医学的发展。
全方位布局,远大医药驶向千亿级蓝海
与欧美发达国家相比,我国核药物市场仍然处于发展初期。《中国放射性药物制备的现状及展望》中指出,2017年全球核药销售额达45亿美元,其中美国占38%,欧洲占24%,我国仅占不到8%;以目前使用较多的99mTc为例,其母体核素99Mo全球2017年用量50万居里,美国年用量20-30万居里,占全球50%以上,而我国年用量为1.2万居里,仅占全球的3%。目前我国每万人开展核医学检查数量仅有19人,仅为全球平均水平的30%左右,更远低于发达国家水平。
为了改变这一现状,2021年6月,国防科工局、医保局、卫健委、药监局等国家八部委联合发布了《医用同位素中长期发展规划(2021-2035)》,充分肯定了核医学在重大疾病早期诊断、微小病灶的精准清除以及合理诊疗方面具有独特的作用。这也成为了未来15年间,我国核药物发展的纲领性文件。今年初,国家药监局发布《关于进一步加强放射性药品管理有关事宜的通告》,进一步明确了核药物的上市许可持有人管理、检验和出厂管理,明确提出含有短半衰期放射性核素的药品可以边检验边出厂,对治疗类核素药物市场的快速发展给予了明确支持。
远大医药对核药物领域的布局,正是看中了在政策支持和市场需求双重推动下,这一领域巨大的潜在发展空间。GE healthcare数据显示,2018年全球核医学市场规模约50亿美元,预计2030年全球核医学市场规模将达到140-300亿美元。随着新获批核药品种越来越多,多款药物的上市和放量使得治疗市场空间有望进一步打开,治疗类产品在核医学市场的占比将从当前的14%上升到35%。远大医药CEO周超先生此前在参加第六届中国医药创新与投资大会期间表示:“以拜耳和诺华的Xofigo和Lutathera两款核药物为例,Xofigo三年达到4亿美元后因副作用原因限制其应用范畴对销售造成一定影响。Lutathera则上市后两年达到4亿美元。”
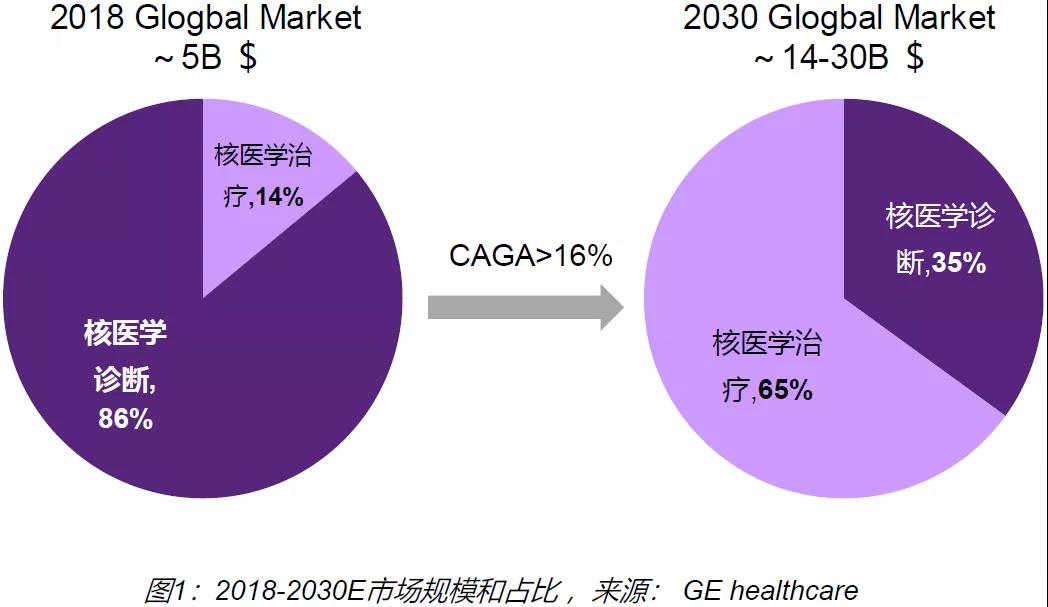
▲2018-2030年核药物市场规模和占比,
来源:GE healthcare
近年来,国内创新药企扎堆单抗、双抗药物,而远大医药坚持以科技创新为原动力,在介入、核药及免疫治疗抗肿瘤领域持续发力,已在全球范围内实现了研、产、销等领域的全方位布局。此次钇[90Y]微球注射液在国内的获批上市,是公司这一长期战略的重要里程碑,千亿级别的核药物市场,也有望成为远大医药新的“星辰大海”。
值得一提的是,与一般的药物不同,核素药物在拥有优异的临床效果同时,其安全性也有着极高的门槛。2020年11月远大医药先同江苏原子医学研究所签订战略合作备忘录,就放射性核素偶联药物领域的药物研发、生产及标准制定、临床前研究以及知识产权等领域合作达成一致意向;同月,远大医药中国生态环境部核辐射安全中心签订辐射安全与环境保护合作框架协议,就核辐射安全及相关领域开展技术合作。同时,通过普尔伟业平台,远大医药获得《放射性药品生产许可证》及《放射性药品经营许可证》,并获得在中国大陆开展68Ga、177Lu、89Zr、90Y等多种放射性核素偶联药物的开发、生产、经营的相关资质。这就使得远大医药在核药物领域的布局,实现了放射性药物领域特殊且严格的监管要求。通过持续夯实全球化创新布局及丰富的创新产品管线,公司在核药抗肿瘤等多个细分领域龙头地位逐渐显现,并朝着国际领先的放射性核素药物诊疗平台持续迈进。
根据Frost&Sullivan数据统计显示,中国放射性药物产业年复合增速在18.6%左右,进入高速增长期,预计2022年国内市场总额将达到106亿元,拥有10个全球创新型核药物的远大医药,有望成为下一个市场黑马。与此同时,钇[90Y]微球注射液的上市,也标志着国内核药“双寡头”格局已被打破,中国核药治疗领域将会开启“三足鼎立”的新篇章。
<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论