3 月 16 日,科伦药业对外公布了11 日开展的调研活动会议纪要,科伦研究院宋宏梅博士就公司重点项目进展情况进行汇报
一、 研发管线 :
不包括细胞治疗的大小分子共 74 个项目在研,包括临床前和临床。
a. 大分子:A167 已向 CDE 提交 pre-BLA 的申请,现准备国家局的现场核查工作;A166 已向 CDE 提交关键Ⅱ期申请,就 166 的数据表现而言在 HER2 ADC 领域具有竞争优势;A264 TROP2 ADC 已获得一期临床数据,就目前看来具有 me-better 潜力,同时 A264 在对外授权工作也取得实质性进展。免疫检查点单抗 A289、A400 临床启动准备中;337 为科伦首个双抗。
b. 小分子:277、223、204 均已取得健康人数据,完成成药性风险研究。其中 277 和 223 正在启动Ⅱ期研究工作,204 今年上半年开展一期研究。A140 Ⅲ期已开始入组。
二、今年申报预测:
a. IND:今年的大小分子预计至少6个IND,尽量克服国外疫情对研发所需原料、耗材来源的影响。
b. 临床前候选分子:今年至少6个项目拿到临床前的候选分子,明年开始申报或者开展临床前研究工作,因为涉及不同适应症具体时间不定。
三、管线建设重点:
治疗领域:肿瘤为核心研发领域,会开展大小分子协同战略布局,乙肝、疼痛等重大领域也会持续跟进,同时也会立项好靶点,建设具有增长 性和抗风险能力的管线,未来有好的靶点也会进行布局。
项目技术类型:以 ADC 为主,继续重点推进已有 ADC 项目, 2021 年 Claudin 18.2 ADC 进入临床。除已有管线,会基于生物学系统布局临床前 靶点,以提升整个 ADC 管线实力。
单抗:持续跟进新一代的肿瘤免疫靶点,作为 ADC 研发的一个模块。
双抗:国内研发热但成药性的风险没有得到很好释放,研发将更多从靶点组合机制出发,满足临床需求,不为组合而组合。
四川科伦药业股份有限公司成立于1996年,并于2010年6月在深圳证券交易所成功上市,经过20多年的发展,科伦药业已成长为“大输液+原料药+制剂”三发驱动的现代化药企。不过,近年来,科伦药业已逐步开始加速向国际创新药型制药企业转型,该公司的研发投入在逐年增加。本文根据药融云数据整理了科伦部分新药研发管线,包含生物药15项,小分子治疗药14项。
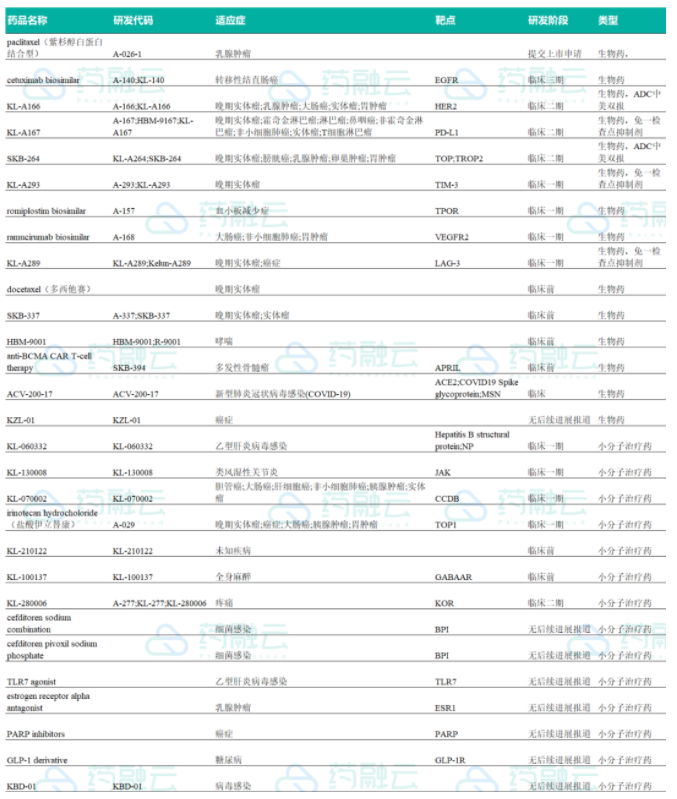
科伦创新药研发管线
四、 抗体偶联(ADC)—KL-A166、SKB-264
ADC药物由单克隆抗体和强效毒性药物通过连接子(linker)偶联而成,是一种靶向癌细胞的强效抗癌药物。全球目前共上市11款ADC药物,其中辉瑞Mylotarg为全球首个ADC药物,但由于技术受限导致致死性毒性的产生于2010年退市,之后2017年在白血病领域再度获批;而武田Adcetris和罗氏Kadcyla表现相对较好,Adcetris2018年全球销售额约为8.8亿美元,其中北美4.77亿美元;Kadcyla2019年全球销售额超过10亿美元。

全球上市ADC药物
A166对标罗氏重磅ADC药物Kadcyla
科伦A166为HER2抗体ADC药物,对标罗氏Kadcyla(曲妥珠单抗与微管抑制剂DM1偶联)。目前已完成中美双报,科伦的 A166是全球首个通过赖氛酸定点定量偶联、具有创新Linker和高活性毒素小分子的第三代抗HER2 ADC,具有良好的血液稳定性。
2018年8月A166在中美同步开启Ⅰ/Ⅱ期临床试验,适应症为治疗HER2+晚期实体瘤。2020年5月在ASC0 上发表A166美国临床的初步结果:4个剂量组0.3/1. 2/3. 6/4. 8 mg/kg中3.6和4.8 mg/kg为有效剂量组,乳腺癌、结直肠癌、胃癌、肺癌等适应症均显示出疗效,有效剂量组的0RR为36%;同期的中国临床削量已爬升至6.0 mg/kg,尚未出现DLT。
罗氏Kadcyla是由靶向HER2的曲妥珠单抗,与微管抑制剂DM1 ( —种美登素衍生物)连接而成的ADC药物,该药物于2013年获FDA批准上市,作为单一制剂用于治疗既往已接受赫赛汀和紫杉烷化疗(单独或联合治疗)的HER2阳性转移性乳腺癌患者。
2020年1月,NMPA批准赫赛莱上市,单药适用于接受了紫杉烷类+曲妥珠单抗为基础的新辅助治疗后仍残存侵袭性病灶的HER2阳性早期乳腺癌患者的辅助治疗,2019年全球销售額超过15亿美元。
SKB-264
SKB-264是科伦博泰第二个完成中美双报的创新药,为靶向TPOR靶点的ADC。 SKB264的临床申请分别于2019年8月和2020年4月被FDA和NMPA批准。SKB264通过新型偶联方式实现高毒素负载,工艺稳定可控、易于放大,产品批间一致性好。非临床研究数据表明在TR0P- 2阳性的乳腺癌、胃癌、肺癌和结直肠癌动物模型中的抗肿瘤活性显著,兼具良好的安全性和耐受性。
TPOR-ADC全球仅一款药物上市, 2020年4月22日,FDA加速批准 Immunomedics的TPOR-ADC药物Trodelvy用于先前已接受过至少两种疗法治疗的转移性三阴性乳腺癌患者,2020年7月6日Immunomedics宣布在治疗mTNBC患者的确认性3期ASCENT 研究达到了无进展生存期(PFS)的主要终点,将患者疾病进展或死亡风险降低59%。而在此前的 2019年4月,云顶药业宣布将该药物引进中国。2020年4月,Trodelvy在中国的2b期临床申请获批。
六、免疫检查点抑制剂—KL-A167、KL-A293、KL-A289
KL-A167
科伦KL-A167作用于肿瘤免疫治疗的颠覆性靶点PD-L1,具有自主知识产权,主要通过与肿瘤细胞表面的PD-L1结合,解除肿瘤细胞免疫功能的抑制,激活免疫功能,从而杀伤肿瘤细胞。已有2项适应症进入临床2期,最快有望今年年上市。PD-L1单抗KL- A167的1期临床数据显示出良好的安全性,现已开展两项2期临床试验,适应症为复发或难治经 典型霍奇金淋巴瘤(r/r cHL)和复发或难治性鼻咽癌(r/r NPC),目前r/r cHL适应症已经完成入组,预计最快将于今年下半年获批上市。
KL-A293
TIM-3单抗KL-A293 为科伦博泰开发的具有自主知识产权的第二代肿瘤免疫检查点抑制剂,靶向作用机制明确,拟用于晚期恶性肿瘤的治疗。研究表明,KL-A293注射液在肿瘤动物模型中表现出抗肿瘤活性,具有良好的药代动力学特征,兼具良好的安全性和耐受性。公告表示,目前全球尚无同靶点药物获批上市。
TIM-3是目前研究最多的免疫治疗的靶点之一,但目前国内外尚无已上市药物,BMS、诺华、GSK处于2期临床阶段。国内的恒瑞、科伦、百济神州则处于1期临床试验阶段,智康弘义、复宏汉霖、凡恩世、昭衍生物、智仁美博、丽珠单抗等则处于临床前阶段。
KL-A289KL-A289为科伦药业/安源医药的LAG-3抗体,适应症为晚期实体瘤。临床申请于2020年5月22日获CDE承办,8月3日获得临床试验默示许可。为第5款国产LAG-3抗体。该单抗可同时阻断配体MHC-II和FGL-1。
LAG-3(lymphocyte activation gene 3,LAG-3,CD223)是一种免疫检查点受体蛋白,主要表达在活化的T细胞、NK细胞、B细胞和浆细胞树突细胞。目前全球尚未有LAG-3靶点的药物获批上市,国内布局该靶点的企业有恒瑞、信达、再鼎等
七、 生物类似药—A140、A168
西妥昔单抗生物类似物A140处于临床III期.西妥昔单抗原研为Imclone和BMS联合开发,2003年瑞士首次上市,也首个上市的靶向单抗,2004年美国上市、2006年国内上市,国内获批适应症为单用或与伊立替康联用于表皮生长因子受体过度表达的、对以伊立替康为基础的化疗方案耐药的转移性直肠癌。国内暂无西妥昔单抗生物类似物上市,科伦A140申报规格为全国首家。
雷莫芦单抗类似物A168于2018年3月获批临床,VEGFR2单抗国内未上市,科伦A168有望成为雷莫芦单抗的国内首款生物类似药。
雷莫芦单抗(商品名:Cyramza)原研为礼来,是一种完全人源化lgG1单克隆抗体,其能与血管内皮生长因子受体2(VEGFR-2)结合,从而抑制胂瘤血管生成。雷莫芦单抗自2014年被FDA批准上市以来,已获批晚期胃癌、结肠癌、非小 细胞肺癌和肝细胞癌四大适应症。






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论