
文 | 小不懂
封面 | Pixabay
2021年9月27日,恒瑞医药发布公告称,公司收到国家药监局核准签发关于注射用甲苯磺酸瑞马唑仑的《药品补充申请批准通知书》,在已获批上市的36mg规格[按瑞马唑仑{C21H19BrN4O2}计]的基础上,新增25mg规格[按瑞马唑仑{C21H19BrN4O2}计]。

(图片来源:企业公告)
注射用甲苯磺酸瑞马唑仑本次新增25mg规格[按瑞马唑仑{C21H19BrN4O2}计],可用于常规胃镜检查镇静及结肠镜检查的镇静,增加了临床使用的便捷性,减少资源浪费。
甲苯磺酸瑞马唑仑通过与GABAa受体结合,抑制神经元活动,从而产生镇静作用。甲苯磺酸瑞马唑仑的优势在于起效快、苏醒时间短、对呼吸及心血管系统影响小,是相对安全、可控的麻醉/镇静药物。
◆ 相关实验数据:
在本品用于胃镜诊疗镇静的Ⅲ期研究中,甲苯磺酸瑞马唑仑组受试者的中位镇静诱导时间为90秒,中位镇静苏醒时间为6分钟;用于结肠镜诊疗镇静的Ⅲ期研究中,甲苯磺酸瑞马唑仑组受试者的中位镇静诱导时间为90秒,中位镇静苏醒时间为8分钟。
上述临床试验中,甲苯磺酸瑞马唑仑组受试者低血压发生率为5.41%(24/444),心动过缓发生率为1.13%(5/444),呼吸抑制发生率为1.58%(7/444)。
20亿级重磅新药,多项适应症正在布局
甲苯磺酸瑞马唑仑是我国自主研发并拥有自主知识产权的1类创新药,最早由恒瑞医药研发报产,于2019年12月26日通过优先审评审批程序获批上市,为常规胃镜检查镇静提供了新的用药选择。这是恒瑞医药第六个获批上市的创新药,也是公司在患者舒适化诊疗领域布局的第一个创新药。
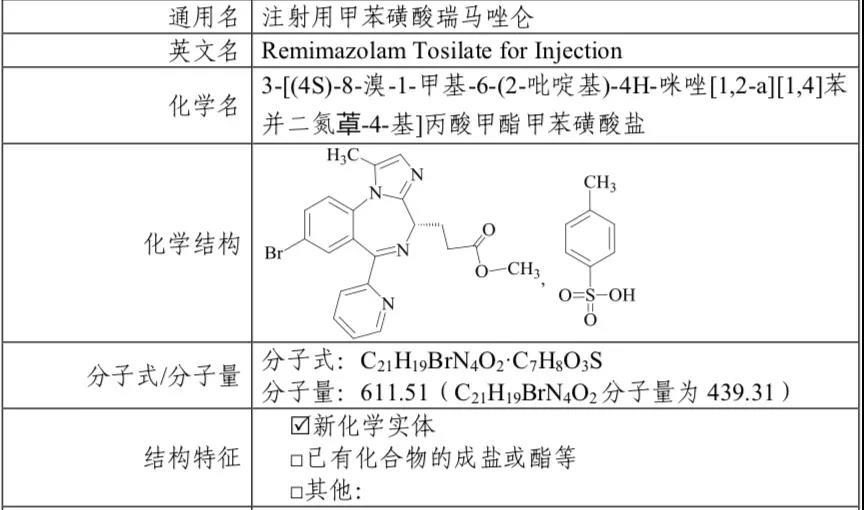
来源:CDE审评报告
瑞马唑仑是一种短效GABAa受体激动剂,由Paion AG公司开发,用于手术中的全身麻醉。该药结合了咪达唑仑的安全性与丙泊酚的有效性,但瑞马唑仑游离碱不稳定,需要成盐改善其理化特性。
Paion AG公司开发瑞马唑仑的苯磺酸盐,2018 年 12 月在日本授权萌蒂制药提交上市申请,2019 年 4 月在美国提交新药申请,2019 年 6 月美国 FDA 已受理该申请,2020年7月在美国获批上市。
目前国内瑞马唑仑相关产品仅有恒瑞医药与人福药业两家企业获批生产,均为各自的独家产品。

(图片来源:药融云中国药品批文数据库)
- 恒瑞医药选择了甲苯磺酸成盐,盐型核心专利为“苯并二氮杂䓬衍生物的托西酸盐及其多晶型、它们的制备方法和用途”,CN102964349A。其自主研发生产的1类创新药注射用甲苯磺酸瑞马唑仑(商品名:瑞倍宁)于2019年底率先获批上市,用于胃镜检查镇静,2020年6月24日,再获批新适应症,用于结肠镜诊疗镇静。
- 宜昌人福(Paion AG 公司授权)2018 年11月15日向国家药品监督管理局提交注射用苯磺酸瑞马唑仑(商品名:锐马)的上市申请,已于2020年7月16日获批,批准文号为国药准字H20200006,用于结肠镜诊疗镇静。
- 成都倍特于2020年9月申报了注射用氢溴酸瑞马唑仑的临床申请,注册分类为2.1类新药,目前正在审评审批中,有望成为国内第三个瑞马唑仑制剂。
取得先发优势的恒瑞,并未止步于此,瑞倍宁还在全身麻醉、支气管镜诊疗镇静、ICU期间镇静、局部麻醉辅助镇静等领域开展了临床研究。其中,全身麻醉和支气管镜诊疗镇静适应症已完成III期临床试验,并已进入申报生产阶段,有望2022年获批。
注射用甲苯磺酸开展的临床试验
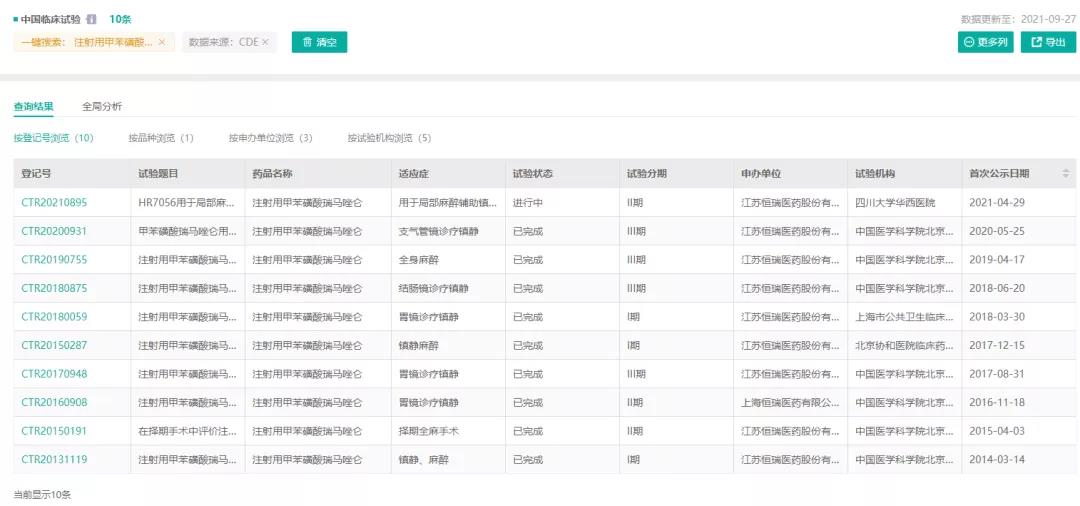
(图片来源:药融云中国临床试验数据库)
手术麻醉镇痛类产品是恒瑞医药主要营收来源之一。目前主要品种有七氟烷、右美托咪定和苯磺酸顺阿曲库铵。相关数据券商预计未来甲苯磺酸瑞马唑仑销售峰值将达到20亿人民币。
根据药融云全国医院销售数据显示,恒瑞的注射用甲苯磺酸瑞马唑仑上市后销售额一路高歌,2020年销售额超2600万元,2021Q1销售额便达到2000万,已接近去年销售额水平,市场前景见好,预计2021年整年销售额将在5亿元左右。
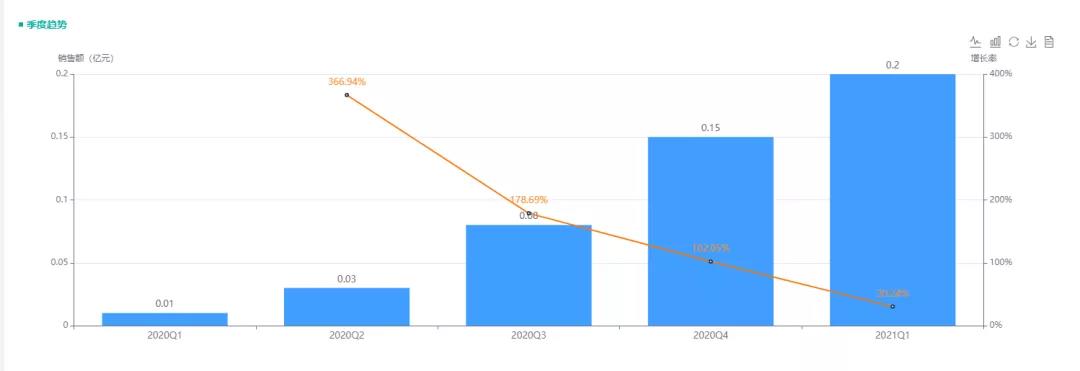
(数据来源:药融云全国医院销售数据,二级或二级以上医院)
—END—
本文为原创稿件,未经授权请勿转载。
















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论