
正常人肝内脂肪大约占整个肝重的2%~4%,当肝内脂肪含量超过5%且弥漫分布于全肝的时候,被称为脂肪肝。除了熟知的大量饮酒造成的ALD(酒精性肝病)以外,还有一种脂肪肝,被称为NAFLD(非酒精性脂肪性肝病)。
据估计,全球超过20%的成年人患有NAFLD,中国NAFLD患者人数在10年内从18%急剧增加到近30%,预计到2030年,中国的患病人数将超过3亿。非酒精性脂肪性肝炎(Nonalcoholicsteatohepatitis,NASH)是NAFLD的一种更晚期形式,一种由包括代谢、基因、环境和肠道微生态等多种机制调控的复杂疾病。患有NAFLD的人群中,大约20%可能患有NASH。
NASH是肝脏相关疾病死亡的主要原因,也是全球医疗保健系统负担日益加重的原因。此外,NASH患者,尤其是那些具有更晚期代谢危险因素的患者,发生不良心血管事件的风险增加,发病率和死亡率增加。一旦NASH进展为严重的肝纤维化(F2和F3期),患者的生命就会受到更严重的威胁。目前没有FDA批准的用于治疗NASH的疗法。
从药融云数据库获悉,2023年4月18日,Madrigal Pharmaceuticals,Inc.(NASDAQ:MDGL)宣布resmetirom已获得FDA的突破性疗法称号,用于治疗患有肝纤维化的NASH患者。2023年9月13日,Madrigal Pharmaceuticals宣布FDA已接受resmetirom的新药上市申请(NDA)并纳入优先审评审查,拟定的PDUFA目标审评日期为2024 年 3 月 14 日。

截图来源:Madrigal相关报道
对于NASH这块几十年“无水花湖面”来说可谓是激起了一阵涟漪,把NASH作为主要适应症的研发药物以Madrigal Pharmaceuticals的resmetirom为先锋,紧随其后的就是Viking Therapeutics的VK2809,而今天我们要详谈的,不是先锋军Madrigal Pharmaceuticals,而是紧随其后的Viking Therapeutics。
公司简介
Viking Therapeutics, Inc.(NASDAQ:VKTX)于2012年9月24号在特拉华州成立。作为一家临床阶段的生物制药公司,致力于开发用于治疗代谢和内分泌疾病的新型首创或同类最佳疗法。公司目前在研药物中有三款药物已进入临床试验阶段。
自成立之日起,公司共进行了三轮融资,总融资金额达到3850万美元,其中,2014年的250万美元以债券融资的形式得到,来自Ligand Pharmaceuticals,另外两轮融资详细信息未公开。
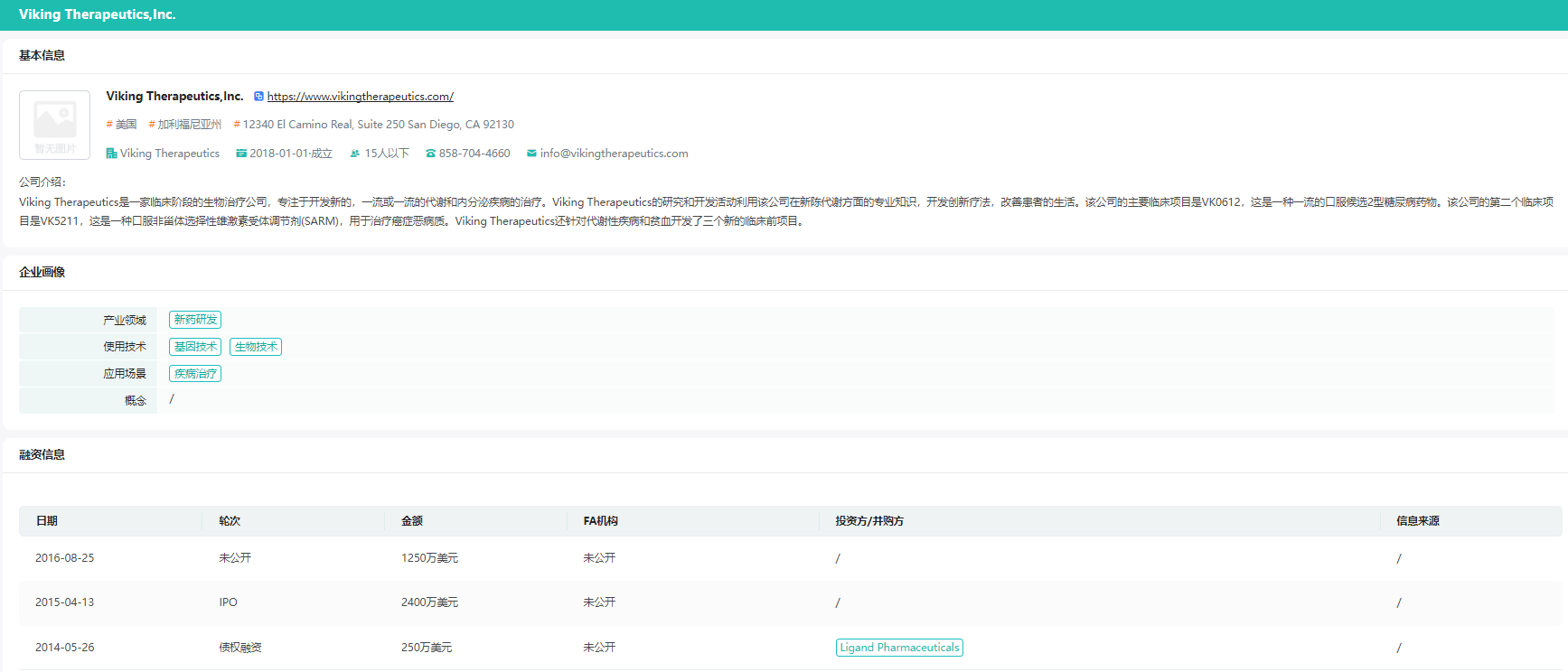
截图来源:药融云医药投融资数据库
由于成立以来公司的资金主要用于研发、一般和行政投入,并且近几年有扩大资金投入的趋势,Viking Therapeutics在想方设法筹集资金。2023年4月,Viking Therapeutics宣布结束其先前宣布的19828300股普通股的公开发行,公开发行价为每股14.50美元,其中包括承销商行使其购买最多2586300股额外普通股的全部选择权。在扣除承销折扣、佣金和其他估计的发行费用之前,Viking Therapeutics从此次发行中获得的总募资金额约为2.875亿美元。
目前Viking Therapeutics打算将此次发行的净收益用于继续开发其VK2809、VK2735和VK0214计划,以及用于一般研发,营运资金和一般企业用途。

▲发行普通股相关报道
研发管线
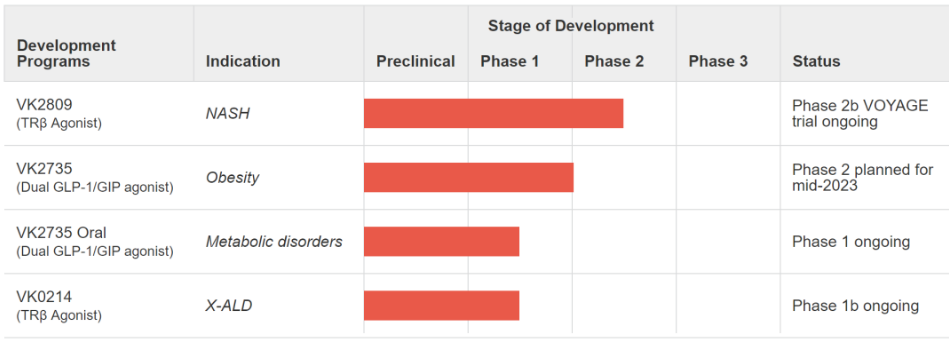
Viking Therapeutics成立十余年一直专注于开发用于治疗代谢和内分泌疾病的新型首创或同类最佳疗法,目前有三种处于临床试验中的药物,其他药物正处于开发阶段。其中,处于临床试验的药物有VK2809、VK2735和VK0214。
VK2809是一种新型小分子甲状腺激素受体β(THR-β)激动剂,对肝组织以及β受体亚型具有选择性,有望治疗代谢紊乱,包括非酒精性脂肪性肝炎(NASH)。
甲状腺激素受体存在于全身的各种组织中。THR-β是在肝脏中表达的主要受体亚型,TRα是在心脏中表达的主要亚型。TRβ激动剂的肝脏靶向特性旨在减少或消除肝外甲状腺受体激活的有害影响,特别是高组织和TRβ选择性可能导致TRα受体活性降低,这可能进一步导致呼吸增加和心脏组织肥大。肝组织中TRß受体的选择性激活被认为通过多种机制有利地调节胆固醇和脂蛋白水平,包括增加低密度脂蛋白受体的表达和增加线粒体脂肪酸氧化,这些特性反过来又导致LDL-C(低密度脂蛋白胆固醇),血浆和肝脏甘油三酯的减少。
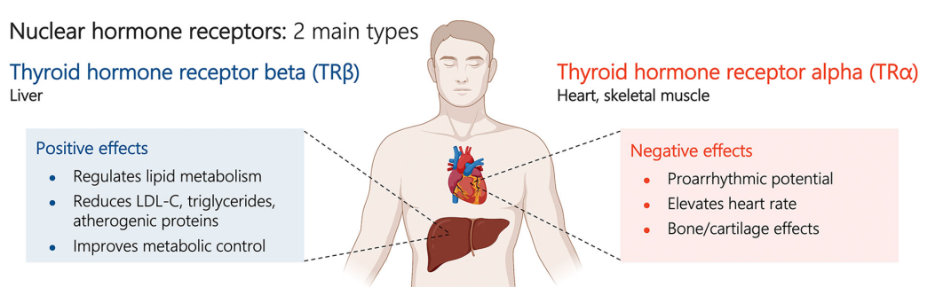
▲甲状腺激素受体类型
VK2809正处于二期临床试验阶段。2023年一季度初,完成了在NASH和纤维化患者中的2b期VOYAGE研究入组,预计在2023年第二季度报告这项研究的主要终点数据。
VK2809全球研发进度查询(部分)

截图来源:药融云全球药物研发数据库
基于2a期试验的良好结果,Viking Therapeutics启动了VOYAGE研究,该研究是一项随机、双盲、安慰剂对照、国际多中心临床2b期试验,旨在评估VK2809在活检确诊的非酒精性脂肪性肝炎(NASH)和纤维化患者中的有效性、安全性和耐受性。目标人群包括通过磁共振质子密度脂肪分数测量的肝脏脂肪含量至少为8%的患者,以及F2和F3纤维化患者。VOYAGE研究的主要目标将评估接受VK2809治疗的患者与接受安慰剂的患者相比,肝脏脂肪含量从基线到第12周的变化。次要目标包括评估治疗52周后通过肝活检评估的组织学变化。
VK0214是一种新型口服甲状腺激素受体β受体激动剂,正在评估作为X连锁肾上腺脑白质营养不良(X-ALD)的潜在治疗方法,X-ALD是一种罕见的神经源性疾病,目前尚无批准的治疗方法。
VK0214基本信息
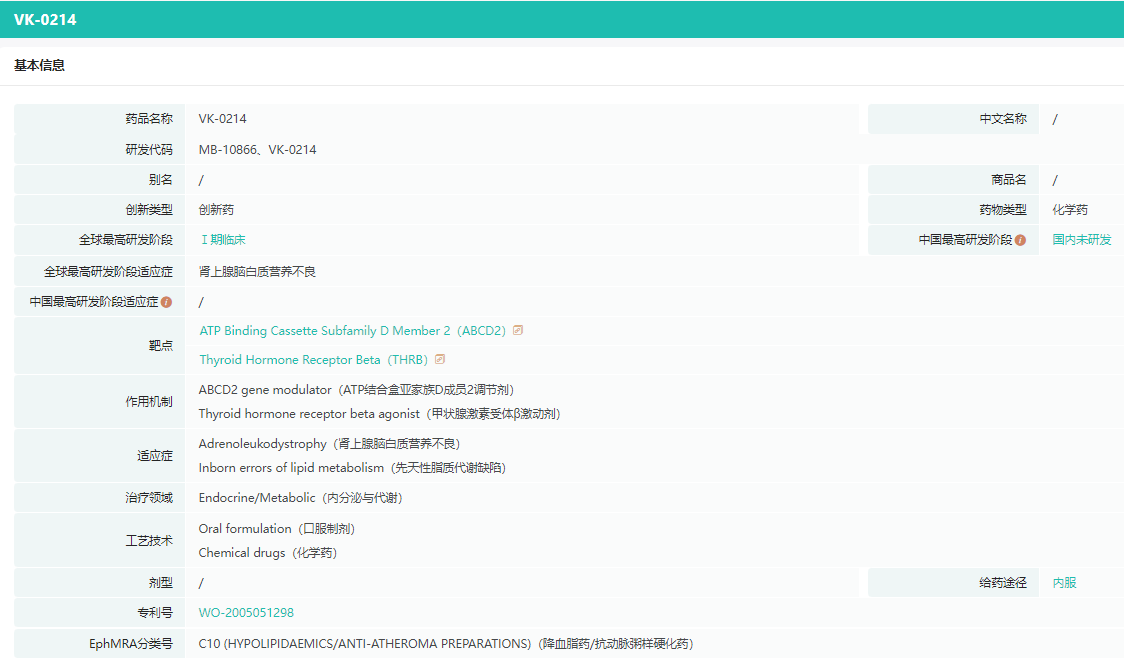
截图来源:药融云全球药物研发数据库
2021年,Viking宣布了VK0214在健康志愿者中进行的一期研究的结果。VK0214在这项研究中表现出良好的安全性和耐受性,与安慰剂相比,VK0214治疗的受试者在胃肠道副作用(如恶心或腹泻)方面没有观察到严重不良事件,也没有报告差异。
在完成1期研究后,该公司启动了VK0214在肾上腺脊髓神经病(AMN)形式的X-ALD患者中的1b期研究,AMN是X-ALD最常见的形式。1b期试验是一项针对成年男性AMN患者的随机、双盲、安慰剂对照多中心研究。该研究的主要目的是评估VK0214口服的安全性和耐受性,每天一次,持续28天。该研究还包括对VK0214在AMN患者中的药代动力学评估,以及对超长链脂肪酸血浆水平变化的探索性评估。目前这项1b期研究仍在继续招募,预计在2023年下半年报告初步结果。
财政营收
虽然Viking Therapeutics从成立至今尚未有营业收入,但是从近几年的年报来看,公司却在逐年加大投入,并且从公司的研发情况来看,若NASH药物研发能顺利进展到三期临床试验,后续获批也就是迟早的事。
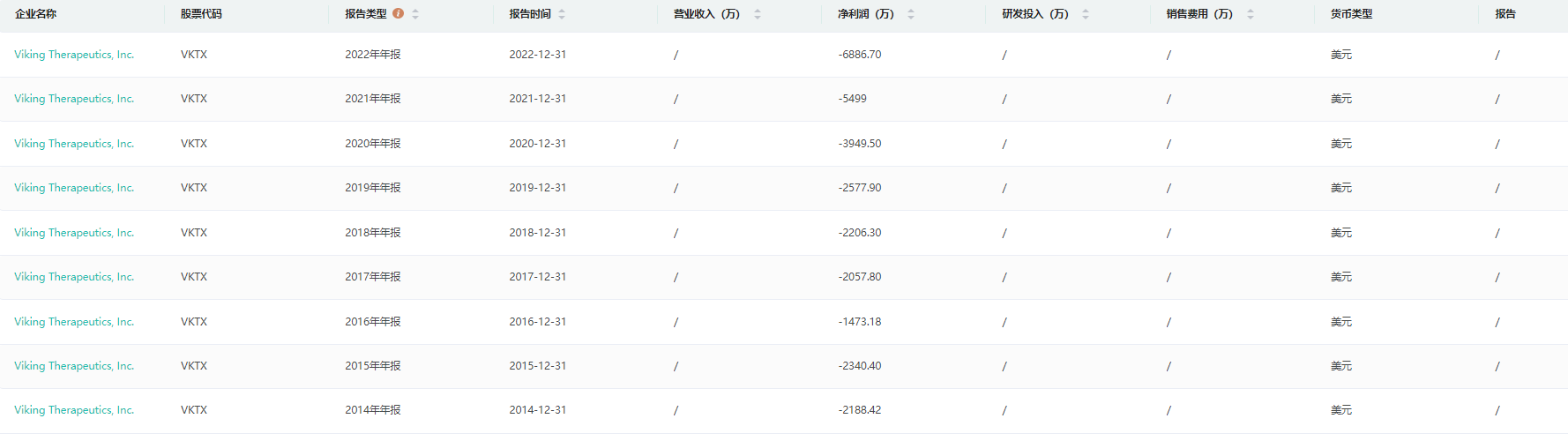
截图来源:药融云上市医药企业年报数据库
截至2022年12月31日,Viking Therapeutics报告的净亏损为6890万美元(或每股50.90美元),而2021年同期的净亏损为5500万美元(或每股50.71美元)。2022年净亏损(或每股净亏损)的增加主要是由于研发费用和一般行政费用的增加。
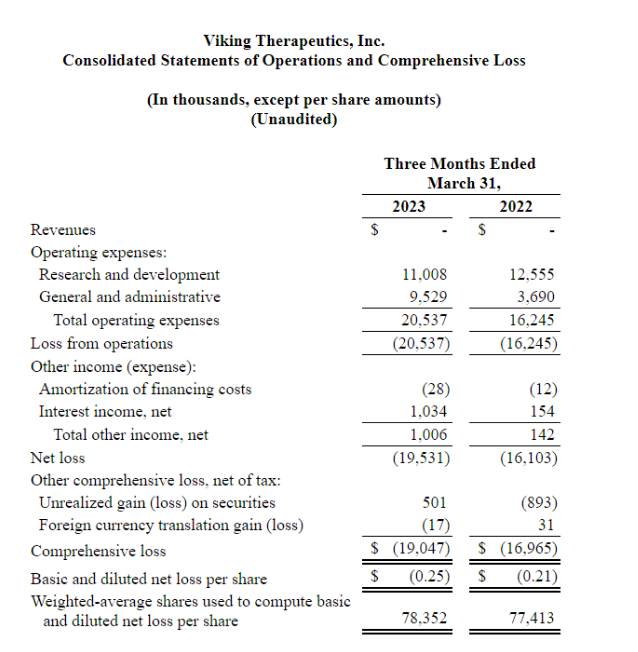
▲合并经营报表和综合亏损
Viking Therapeutics 2023年第一季度的研发费用为1100万美元,2022年同期为1260万美元,与同期相比这一时期研发费用减少主要与临床研究、临床前研究和第三方顾问相关的费用减少有关,部分被与工资和福利、股票薪酬和监管服务成本相关的费用增加所抵消;一般及行政开支为950万美元,2022年同期为370万美元,这一增长主要是由于与法律和专利服务、股票薪酬以及薪金和福利有关的支出增加;第一季度的报告净亏损1950 万美元,或每股0.25 美元,而2022 年同期的净亏损为1610 万美元,或每股0.21 美元,净亏损和每股净亏损的增加主要是由于之前提到的一般和管理费用的增加,部分被与2022年同期相比增加的利息收入所抵消。
截至2023年3月31日,Viking Therapeutics持有的现金、现金等价物和短期投资为1.357亿美元。
结语
目前Viking Therapeutics研发进展最快的药物就是处于临床二期试验的VK2809,2022年年底Viking Therapeutics向歌礼制药以及歌礼制药的创始人吴劲梓博士及公司若干附属公司作出控告,因为Viking Therapeutics认为歌礼制药的候选药物ASC41及ASC43F侵犯了其候选药物VK2809的商业机密,随后歌礼制药坚决否认,但是今年三月份歌礼旗下以NASH为研发重点的子公司Gannex制药已撤回原定于2023年12月开始的一项美国二期试验。
虽然具体事实我们尚不清楚,但是可以肯定的是,NASH赛道当前的竞争正在明里暗里的进行,各竞争对手都在想方设法杀出重围。

▲歌礼制药相关报道
2022年6月22日,Intercept Pharmaceuticals,Inc.宣布FDA已发布完整回复函(CRL),以回应该公司针对奥贝胆酸(OCA)的新药申请,用于治疗NASH。FDA在回复函中表示,在NASH中重新提交奥贝胆酸的任何新药申请至少需要成功完成REGENERATION研究的长期结果阶段。收到这一回复之后,InterceptPharmaceuticals决定停止所有与NASH相关的投资,重组公司的运营以加强对罕见和严重肝病的关注,并从2024年开始加速盈利。

▲ Intercept相关报道
Intercept Pharmaceuticals的奥贝胆酸曾一度被认为是行业标杆,而今却惨遭拒绝。不知道这一消息会不会影响各位后起之秀的研发布局,像Intercept、Mardrigal这样跑在前面的公司,其数据和临床试验也对后来者有很强的借鉴意义,Viking Therapeutics能否从这些企业身上找到自己的出路呢?相信时间会给我们答案。
参考资料:
NMPA/CDE
药融云数据库
FDA/EMA/PMDA;
相关公司公开披露(除标注外,正文图片均来自企业官网);
https://vikingtherapeutics.com/;
https://mp.weixin.qq.com/s/_qMDQvhysxGXAk2MRAuxng;
https://endpts.com/scoop-ascletis-nash-subsidiary-scraps-us-phii-trial-in-favor-of-china/;
https://ir.madrigalpharma.com/news-releases/news-release-details/madrigal-receives-breakthrough-therapy-designation-fda;
https://www.globenewswire.com/news-release/2023/06/22/2693358/23024/en/Intercept-Receives-Complete-Response-Letter-from-FDA-for-Obeticholic-Acid-as-a-Treatment-for-Pre-Cirrhotic-Fibrosis-due-to-NASH.html;
https://finance.sina.com.cn/stock/med/2023-06-26/doc-imyyqitu4302704.shtml;等等。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


































![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yry-public-oss.pharnexcloud.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)
















 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论