1 背景
飞行检查是NMPA药品生产、经营企业进行的无提前通知的一种现场检查方式,能真实地反应药企日常生产、经营的运行情况。作者汇总了NMPA自2015.12.23至2019.01.25年的药品飞行检查通报结果,并进行了汇总解读。
2 经营企业与生产企业检查状况
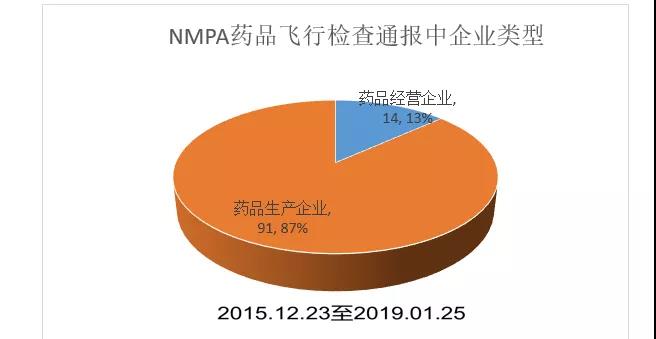
药品飞检期间,NMPA共通报了约105次。其中药品经营企业的通报次数为14,药品生产企业的通报数为91。飞检检查原因中有5次提到是知情人主动举报触发。

3 地域省份分布
被飞检通报次数最多的三个省份分别是吉林、湖北以及河北省。这三个地区均在药品生产企业国内排名前十的省份之中(前十省份的药企占比约为全国总数的55%)。
4 药品飞行检查中缺陷分布
4.1. 按生产企业类型分类
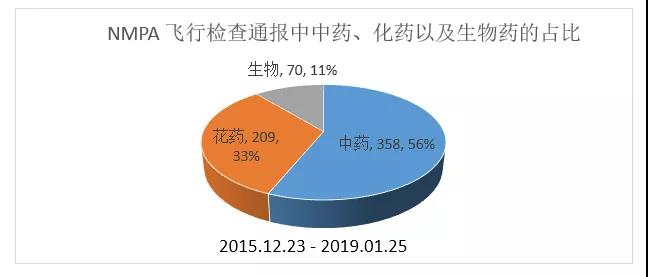
药品飞行检查共发现缺陷项约637条,其中中药相关缺陷占比56%,化药占比33%,生物药占比11%。中药缺陷占比较高,与传统作坊式中药/中药材生产的方式,药食同源的多重管理模式以及GMP在中小型中药企业的执行程度不足有关。其次,中药材、道地药材的供应不确定性,生产设备设施的落后,批量问题导致规模化效应较低也是中药企业缺陷高发的原因。
4.2. 检查缺陷在GMP章节的分布
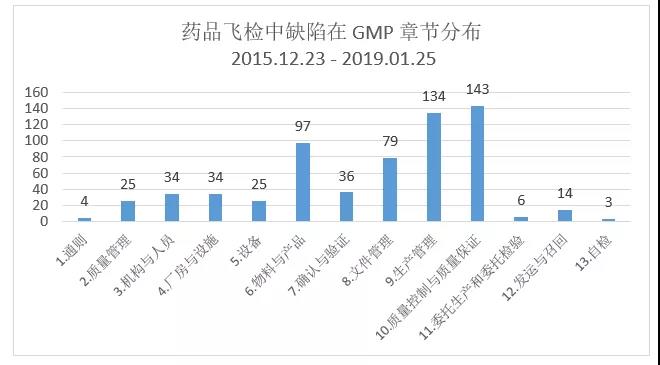
药品飞行检查通报中发现的缺陷项,在GMP章节中占比最高的四个是:章节10-质量控制与质量保证;章节9-生产管理;章节6-物料与产品以及章节8-文件管理。
4.3. 缺陷在生产企业中职能部门分布
GMP规范是一个QA统领的跨部门协作体系,虽然所有的问题都可以归结于QA的经验不足、体系建立不完善以及管理的缺失。考虑到实施主体是各个职能部门,统计时为反应各部门的主观性,将缺陷统计在发现的部门内。
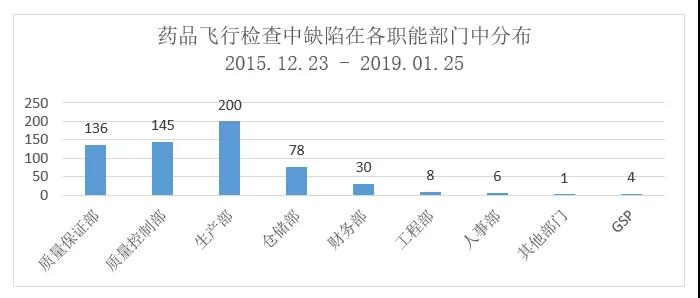
缺陷的部门分布显示:生产部、质量控制部与质量保证部是缺陷发生的三个主要部门,接下来是仓储部与财务部。这些具体缺陷会在第5章节 缺陷汇总分析中进行着重论述。有趣的是,财务部门缺陷也有较高的占比,这些缺陷大多是物料/产品收支台账不一致的问题,如:
1、财务报表中显示的货款与产品生产中实际使用的物料的量不符。
2、财务报表中显示的货款与产品生产、销售批量不符。
3、无物料、产品的购销凭证。
4.4. 缺陷内容的具体分析
数据可靠性、物料管理与计算机化系统是药品飞行检查通报中三个主要缺陷项,详细的分析参见章节5.
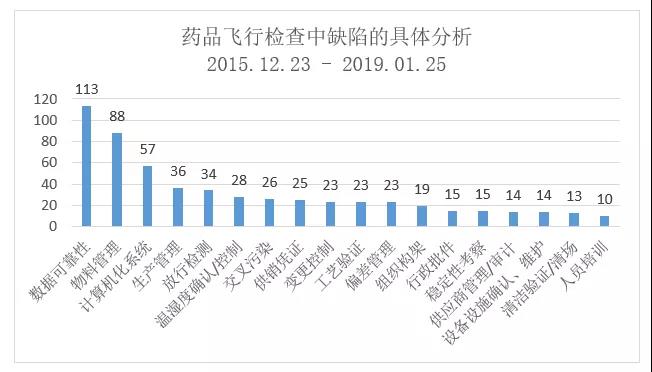
5 缺陷汇总分析
5.1. 数据可靠性
2015年07月22日,CFDA对公布了一份《关于开展药物临床试验数据自查核查工作的公告》,此公告揭开了业内关于药品临床实验均一次性通过的遮羞布,也是对药品注册疯狂期问题批件的一个整顿。同年,CFDA发布了《数据可靠性征询意见稿》,把实验数据的自查扩展到了整个医药行业,这也是飞检通报中数据可靠性问题占据首位的历史因素。
数据可靠性总结来说即ALCOA-CCEA的数据管理要求,即:
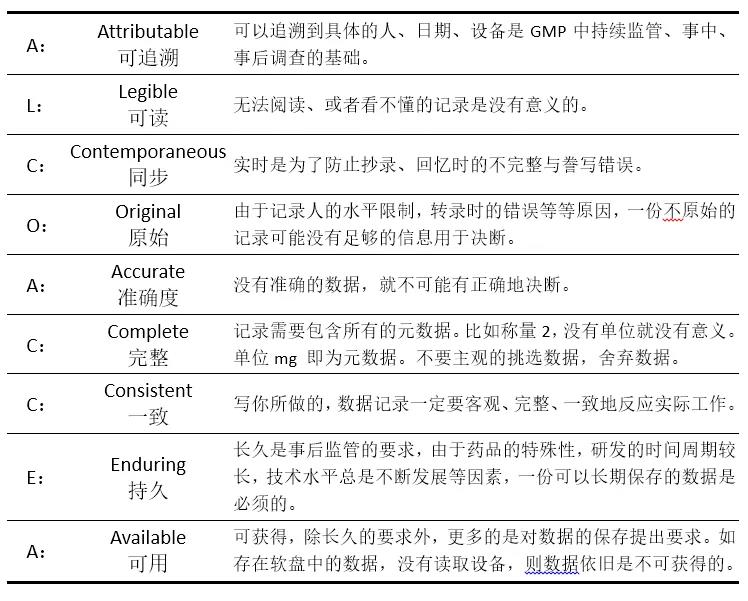
飞检中数据可靠性缺陷主要有:
1、实验室、车间、仓库的计算机化系统权限不合理,包括但不限于无账号分级管理,系统时序错乱。
2、实验室、车间、仓库记录的缺失,无检测记录文件,无生产记录文件。如:物料管理文件显示有产品被实际生产/放行,但生产与检测记录文件缺失。
3、虚构供货商信息。
4、检测记录与图谱数据不符;生产物料、批量记录与仓储记录不符;采购销售数据与财务数据不一致。
5、生产设备的实际产能与批记录不匹配;仓储的大小与批生产记录中的产能不匹配。
6、公司存在多套生产、检测、仓库以及财务记录。
7、标准检验规程、批检验记录、批放行记录没有复核以及质量负责人签字。
这些问题,大致可以归结为以下两点原因:1)企业人力不足,无法有效地执行与管理日常GMP工作。2)企业追求利润,从而替换/省略掉部分工艺程序。例如:未按照注册工艺生产,应该浸提后使用提取液的直接使用药材粉末;直接采购产品进行分装,贴标销售;使用非正规/合格供应商物料。
5.2. 物料管理
物料管理涉及的有仓储与生产部门,主要缺陷有:
1、物料账、物、卡不一致或者缺失。
2、物料未分区存放,存在交叉污染的可能。
3、物料、成品的储存区域温湿度不符合要求,超有效期或者变质。
4、批生产记录中,没有物料平衡信息;仓储与生产的物料不平衡;仓储与销售台账不平衡;采购台账与供货商销售台账不一致。
标识、出入库台账、防止交叉污染以及满足物料存储要求是仓储部门的主要工作。清晰的标识、货物卡以及放行标签是防止物料混淆,过期物料/未放行物料被用于生产的基本措施。
防止物料的交叉污染,则是对仓储分区管理、取样管理的要求。如:不同批次品种间无间隔的存放;取样室无清洁程序;取样器具混用等均会导致交叉污染。
无法满足物料的储存要求,主要体现在仓储的大小不满足生产批量的要求,仓库的温湿度控制不满足要求(见章节5.6),这一点主要是老旧厂区不愿意进行硬件改造有关。
物料的不平衡,也是NMPA飞检检查中缺陷的高发区。这里的平衡不仅仅是生产线上的物料平衡,还有尾料/废料的管理,采购与生产使用的平衡,生产批量与销售批量的平衡。这些不平衡出现的原因有有人员管理、文件管理的疏忽,有批放行记录包不包含仓库台账审核的因素,有伪造供应商货物信息还有贴标销售的违规因素。
5.3. 计算机化系统
计算机化系统与数据可靠性的缺陷存在部分重叠,如:计算机化系统数据与纸质数据的不一致;计算机化系统数据的丢失;离职账户依旧在被使用的问题。此处还有一些个性问题:
1、计算机化系统无权限分配,或者是权限不合理,无审计追踪功能也没有其他有效的控制措施。
2、计算机化系统没有经过确认与验证。
3、计算机化系统的数据没有定期进行备份与还原,或者未对此操作进行确认。
4、计算机化系统,如QC实验室色谱仪、光谱仪、仓库物料管理系统以及生产设备的时序错乱。
计算机化系统的确认与验证以及权限分级在《药品记录与数据管理规范》中有明确的要求。这是保证药品生产、经营企业中电子数据准确性的前提。需要指出的是,即使是主流的色谱数据管理软件,如沃特世的Empower 3色谱软、微软的EXCEL组件,也需要进行验证的。
如:Empower 3软件中人员的权限就有120多条,如何配置软件,配置后的软件是否按需运行,是确认的一部分。EXCEL软件中可编辑区域、修改权限的确认、计算准确性的确认以及修约规则与纸质文件的一致性等,均需要确认文件来支持。
对数据进行定期的备份与还原,在《药品记录与数据管理规范》中也有明确的要求。这里的数据不仅包含电子数据,也包含纸质文件的扫描备份。现场检查时,文件被烧,计算机化系统损坏导致数据无法查看,备份盘损坏等,均无法再作为数据不可获得的借口。
计算机化时序的混乱,一般被认为与补写,编造记录相关。电脑操作软件与其他功能性软件的账号分级管理,可减少一线人员主观更改系统时间戳的可能。
5.4. 生产管理
生产控制的缺陷中,实际生产与注册工艺不一致是主要问题。由于早期药品注册的无序与混乱,按照注册工艺无法生产,或者是成本居高不下,促使药品生产企业在处方中非法添加填充剂、粘合剂,使用劣质、非合格供应商物料,使用粉末替代提取物,改变工艺,随意变更批量等时有发生。这些典型的缺陷有:
1、改变料液的搅拌模式。
2、湿热灭菌改为辐照灭菌,湿热灭菌改为煮沸,终端灭菌改为非终端的无菌生产工艺。
3、浸膏时按照多倍批量进行投料,然后分成亚批(备案批量)进行后续生产。
4、处方中擅自添加淀粉与糊精,或者是改变处方比例。
5、猪脑干渣替代猪脑进行提取。
6、批生产记录中设备型号与实际生产的不一致。
7、生产过程中未记录温湿度、光照强度信息。
8、批生产记录不能反映完整的工序操作。
5.5. 放行检测
放行检测主要来自于QC实验室的缺陷,这些缺陷来自于人员资历不足以及GMP管理的缺失。包括:
1、未按照操作规程进行系统适用性检查。
2、物料、产品未进行检测,或仅进行部分检测即用于生产或者销售。
3、放行检测中存在挑选数据的嫌疑,对于超标超趋势内容未进行偏差调查。
4、仅有检测报告单,无检测原始数据。委托检测无原始数据、图谱。
5、红外光谱仪上多批次的吸收光谱图完全一致。
6、色谱系统数据与纸质数据不一致。
5.6. 温湿度控制
主要缺陷来自于仓储部门以及货物运输中的不符合,包括:
1、无法有效的控制环境温湿度。
2、温湿度超标的偏差调查缺失,或者是不合理。
3、无温湿度监控数据、无巡检内容。
环境温湿度的短期偏离,可以基于产品性质在管理程序要求报告或者监控即可。过高的偏离程度与时间应启动偏差调查,并进行详细的评估或者进行额外的稳定性考察。这个偏离程度应根据物料/产品的理化稳定性与稳定性数据而定。对于一些特殊产品,温度控制应该有一个严格明确的上限要求,如:冻干产品温度偏移超出了塌陷温度。
需要特别指明的是,常温库在中国药典中是有明确温度要求的(10℃-30℃),而不是随四季温度变化的不控温库。
5.7. 交叉污染
防止交叉污染是GMP的另一大核心内容,交叉污染的来源一般有:物料储存不当;取样器具的清洁不合理;物料/产品的储存容器清洁不合理洁净区级别控制不当;批间清洁、清场程序不合理或者未严格执行;使用回收溶剂;清洁剂残留等内容。
污染的种类有:其他辅料残留;其他活性成分残留;微生物污染;残留溶剂;灰尘;清洁剂等。
药品飞检通报中相关缺陷包含:
1、生产用乙醇罐密封不严,内部存在黑色异物,被污染。
2、共线生产时未进行风险评估与清洁验证,或者是清洁验证用物料不能代表其他产品残留的最差情况。
3、高活性车间与一般车间共线生产。
4、生产用原辅料中存在异物与污染问题。
5、车间墙面、地面破损,设备与地面存在难以清洁的粉尘。
6、设备清洁不彻底,干燥箱托盘、设备履带、切刀上存在残留药材。
7、固体口服车间地漏未按照要求定期清洁与消毒。
5.8. 变更控制
GMP管理活动不是一成不变的。由于设备的更替,厂房设施的变动,生产工艺的优化,检测方法的升级以及GMP条例更新等原因,药品生产活动必然存是一个发展变化过程。由于药品的特殊性,这些变化内容均需要进行变更控制,来详细的评价变化对最终产品质量的影响。
《药品上市后变更管理办法(试行)》、《上市化学药品生产工艺变更研究技术指导原则》,化药的技术性变更一般分为三级:微小变更(I级)、中等变更(II级)以及重大变更(III级),不同的变更需要进行对应的理化、临床学研究,且接受省局或者是国家局的备案,审批管理。
需要注意的是,在变更中滥用风险评估工具,仅依据经验却忽视实验数据支持是一种危险的做法。良好的风险评估应该是:首次评估→确认风险点→改进/预防措施→实验数据支持→确认风险降低到可控范围→结束评估。
药品飞行检查通报中关于变更控制的缺陷有:
1、变更未获得批准的情况下,按拟变更后的场地、工艺进行生产。
2、生产设备、车间布局等发生了重大变更,做了相关的验证,但未申报备案,质量管理部门亦未进行变更管理。
3、生产工艺、设备发生变更未进行验证与备案。
4、变更批生产记录中设备的参数范围以及收率标准,未进行评估。
5、生产批量变更,未进行验证与备案。
5.9. 工艺验证
除上述“变更控制”章节中涉及的工艺验证缺失外,此处涉及的还有以下缺陷:
1、工艺验证的参数无法覆盖实际生产参数范围,验证的批量不足,验证时的检测指标不全。
2、仅对同一品种的部分规格、部分批量进行了工艺验证。
3、工艺验证方案不合理,总混物含量均匀度未确认取样位置与取样量。
4、工艺规程的变更无相关研究数据或者验证资料支持,无稳定性相关考察。
5.10. 偏差管理
偏差文件的质量与数量是GMP管理科学性与有效性的体现。药品生产活动较为复杂,对偏差进行合理的分级,可以减轻各职能部门的工作负担,提高整体工作质量。如何分级则需要各个职能部门充分讨论后制定,基于是否影响产品有效性、安全以及质量可控的角度进行分级。
偏差管理的另一个问题是调差不充分,纠正与预防措施(CAPA)不合理。偏差调查的深度、广度以及影响范围与调查人员的经验水平相关,其涉及到跨部门协作,一个多部门的专家委员会在偏差调查中是十分有必要的。
药品飞行检查中关于偏差管理的主要缺陷包含:
1、不合格的检测结果未发起偏差调查即放行。
2、不合品的偏差调查中,没有原料药供应商的现场审计,也未对已售产品进行召回。
3、企业没有任何偏差、超标准(OOS)以及CAPA程序。
4、生产与检测设备故障不在偏差管理程序中,如灯检仪故障,无偏差记录。
5、返工未充分评估返工过程对产品质量产生的影响,也未对产生返工的原因进行充分调查。
6 总结
从上述的药品飞检通报结果来看,大多数缺陷还集中在GMP是否被良好实施的层面上,少部分则是实施的科学性问题。
生产营销为王是药企早期的主流文化,在这种企业文化下,质量管理与技术水平提高被放到次位。2015年之后,食品药品监督管理局意识到了国产药品质量低下的问题,积极施政,引导药企向技术水平、管理水平的比拼上发展。这在药品集采环境中体现的尤为重要,今后的飞检中真实性问题,必将成为历史。
其次,笔者在汇总NMPA网站药品飞行检查数据时,遇到较多阻碍。包括检查报告的格式的不统一;表格的布局不完全相同;某些检查通报只有合格不合格的结论;药品飞行检查通报中仅有8页约149条结果。希望NMPA网站在药品飞检通报一栏中做的更加易于阅读,便于大家及时了解监管动态,并及时提高自身的管理水平。
<END>



















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论