
前记
最近笔者在复习FDA关于亚硝胺杂质的有关法规,发现在2021年3月29日至30日FDA有过一个关于亚硝胺杂质的研讨会,由FDA的药品审评和研究中心(CDER)组织全球的研究专家参与。相关内容在FDA官网可以找到。在微信上搜索了一下,没有找到相应的中文文章或者内容解读,于是笔者对这两天研讨论会内容仔细阅读之后,转译中心内容,以飨读者。限于笔者水平有限,如有不足,请多指正。
亚硝胺杂质污染事件已经过去近3年,但FDA和其他国际监管机构仍面临许多挑战。一是亚硝胺的形成来源广泛分布于新鲜蔬菜、水果、烟熏和烤肉和鱼中的环境中,在水中、空气中,并且人体内也有内源性生成。因此,消除或减少药物中的亚硝胺物质面临很大挑战。消除药物中的亚硝胺杂质始于质量控制。到目前为止,并不是所有药物中亚硝胺杂质产生的根本原因都已查明;新的根源不断出现。稳定性、辅料赋形剂和药品储存条件等因素也会影响亚硝胺的形成,从而阻碍亚硝胺杂质的减少和控制措施。
另一关键问题是制药从业人员需要开发和验证高灵度分析方法,以检测药物中低水平的亚硝胺。此外,在确定药物中亚硝胺的安全性和致癌风险时,还要考虑到药物短缺、疾病状况和患者的人群数,以及消除亚硝胺杂质污染所需要资源。癌症风险评估和亚硝胺可接受摄入量(AI)的确定非常复杂。亚硝胺属于ICH M7关注队列(CoC)中的化合物,这是一类高度致突变致癌物,需要严格控制其含量。癌症风险评估是基于整个寿命期限的暴露量,每10万人中有1例癌症病例的外推计算,这被认为是可接受的保守风险控制水平。
由于它们的高度致突变致癌性质,亚硝胺化合物在20世纪60年代已被广泛研究。在啮齿类动物生物测试中测试了300种亚硝胺,发现90%以上的亚硝胺具有致癌作用。这类化合物诱导癌症的作用机制目前尚不完全清楚,化合物结构—活性关系有助于确定致癌性的结构特性,亚硝胺在各种器官和组织中可引起肿瘤:例如,肝脏、肺、鼻腔、食道、胰腺、胃、膀胱、结肠、肾脏和中枢神经系统。
通常,亚硝胺被生物活化成为活性中间体,这些活性中间体与生物细胞靶点相结合,并导致DNA损伤;这一作用过程在动物和人类中基本相似。与需要代谢活化的亚硝胺不同,一些N-亚硝基化合物不需要生物活化,可直接与DNA结合并烷基化,从而导致突变,最终导致癌症。作用机制不明确、化学成分复杂,缺乏可靠的致癌性数据,使得亚硝基类化合物的风险评估和确定复杂化。
FDA提出七个问题,并由研讨小组的专家成员讨论。它们涵盖药品质量制造和控制、亚硝胺的环境暴露、内源性形成、药代动力学、反应性、暴露的生物标志物、定量结构-活性关系、原料药和制剂中的单亚硝胺和多亚硝胺、低于寿命(LTL)的方法和暴露持续时间、癌症风险和风险评估,以及表征药物中亚硝胺杂质存在风险的确证性研究差距分析。

图1: 亚硝胺相关的事件和产品
Q1. Whatare the endogenous levels of nitrosamine formation in human and rodents? Onceformed, what is the rate/kinetics of elimination? What are the conversion ratesin the liver, circulation levels in blood, and normal variations? If this informationis not available, can it be determined experimentally?
问题1:人类和啮齿类动物体内中内源性生成的亚硝胺物质形成的水平是多少?形成后,消除的速率/动力学是什么?肝脏的转化率、血液循环水平和正常变化水平是多少?如果这些信息不可获取,可以通过实验确定吗?
专家讨论:
除了环境中有丰富的亚硝胺物质外,亚硝胺也会在动物体内源性生成。为了计算这类化合物的风险,需确定亚硝胺内源性生成和了解其在体内分布的药代动力学。目前对亚硝胺的内源性生成,尤其是NDMA的内源性形成的认识存在相当大的差距。尚不清楚亚硝胺的内源性生成是否超过、等于或小于药物中检测到的水平。专家小组成员强调确定内源性生成对评估风险的重要性,并建议尽快开始实验工作。一些专家小组成员表示,无论内源性接触的风险如何,外源性亚硝胺都会带来额外的风险。
亚硝异丙氨酸是一种未经代谢且不致突变或致癌的亚硝胺。服用脯氨酸加亚硝酸盐或硝酸盐的受试者的尿中亚硝酸盐的排泄量增加。同时服用不同浓度的前体、L-脯氨酸和亚硝酸钠后,大鼠体内形成亚硝异丙氨酸的剂量-反应关系,结果表明,亚硝异丙氨酸形成量的对数与脯氨酸剂量乘积和亚硝酸盐剂量平方的对数成正比。然而,关于许多反应性致癌亚硝胺(例如NDMA和NDEA)的可靠数据很少,因为它们代谢迅速,其代谢产物的分布和排泄尚不清楚。假设NDMA和NDEA是作为其前体(分别为二甲胺和二乙胺)内源性生成的,它们与亚硝酸盐和硝酸盐一起存在于食品中。然而NDMA或NDEA代谢迅速,难以对其进行定量评估。NDMA和许多其它亚硝胺主要由细胞色素P450 2E1代谢,由于存在其它的底物,该酶受到竞争性抑制。因此,如改变组织器官对亚硝胺物质的代谢、分布和排泄,要考虑多种因素和风险评估。根据血液和尿液中NDMA的检测,只能粗略估计NDMA的内源性形成。
来自暴露于大量甲基化化合物的啮齿类动物的数据显示,低剂量的NDMA是血液白细胞中O6-甲基鸟嘌呤的有效产生物质。考虑到人类接触的甲基化剂,可以合理地得出结论,人体组织中的这些O6-甲基鸟嘌呤加合物主要是由NDMA引起的。在啮齿类动物和猴子中使用O6-甲基鸟嘌呤DNA甲基转移酶消耗剂量的NDMA进行的研究显示,不同物种血液中加合物积累的剂量反应曲线具有可比性(斜率在5倍以内),而在大鼠、猴子和人类中,血液中O6-甲基鸟嘌呤的修复率相似。在大鼠慢性NDMA暴露期间,O6-甲基鸟嘌呤稳态水平的剂量反应是线性的,与人类血液DNA中发现的加合物水平相对应的慢性暴露量为982μg/天(最大)或144μg/天(O6-甲基鸟嘌呤的平均背景水平)。
现实生活中“正常”食用食品和药品或环境的外源性的亚硝胺物质的暴露量也应确定,以提供从内源性生成的暴露量的评估角度。专家小组成员认为,内源性亚硝胺形成的暴露可能高于食物等外源性来源的暴露量。一般来说,在不同国家和文化背景下,每天从食物中接触的剂量估计小于1μg。鉴于目前评估受亚硝胺污染药物风险的紧迫性,确定亚硝胺内源性形成是一个长期目标,应考虑其他方法。例如,基于生理学的药代动力学建模、测量作为暴露生物标志物的O6-甲基鸟嘌呤加合物,以及结合(Q)SAR进行定量。
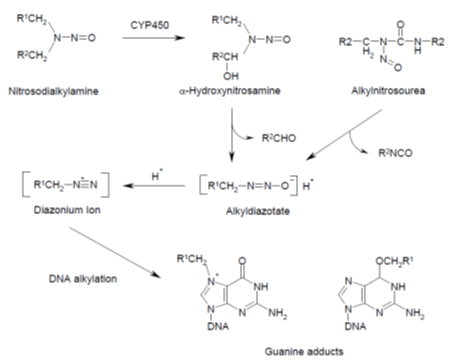
图2:N-亚硝基化合物的代谢活化
Q2. Can nitrosamines be classified? If yes, what isthe basis of their classification? For example, could they be classified basedon:
• Carcinogenic potency?
• Chemical structure, e.g., aliphatic vs.cyclic?
• Chemical reactivity? Direct alkylating agentsvs. indirect (require metabolism)? Adduct formed, e.g., O6-, N7-methylation?
• Other?
• Why would you choose this basis ofclassification?
Ifclassification is not possible, is it feasible to calculate a single acceptableintake (AI) value for nitrosamines; i.e., a class-specific limit, using theexisting carcinogenicity study results of ≥110 nitrosamines (irrespective ofstudy quality)?
问题2:亚硝胺可以分类吗?如可以,它们的分类依据是什么?例如,它们是否可以根据以下内容进行分类:
•致癌活性?
•化学结构,例如脂肪族与环状?
•化学反应性?直接烷基化剂与间接烷基化剂(需要代谢)?形成加合物,例如O6-,N7甲基化?
•其他?
•为什么选择这种分类基础?
如果无法进行分类,是否可以计算亚硝胺的单一可接受摄入量(AI)值;比如特定类别的限度,使用现有110多个亚硝胺化合物的致癌研究结果(不考虑研究质量)?
专家讨论:
超过90%的已知亚硝胺化合物是致癌物质,其活性跨越几个数量级。它们通过不同的给药途径(在某些情况下,相同的肿瘤通过不同的途径)在40种动物的多个器官中导致癌症。同样的亚硝胺在不同的动物物种中也会引起不同的肿瘤,并且在短时间(包括单次剂量)和长时间的暴露后,亚硝胺的潜伏期也不同,这种多样性阻碍了亚硝胺化合物的分类。
专家小组成员表示,亚硝胺可以分类,但首先需要解决几个研究上的空白。基于现有的数据,一个简单的分类方式是可将亚硝胺分为致癌物和非致癌物。基于致癌活性的分类更为复杂,一般使用半数致肿瘤剂量(TD50)进行分类,它来自于黄金致癌性活性数据库(CPDB)的数值,专家认为,在缺乏其它替代方式的情况下,这种方法最为合适。
或者分类也可基于这类化合物的结构。一些亚硝胺没有致癌性,例如含有叔丁基、亚硝化氨基酸或支链的亚硝胺。此外,分类可以基于质子化的程度(pKb值),质子化会降低化合物的生物利用度,从而降低生物活性。此外,亚硝胺可根据其化学反应性分为直接和间接烷基化亚硝基化合物。例如,亚硝基脲是直接烷基化剂,不需要代谢活化。
基于基准剂量-下限(BMDL),例如1%或5%,以及安全边际作为分类依据进行了讨论。BMDL使用剂量反应信息,TD50使用单剂量估计来推断给定的风险水平。专家成员认为,BMDL通常是首选方法。然对于亚硝胺,TD50是最佳的致癌风险评估方式。基于TD50值的SAR建模,结合专家知识,并根据需要补充经验数据,显示分类的前景。在专家知识评估中必须考虑几个参数,例如,立体电子因素及其对α-羟基化速率、中间重氮离子半衰期和碳离子反应性的影响。其中一些参数是基于预测,降低了对模型结果的信心。
例如,使用有效的亚硝胺AI或基于模型和1:100000癌症风险的评估计算,根据Lhasa/Leadscope对TD50值的重新评估,欧洲药品管理局(EMA)对NDEA采用了18ng/天的限度要求。18ng/天和26.5ng/天的差异很小。亚硝胺可根据TD50的范围进行分类(例如,<1、1-10和10-100 mg/kg);超过100 mg/kg的化合物可能会被舍弃,因为其不在药物污染的危险范围内。TD50的计算也存在缺陷,因为研究的设计和暴露量持续时间不一致,涉及的动物数量少,或剂量少于最佳剂量。
目前对亚硝胺进行分类是困难的,因为缺乏必要的支持性数据。例如人类的N-亚硝化反应性、DNA加合物的形成、与DNA的结合、ADME以及与其它动物的比较。这些可以通过比较亚硝胺在啮齿类动物的癌症靶器官和非靶器官中诱导的O6烷基化或其他致突变DNA损伤与相应的人体组织/细胞中的损伤来测试。这种方法可以使用替代生物标记物,报告相关的生物转化步骤,如血红蛋白的烷基化作为长期生物标记物(平均暴露3-4个月),或谷胱甘肽的烷基化,随后在尿液中排泄巯基尿酸作为短期生物标记物。
通过Ames试验进行致突变性测试是确定化合物潜在致癌性的第一步。然而,亚硝胺化合物之间的诱变活性之间相差四到五个数量级,与类似的致癌活性不相关。例如,NDMA和NDEA的细菌致突变性相似,但后者是一种更强致癌物。一个可靠的风险评估是需要了解其致癌机制,目前尚不能完全做到。并不是所有亚硝胺都能引起O6鸟嘌呤甲基化。如果一种化学物质与DNA碱基的氧形成加合物,如O6-甲基鸟嘌呤,它很可能是一种有效的致癌物。DNA加合物的形成或DNA损伤的诱导可被用作致癌活性(或风险评估)的标记物。
因此,一些亚硝胺化合物可能无法归类。在获得实验数据之前,根据化合物的TD50值以及专家对其代谢和与DNA反应性的判断来评估这些化合物。亚硝胺的另一个重要方面是它们的反应性。关于反应性和致癌活性之间的相关性,目前几乎没有数据。然而反应性可以使用灵敏和定量的方法进行测量,例如,高分辨率质谱法。另一种分类方法是贝叶斯概率建模,其中当前数据与SARs和生物标志物或代谢数据相结合,以预测概率。另一种是类似于ICH M7中使用的毒理学关注阈值方式,但特定于亚硝胺,亚硝胺在基于TTC的关注队列中,被排除在这类分类方式之外。有数据显示,亚硝基化合物会导致胎盘癌变,这是接触亚硝胺污染药物的孕妇的一个担忧。同样未知的是CYP450和其他参与生物转化的酶缺乏个体的风险评估数据。
总之,如果不了解亚硝胺在人体内的代谢、代谢酶的效率(速率、组织和血液中的含量)、人体DNA修复能力、致癌的作用机制、反应性水平、稳定性和DNA结合,就不可能对亚硝胺进行可靠的分类。目前所有这些参数的数据都缺乏或者不足,在这种情况下,亚硝胺可以通过相对不精确的基于结构的建模进行分类。

图3: 胃肠道中硝酸盐循环图
Q3. The carcinogenic potential of nitrosamines isdose and duration dependent:
• Is there an in vivo exposure level fornitrosamines to define low vs. high risk for carcinogenicity? Is it appropriateto calculate a no observed effect level (NOEL) dose for carcinogenicity? Whatare the criteria to do so (Ames negative, in vivo mutation assay negative,other)?
• Can LTL approach as described in ICH M7 beused to determine the AI of a nitrosamine if a drug is indicated for a shortduration of use?
问题3:亚硝胺的致癌性取决于剂量和持续时间:
•是否可用体内暴露量水平来定义亚硝胺致癌性的低风险与高风险?计算无观察效应水平(NOEL)的致癌剂量是否合适?这样计算的标准是什么(Ames阴性、体内突变试验阴性、其他)?
•如果一种药物只可能短期被使用,ICH M7中描述的低于预期寿命(LTL)的方法能否用于确定亚硝胺的可接受剂量(AI)?
专家讨论:
研究表明,剂量—响应到转变为无毒性,亚硝胺物质表现出逐渐的变化。在低剂量下呈曲线剂量反应和S形曲线,重要的是要确定药物剂量率,即两次剂量之间的间隔,以及它如何影响DNA修复。早期研究表明,癌症发病率与年龄无关。但事实上,当对不同预期寿命的动物给予相同剂量的NDEA时,所有动物都以相同的速度和时间发生肿瘤。LTL方法(ICH M7)对亚硝胺化合物适用性的问题包括模型从长持续时间到短持续时间外推的可靠性、模型敏感性以及剂量-反应曲线的形状(非线性与阈值)。这些都是讨论LTL时要考虑的重要问题。专家成员认为使用NOEL计算亚硝胺的限度是不合适的,它不能用于计算致突变并致癌的杂质限度水平。
参考Peto大鼠生物测定法(大于4000只大鼠),其中低剂量下的剂量-反应曲线呈线性,没有阈值。DNA加合物的水平支持了这种线性。因此,癌症生物测定和加合物形成结果产生了线性剂量反应,没有得到阈值的证据,因此未确定NOEL。这些发现是在啮齿类动物身上获得的,目前尚不清楚这种模式是否适用于人类。
化合物Ames试验阴性后应进行体内致突变性试验,单一的体外突变试验不足性评估亚硝胺化合物的致癌性。体内突变试验虽不能预测体内癌症的可能性,但更具生理上相关性。此外,暴露水平的持续时间和剂量也很重要。DNA加合物剂量反应的线性可能会,也可能不会诱发突变。突变诱导需要几个步骤,其中一些步骤是有毒的(例如细胞死亡),而另一些步骤则进行突变。发生突变和发生癌症之间也有几个步骤,任何一个步骤的失败都会阻止癌症的发生。因此,仅DNA加合物的形成不足以证实致突变或致癌症。大多数亚硝胺经标准Ames试验呈阳性,但在某些情况下,阳性率取决于方案,NDMA在大鼠S9中呈阴性,但在仓鼠S9中呈阳性。此外,大鼠、小鼠和仓鼠S9的化学反应也不同,也没有使用人类肝脏S9的此类数据。
如果亚硝胺通过标准或优化(仓鼠S9,30%S9)的Ames试验呈阴性,则必须进行体内基因突变试验和基于专家知识的评估,以确定亚硝胺化合物的中间亚硝化、反应性和稳定性。加上支持性证据,如预期(来自SAR)的吸收、分布、代谢和排泄(ADME)的行为(在尿液中排泄的亚硝化氨基酸),才能用来支持非致突变亚硝胺不太可能致癌的前提。
另一个问题是什么程度的亚硝胺暴露水平可以降低癌症风险?这取决于具体的亚硝胺物质。当然,对于NDMA或NDEA,毫克水平的暴露是不可接受的,但对于非代谢性、非致突变性和非致癌性的硝基异丙氨酸,毫克量是可以接受的。因此,必须具体案例具体分析。
普遍认为LTL方法可适用于计算亚硝胺作为短期使用药物中的限度水平。致癌是累积剂量和DNA损伤的函数;然而其他因素(如细胞增殖、凋亡、代谢和修复)也与此有关。对于DNA加合物的形成,剂量反应在很大范围内是线性的,因此,短时间的高暴露与长时间的低暴露具有相当的风险,因为这两者与DNA损伤相关的整体寿命暴露水平是相同的。1:100000的癌症风险是保守的,短期内风险的轻微增加是可以接受的。
然而,对于短时间内的高暴露量,与致癌有关的其他因素(增殖、代谢辅助因子、DNA加合物)的剂量反应尚不清楚。因此,对于亚硝胺而言,LTL适用性的答案并不像短期高暴露的效果与长期低暴露的效果相似那样简单。在短时间内暴露于高剂量亚硝胺时,必须考虑DNA修复能力。
如上所述,专家提醒儿童使用受亚硝胺污染的药物,并建议纳入安全因子(SFs)。ICH M7不包括SFs,FDA食品和应用营养中心(CFSAN)也没有调整更长的寿命。后者使用模型从饮食习惯调查中估计特定食物的消费量。美国环境保护署(EPA)不评估水果中的致癌杂质,但使用SFs来确定食品中农药的限量。在短期癌症研究中,当短时间给药时,新生小鼠的反应与大鼠不同。这是在儿童药物中使用LTL评估亚硝胺杂质应注意的事项。
Q4. Howwould the risk assessment change when multiple nitrosamines are present in adrug product? What are the key variables to consider when conducting such riskassessments? (nonmutagenic carcinogen + mutagenic carcinogen; nonmutageniccarcinogen + weakly mutagenic carcinogen; multiple mutagenic carcinogens).
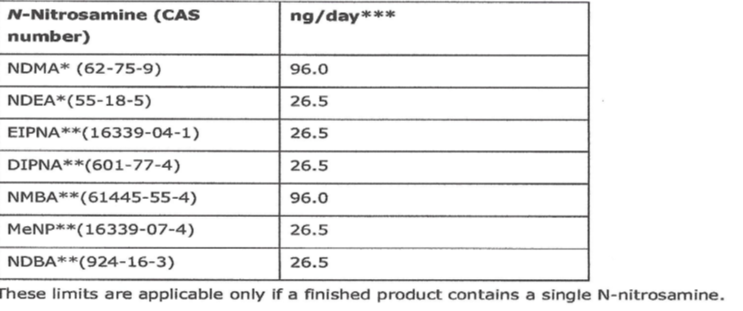
图4: 药物中常见7种亚硝胺杂质的可按受限度水平
问题4:当一种药品中含有多种亚硝胺时,风险评估会发生怎样的变化?在进行这种风险评估时,需要考虑哪些关键变量?(非致突变致癌物+致突变致癌物;非致突变致癌物+弱致突变致癌物;多重致突变致癌物)。
专家讨论:
自污染事件报告以来的两年半时间里,多个亚硝胺已被确定为单一原料药和制剂中的杂质。目前尚不清楚药代和DNA加合物修复是否受到影响,考虑到其它亚硝胺来源的暴露水平,以及它们的影响是加和还是协同的,多种亚硝胺在一起具有类似的代谢活化和作用机制、效力和反应性,目前这些机制都不为人所知。如有足够的数据(结构相似性和差异性)支持(Q)SAR预测,则可以比较这些参数,并对类似亚硝胺的数据进行分组。
具有相同作用机制的亚硝胺可能具有不同的活性效力;在这种情况下,向高活性亚硝胺中添加低活性亚硝胺的影响尚不清楚。专家成员讨论了累积风险评估在亚硝胺中的应用。欧洲食品和安全管理局(EFSA)对农药残留进行了大量研究。例如,在混合物中,是否存在致突变或非致突变化学物质无关紧要。如果其中一种化学物质是致癌物质,则该信息将可用于计算可接受水平(AI)的信息,即风险将是相加的,或者使用最有效的亚硝胺数据来计算AI。亚硝胺的混合物会导致酶激活和修复的竞争,这不是低分子量亚硝胺的问题,因此在这种情况下,加和性效应假设可能不合适。
专家小组重申需要关注亚硝胺的外源性和内源性形成的最新信息。这些信息对于风险评估和可接受水平的准确计算至关重要。然而,大多数可用数据都是20-50年前的数据,此后发生了很大变化,包括饮食习惯、暴露和分析方法。与食物中的外源性接触相比,药物中作为杂质的亚硝胺水平可能微乎其微,与内源性水平相比更是如此。然而,这一估计是基于旧数据,因此可能不准确。相比之下,有关食品中亚硝胺的数据更为及时,食品行业在过去几十年中取得了很大进步。
最近关于食品中硝酸盐、亚硝酸盐和亚硝胺含量的研究报告了极少量的硝酸盐、亚硝酸盐和亚硝胺;亚硝胺为0.2-0.4μg/天,全球范围内小于1μg/天。专家成员强调通过良好生产规范(GMP)进行质量控制,并了解原料药和制剂中每种化学物质的化学成分,以消除或减少药物中的亚硝胺。
专家讨论了几种用于暴露水平测试的生物标志物,可用于风险评估,包括DNA加合物、MGMT和代谢建模。专家成员认为DNA加合物是最佳的评估模型,因为目前的分析技术(例如,高分辨率质谱)的高度敏感和可靠,许多以前的问题现在都可以解决了。然而,仅使用DNA加合物作为亚硝胺暴露量水平测试的生物标记物是不合适的,还需要了解亚硝胺的作用机制。DNA损伤对亚硝胺致癌性至关重要,而O6甲基化是NDMA的相关加合物。DNA甲基化作为一种致癌机制已被广泛研究。然而并不是所有的亚硝胺都会发生甲基化;因此,O6甲基化不是唯一的作用机制位点,其他位点(如O4、N7)和其他机制也应研究。
因为食物和内源性亚硝胺的暴露水平,以及加合物的形成,人们对亚硝胺的DNA加合物的定量研究表示担忧。加合物的分离很重要,已完成和正在进行的人体研究测量了服用受亚硝胺或其他来源污染的药物后尿液中的总亚硝胺,结果显示NDMA水平非常高,进一步调查表明,分析方法存在缺陷,说明一种方法并不适用于所有物质的测试。
Q5. Shouldthe regulatory limits for nitrosamines listed for food and water or, amountformed endogenously, be considered in determining AI of nitrosamines in drugs?
问题5:在确定药物中亚硝胺的可接受水平时,是否应考虑食品和水中所列亚硝胺的监管限度,或内源性形成的亚硝胺水平量?
专家讨论:
患者服用药物治疗疾病,产生预期受益。在多数情况下,这不是一个个人的选择,而是一种治疗方案。美国公众希望他们的药物是安全的。然而人们可以选择吃什么和喝什么。据之前的讨论,相比外源性摄入,亚硝胺及其前体的内源性形成可能是其暴露水平的重要来源。除了亚硝胺,为了估算总饮食中的摄入量,硝酸盐和亚硝酸盐摄入量的计算至关重要。小组成员认为,在亚硝胺风险评估和可接受水平测定中,应考虑所有来源的摄入量。专家再次强调了准确评估亚硝胺内源性形成的必要性。如果数据显示内源性水平含量高出几个数量级,那么从数值风险评估的角度计算可按受水平并不困难。与内源性暴露水平不同,外源性暴露有很多新旧信息,亚硝胺的摄入量可能与0.2–0.5μg/天和<1μg/天相似。
此外,亚硝胺内源性形成的测定非常重,许多因素如饮食习惯和整体健康(炎症、感染)都起到了作用。如果来自除药物污染以外的所有来源的接触量都很大,那么药物中存在的少量亚硝胺的健康风险就变得微不足道。如果这些来源被认为是背景,尤其是内源性形成,无论是大的还是小的,它们都应该被认为是对普通人群背景癌症风险的贡献。例如,根据Kyrtopoulos博士的数据,144μg/天的平均内源性形成量将转化为NDMA约1%的癌症风险作为背景发病率(人类终生癌症总发病率为30–40%)。传统的和M7癌症风险评估是基于1:100000,这是普通人群癌症风险的增量,即忽略背景发病率。如果内源性暴露被高估(即不超过100μg/天),那么药物污染的增量暴露就变得更加显著,因此在药物中亚硝胺的风险评估或可接受水平,不应考虑来自其他来源的接触。
有人支持仅基于亚硝胺在药物中的存在进行亚硝胺增量风险评估。这是因为内源性生成的亚硝胺可能致癌。30–40%的自发肿瘤负荷可能是由于内源性形成的亚硝胺。如果这样,就没有准确确定亚硝胺污染药物带来的额外癌症风险的基线。然而,基于TD50的风险计算是评估内源性和外源性暴露的最佳方法。
专家成员表示,亚硝胺的结构应包括在风险评估中。多数可用数据都是关于NDMA和NDEA的,当药物中其它亚硝胺已被确定为污染物时,认为所有亚硝胺的风险水平是相同的并不合适,因为它们的生物效应可能不同,因此应采用正确的化学方法避免接触此类亚硝胺。
有人就旧数据是否可用于确定某些亚硝胺的内源性形成,并根据当前的饮食摄入信息进行推断发表了评论。例如,人们对亚硝基异丙氨酸的内源性形成进行了大量研究,亚硝基异丙氨酸未经代谢,排泄时未发生变化。当人们服用硝酸盐(400毫克)和脯氨酸(500毫克)时,尿中亚硝基异丙氨酸的生成量为纳摩尔。这一发现与已有20年历史的几项关于亚硝异丙氨酸的研究相似。
专家小组成员建议,未来的流行病学研究应包括亚硝胺前体含量丰富和缺乏的饮食。然而,集体暴露水平很难被忽视,有报告称,亚硝胺的单一最高来源是烟熏肉、烟熏鱼和烤肉,它们还富含多环芳烃和其他致癌物。因此,在流行病学研究中应考虑其他来源。然而亚硝胺水平的数值变化不到一个数量级,从而强调了使用外源性暴露量进行风险评估的可靠性。
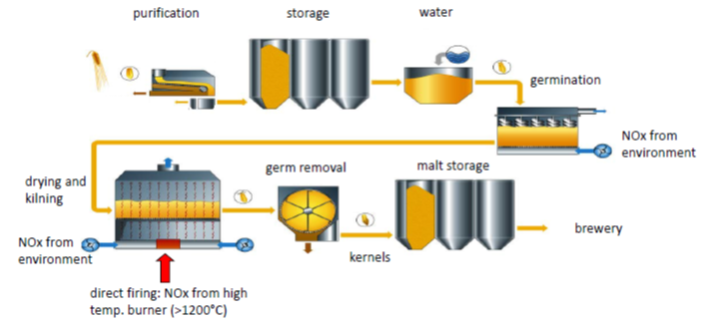
图5:啤酒中麦芽胺与亚硝基反应形成亚硝胺的过程
Q6. In theabsence of data and based on identified differences in NA chemistries andreactivities, can read-across for structural similarity to related compounds beused for NAs? What are the key parameters to consider when conducting (Q)SARassessments for NAs?
问题6:在缺乏数据的情况下,根据已确定的亚硝胺化学性和反应性的差异,相关化合物的结构相似可读性可用于亚硝胺吗?当对亚硝胺进行构效关系评估时,需要考虑哪些关键参数?
专家讨论:
化学结构相似性的计算机模拟和预测已经取得了很大进展。由于亚硝胺在体外和体内行为的多样性,对这类化合物致突变性和致癌性的构效关系预测的可靠性提出了质疑。一般来说,计算机方法的优势,尤其是构效关系的建模,是快速和廉价并且不使用动物。然而这是一种推理和预测,其确定性不如实验数据,需要深入的专业知识来进行解读。
首先,与其他化合物相比,亚硝胺的致突变性和致癌性已有很多数据。在美国EPA 化合物毒理数据库和其他资源(如ChEMBL和PubChem)中,可以找到超过140种亚硝胺的毒性数据。这些信息是否采用有用的格式,即是否可以轻松检索和使用,需要进一步考虑。
第二,分子相似性,这是一个非常主观的概念。监管机构(EPA、欧洲食品安全局、欧洲化学品管理局和经济合作与发展组织)已经发布了这方面的指南。对于亚硝胺,需要进行亚分类以实现区分,这需要了解它们的反应性和化学性质。这些知识可以记录为结构和效力警示。此类警示基于链长、亚硝胺官能团周围的α/β取代以及吸电子基团的存在。
第三,通过可读等方法来证明预测可接受性。在某些情况下,可能需要实验数据来支持结果。需要更多的证据来解读阴性无毒或低毒化合物,这与Ames试验的阴性结果相似,但人们更容易接受对阳性结果的解读预测。
构效关系预测模型是基于分子结构描述的物理化学性质的定量预测。对于亚硝胺,应使用CPDB的致突变性数据,以亚硝胺为组建立构效关系预测模型。这些预测需要对反应性有很好的理解,最终模型应该与作用机制相关。亚硝胺的情况并非如此,因为有大量关于高活性亚硝胺的数据,但关于低活性亚硝胺的数据很少;然而,有几种方法可以解决这个问题。辛醇-水分配系数(logp)的对数与TD50之间没有相关性,因此需要其他描述符,如反应性活性。
一位与会者询问,当从一种亚硝胺推断到另一种亚硝胺时,是否应考虑分子量,因为EMA的单一值18ng/天是基于一个小分子NDEA。专家成员不建议这样做,因为许多被取代的侧链大亚硝胺被代谢并分解为低分子量化合物;可以使用摩尔数。一个大的亚硝胺化合物不一定具有较少的致突变性或致癌性,在做出这样的结论时必须谨慎;例如,二丁基亚硝胺在膀胱中比更小分子量的NDMA更有毒性,后者是一种有效的肝致癌物。有许多高分子量亚硝胺是高致癌物的例子。
Bucher博士和他在国家环境健康科学研究所的团队最近使用机器学习和Opera软件对亚硝胺进行了研究,根据物理化学性质创建了模型。超过700种化合物的数据来自CPDB数据库,但仅限于129种亚硝胺。结果经过五次交叉验证,与上述讨论类似,(Q)SAR模型需要更多信息来更好地区分高致癌活性和低致癌活性的亚硝胺。因此,对致癌活性的一般预测是可能的,但由于亚硝胺数据库缺乏多样性,其用途尚不清楚。
有人建议确定为什么非致癌亚硝胺没有活性。可能的原因包括衰老和与DNA的相互作用,但也有代谢的原因。一个微不足道的结构修改可以显著影响活性。例如,如果连接叔丁基(取决于其相对于亚硝胺部分的位置),则该化合物呈现为非活性。另一个例子是等距取代亚硝基化合物:N-甲基亚硝基吡啶在吡啶环的2ʹ、3ʹ和4ʹ位置上有三种异构体被取代。吡啶2ʹ位的取代被预测为致突变和致癌,而其他位置的取代则不是。这是异构体不同活化和失活的结果。另一个例子是西咪替丁,它的亚硝化形式在体外是致突变的,但在啮齿动物体内不是致癌的,因为它优先经历代谢失活,说明了代谢的重要性。
Q7.Nitrosamines can be formed during manufacturing of the active pharmaceuticalingredient (API) and/or DP. What are possible approaches to reduce nitrosamineformation during manufacturing? Can nitrosamines be eliminated completely fromAPI and/or DP?
问题7:亚硝胺可在活性药物成分(API)和制剂的生产过程中形成,生产过程中减少亚硝胺生成的可能方法有哪些?亚硝胺能从原料药和/或DP中完全消除吗?
专家讨论:
亚硝胺作为杂质可在原料药或制剂中生产的不同阶段、储存和包装期间生成,以及随着时间的推移作为降解物形成。因此,它们的检测、存在和去除一直是监管机构和药品制造商面临的挑战。自污染事件报道以来,我们学到了很多,我们对所有可能的形成途径的理解仍在不断发展。药物结构和化学成分都很复杂,对合成过程中的每一步进行控制和深入了解至关重要,药物制造商必须进行全面思考。这一过程必须经过深思熟虑,并考虑到每一种可能性。如果存在亚硝胺形成的风险,必须制定检测策略。
亚硝胺污染可能与药物合成途径无关,就像缬沙坦。对于缬沙坦来说,问题在于溶剂二甲基甲酰胺,它被加热到高温,促进二甲胺的形成。后者在亚硝酸盐的存在下发生猝灭反应,亚硝酸盐的添加目的不同,导致NDMA的形成。因此,这是副反应的副反应,而不是直接污染。
另一个可能的来源是供应链。如果药品制造商使用回收或回收的含有亚硝胺的溶剂,然后再用于药品制造。另一个方面是药物的稳定性。在某些情况下,由于不稳定,亚硝胺的含量会随着时间的推移而增加,例如雷尼替丁。一个意想不到的来源是包装或印刷中的硝化纤维素。硝化纤维素是一种强硝化剂,在欧洲的化妆品行业中已被发现并被解决。
亚硝化反应可以在适当条件下,即在仲胺或叔胺、亚硝酸盐或亚硝酸存在下,在化学反应的任何步骤中发生。这种情况下,必须采取措施,通过适当的去除方法,通过测试验证,消除该过程发生,或将亚硝胺的生成降至最低。如果不可能消除形成亚硝胺的步骤,则应尝试在合成过程中提前移动该步骤,并在生产原料药之前进行清除。
通过在同一生产步骤中不使用仲胺或叔胺加酸(例如亚硝酸)或消除其中一种来源,可以将亚硝胺的形成降至最低。即使这些来源不在同一步骤中,它们也可能在几步之后形成,并导致意外的亚硝胺形成。另一个潜在来源是含有残留胺的原料药,这些胺通过流化床干燥排出。因此药物生产过程中必须始终遵循GMP,如果难以消除这类杂质,则需要进行多学科(药理学/毒理学、临床、药物短缺和依从性)效益风险评估,以减少亚硝胺污染的可行性。
由于分析方法的灵敏度不断提高,可以检测到极低水平的亚硝胺,因此很难说完全从药物中消除亚硝胺杂质,风险效益比将使用迄今为止的所有可用数据以及确定的知识差距研究结果来确定。在大多数情况下,药品中的亚硝胺可以通过GMP、良好的化学知识、合成路线的修改、亚硝胺形成来源的消除以及对整个生产过程的全面了解来消除。如果不能从药物中消除亚硝胺,则需要进行风险效益分析。在某些情况下,评估风险可能是比使用资源更合适的方法。在这种情况下,应考虑患者群体、药物短缺和临床替代方案。制造业和技术的进步使食品工业几乎消除了亚硝胺。因此,药物也可以实现这一点,但这需要时间,需要收集大量数据。
小结
亚硝胺的内源性形成从20世纪60年代末的初步研究开始,到20世纪90年代结束。内源性形成的亚硝胺、亚硝酸盐和硝酸盐在代谢上相关,通过还原、氧化和循环在血液和组织中转化为活性亚硝胺,然后作为尿硝酸盐排泄。为了确定风险,必须提供有关其内源性形成的定量数据,了解亚硝胺的药代动力学。
对亚硝胺进行分类将有助于根据活性和反应性进行风险评估和分组。然而在涉及40余种动物的研究中,大多数亚硝胺都是潜在的致癌物,很少是非致癌的。如此广泛的活性限制了它们的分类。尽管如此,还是提出了一些分类方法。最简单的方法是根据现有信息将其分为致癌物和非致癌物。根据CPDB的TD50值进行分类被认为是目前的最佳方法。其他建议包括将亚硝胺按<1、1-10和10-100 mg/kg的TD50值进行分类。
国际监管机构正在讨论将ICH M7中的LTL应用于受亚硝胺污染的短期药物,以防止召回药物,并允许患者在益处大于风险时继续使用。然而亚硝胺的LTL方法在全球并不被接受。从FDA的角度来看,这是因为亚硝胺属于关注队列化合物,为高致突变和致癌的化学物质,这些化学物质在药物中受到严格控制。从高剂量到低剂量推断时,此类化学品的剂量效应曲线未知。为了替代LTL方法,FDA实施了一种灵活的方法,允许将高于AI的值作为临时限值,同时使用1:100000的癌症风险进行评估。
大多数亚硝胺是致突变的,经标准Ames试验呈阳性。在某些情况下,标准Ames测试呈阴性,但使用不同的测试条件又呈阳性。专家成员一致认为,Ames阴性试验本身不足以证明亚硝胺的非致突变性。应使用不同的条件进行改良Ames试验;如果结果为阴性,则应进行体内致突变性试验。如果后者也是阴性,则必须进行专家知识和全面评估。在得出亚硝胺的非致突变性结论之前,应彻底评估其致突变性,因此一些亚硝胺是非致突变但致癌的,工业界必须小心。
参考文献:
1.Nitrosaminesas Impurities in Drugs; Health Risk Assessment and Mitigation Public Workshop,FDA网站
2. Control ofNitrosamine impurities in Human Drugs, FDA, February, 2021.
<END>





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论