
受政策、市场、技术等多方面因素影响,近年来,罕见病逐渐成为各大企业争相布局的领域,与之对应的“孤儿药”因其市场需求高、竞争相对较小,一度被认为是“重磅炸弹的摇篮”。罕见疾病从过去企业避之不及的冷门领域成为如今的兵家必争之地。
一、罕见肾病迎来重磅新药
前述榜单中恰恰就涉及到了一些极具潜力的罕见病治疗药物。其中,美国生物制药公司Travere Therapeutics正在开发的Sparsentan是全球首款也是目前唯一一款用于治疗罕见肾脏疾病的口服双效内皮素-血管紧张素受体拮抗剂(DEARA),选择性靶向内皮素A(ETA)受体和血管紧张素II亚型1(AT1)受体。该药目前被开发用于治疗IgA肾病(IgAN)以及局灶节段硬化性肾小球肾炎(FSGS),有望遏制疾病进展,填补治疗空白。
2023年2月17日,Travere Therapeutics宣布美国FDA已加速批准FILSPARI™ (sparsentan)用于减少有快速疾病进展风险的原发性IgA肾病(IgAN)成人患者的蛋白尿,这些患者普遍尿蛋白与肌酐比值(UPCR)≥1.5 g/g。该药是目前首款也是唯一一款获批用于治疗这一疾病的非免疫抑制疗法。
根据药融云数据www.pharnexcloud.com/?zmt-mhwz及企业公开信息,Sparsentan此前已在美国和欧盟获得治疗IgA肾病的孤儿药资格认定,并在美国获得优先审评资格。此外,欧洲药品管理局(EMA)已在2022年8月受理Sparsentan的有条件上市许可,预计将于2023年下半年做出审查决定。
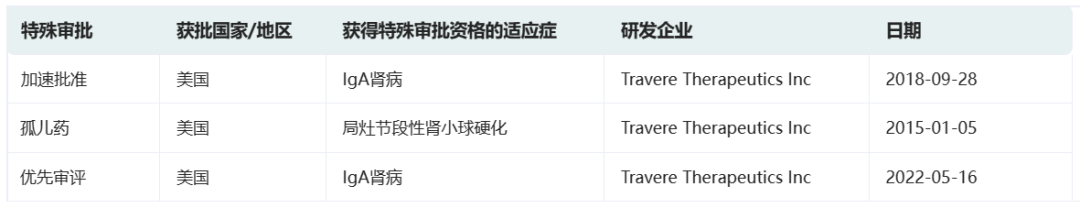
截图自药融云数据库
二、为何值得关注?
01.青壮年的“噩梦”
● IgA肾病也称伯杰氏病(Berger’s disease),是一种罕见的进行性肾脏疾病,其特征是免疫球蛋白A(IgA)在肾脏中积聚引起肾脏炎症,破坏肾脏正常过滤机制,从而导致血尿、蛋白尿和肾功能的进行性丧失。该病是原发性肾小球肾炎最常见的类型,也是导致慢性肾脏病和终末期肾病(ESKD)的重要原因。该病高发于25~39岁,在亚洲人和白种人中更为常见,据估计IgA肾病在美国影响超10万人。约30~40%的IgA肾病患者会进展至终末期肾病。
● 局灶节段硬化性肾小球肾炎(FSGS)是一种罕见的蛋白尿性肾脏疾病,是儿童和成人肾病综合征(NS)常见的原发性肾小球疾病,可引起肾脏的进行性瘢痕化,常导致终末期肾病。原发性FSGS通常影响25~30岁左右的患者。大多数患者在20~36个月内复发,30~60%的患者在5~10年内最终进展为终末期肾病,还有40%的患者在经过肾移植之后仍然复发。该病在美国影响约4万名患者。
上述两种罕见肾病是肾病领域具有重大未满足需求的疾病,也是疾病管理最具挑战性的疾病之一。有研究显示,仅有19%的IgA肾病患者以及8%的FSGS得到了最佳的疾病管理。当前的治疗方案主要是对症治疗,通常将糖皮质激素与肾素-血管紧张素-醛固酮系统抑制剂(RAASIs)进行联用,但这些疗法常带来严重副作用。因此亟需安全、有效、耐受性好的药物来保护肾脏功能或减缓肾小球滤过率(GFR)的进行性下降。
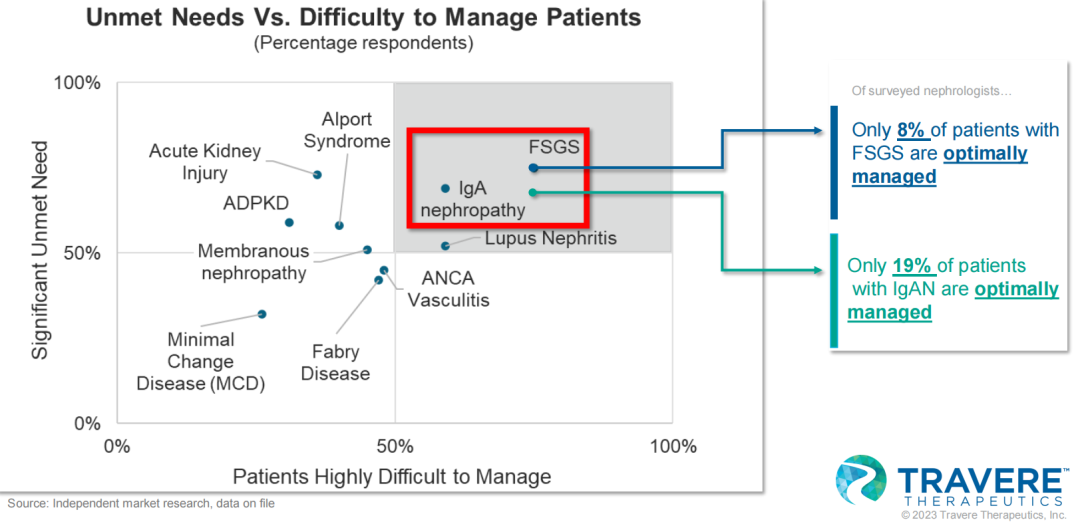
02.首款双效拮抗剂
临床前数据表明,阻断ETA和AT1通路可以在罕见慢性肾脏疾病,如IgA肾病(IgAN)和局灶节段硬化性肾小球肾炎(FSGS)中减少蛋白尿,保护足细胞,并防止肾小球硬化。
针对IgA肾病,Travere Therapeutics围绕Sparsentan开展的关键3期PROTECT试验是迄今为止最大的IgAN领域头对头干预性研究。公司此前已在2021年8月16日公布积极中期数据。与阳性对照厄贝沙坦(Irbesartan,血管紧张素II受体拮抗剂)治疗组相比,治疗36周后,Sparsentan治疗组患者蛋白尿水平比基线减少了3倍以上。公司当日股价上涨超15%。
而对于局灶节段硬化性肾小球肾炎(FSGS),公司开展了关键3期DUPLEX试验,并于2021年2月2日公布积极中期数据。与阳性对照厄贝沙坦组(26%)相比,治疗36周后,Sparsentan组患者达到部分缓解的比例显著增加(42%)。FSGS部分缓解终点(FPRE)定义为尿蛋白与肌酐比值(UP/C)≤1.5 g/g,且UP/C比基线降低40%以上。公司当日股价上涨超11%。
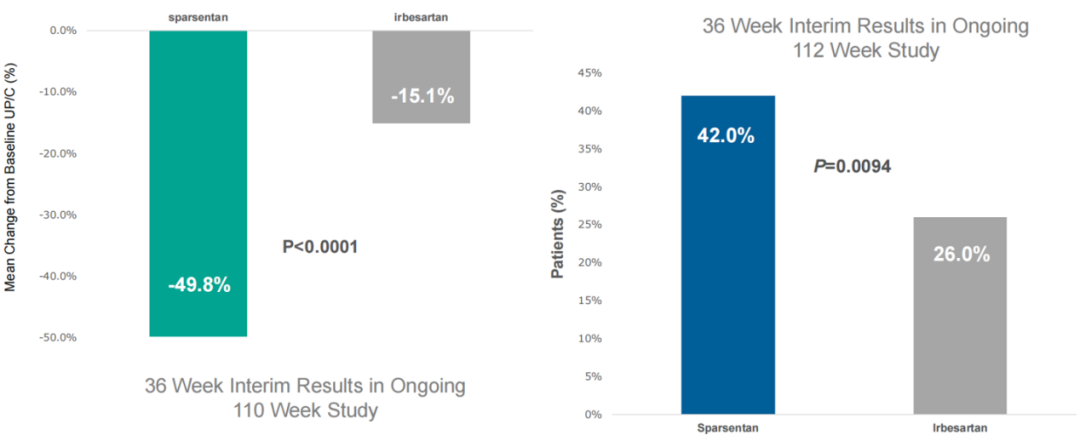
对于IgA肾病,美国FDA此前加速批准了Calliditas Therapeutics的TARPEYO(布地奈德)缓释胶囊,并于2022年Q1推向市场。不过作为首款获批用于治疗IgA肾病的非免疫抑制疗法获批,如果Sparsentan的试验数据最终能够证明其对肾功能的保护作用,那它或将比TARPEYO更具优势。
如果这两种适应症都获得批准,Sparsentan将可能是市场上首款针对IgA肾病和FSGS都有效的治疗方法。
基于中期分析结果,Travere Therapeutics早前于2022年上半年向美国FDA递交Sparsentan的加速批准申请,用于治疗IgA肾病。不过在2022年10月,公司宣布FDA要求公司更新其拟议的药品风险评估和减轻策略(REMS),将Sparsentan的肝脏监测包含在其中,从而与某些已获批的内皮素受体拮抗剂产品保持一致。因此该药原先定于2022年11月17日的PDUFA日期延后3个月至2023年2月17日。
03.许可与合作
值得一提的是,Sparsentan由Travere Therapeutics(当时称为Retrophin)在2012年引进自美国制药公司Ligand Pharmaceuticals,后者是license-out模式的典型代表。根据协议,Ligand获得100万美元的预付款,并可根据临床和监管进展获得超过7500万美元的里程碑付款,以及基于未来产品销售额的9%的特许权使用费。
2021年9月,Travere Therapeutics与血制品巨头CSL旗下的Vifor Pharma公司达成许可协议。根据协议,Vifor获得Sparsentan在欧洲、澳大利亚和新西兰的独家商业化权利,Travere获得5500万美元的预付款,并有资格获得1.35亿美元的监管和市场准入里程碑付款,除此之外还可获得商业化里程碑和基于净销售额的分层特许权使用费。
三、Travere专注罕见疾病
Travere Therapeutics(NASDAQ GS: TVTX)是一家总部位于加利福尼亚州圣地亚哥的生物制药公司,专注于为患有罕见肾脏、肝脏和代谢疾病的人群研发改变生命的疗法。该公司针对具有重大未满足医疗需求的罕见疾病,创建了包含多个后期临床项目的创新管线。
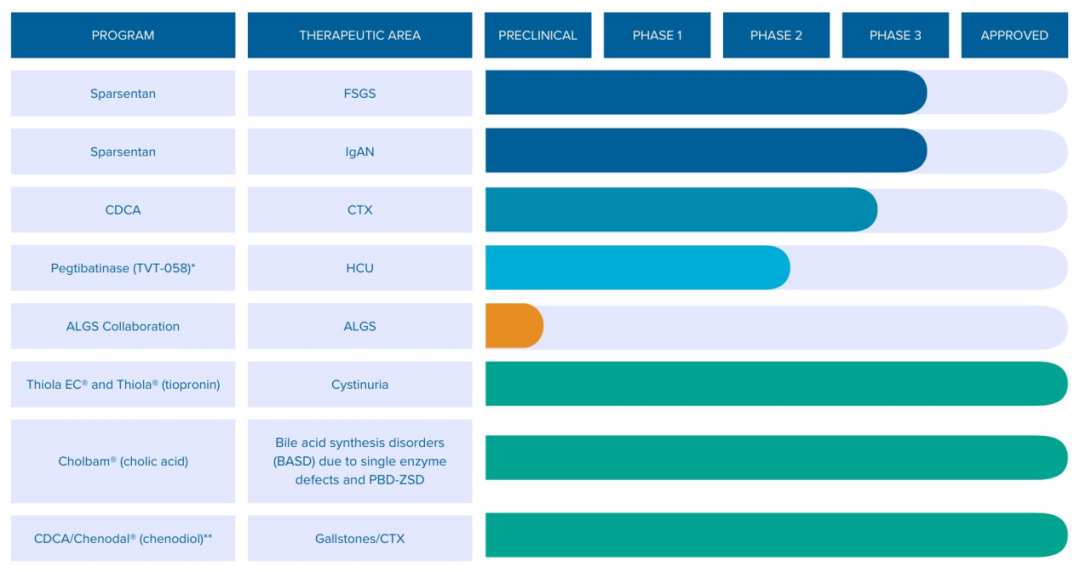
除前文提到的核心资产Sparsentan之外,Travere还拥有2款处于临床阶段的候选产品。
01.临床阶段项目
Pegtibatinase(TVT-058)是一款在研的新型酶替代疗法,来自于公司在2020年11月收购的Orphan Technologies。Travere正在将其开发用于治疗经典型高胱氨酸尿症(HCU)。该病是罕见的常染色体隐性遗传病,由胱硫醚β合成酶(CBS)基因突变引起,导致CBS活性缺失,同型半胱氨酸(Hcy)代谢分解异常,从而在体内累积,可引起视力、骨骼、循环和中枢神经系统并发症。25%的HCU患者在16岁前出现血栓栓塞事件,在29岁前出现概率为50%。据估计,在美国至少有3500名HCU患者。目前尚无针对该病遗传学病因的治疗方法获批。Pegtibatinase是一款经聚乙二醇化修饰的重组人CBS酶替代疗法,有潜力成为治疗经典HCU的首款疾病修正治疗(DMT)药物。
药融圈旗下药融云数据显示,Pegtibatinase已被美国FDA授予罕见儿科疾病用药认定、快速通道资格、突破性疗法称号,并获得了美国和欧盟授予的孤儿药资格认定。

截图自药融云数据库
2021年12月,Travere公布了针对Pegtibatinase开展的1/2期COMPOSE试验的积极顶线结果。在12周的治疗期间内,患者总同型半胱氨酸(tHcy)水平呈剂量依赖性降低。最高剂量组按每次1.5mg/kg,每周两次Pegtibatinase治疗,可使总同型半胱氨酸(tHcy)水平在12周内快速持续降低,相对基线平均降低55.1%,并将tHcy维持在100μmol的临床意义阈值以下。Travere预计将在2023年第四季度启动Pegtibatinase的3期试验。
除此之外,Travere生产的胆结石治疗药物Chenodal(鹅去氧胆酸,CDCA)在30多年来一直被认为是脑腱黄瘤病(CTX)的标准治疗药物,但目前该适应症尚未获得监管批准。Travere开展了一项关键3期临床以评估Chenodal在成人和儿童CTX患者中的疗效,从而支持向FDA提交Chenodal用于CTX的NDA申请。2022年9月,FDA授予Chenodal治疗CTX的快速通道资格。该药来自于公司在2014年收购的Manchester Pharmaceuticals。
2023年预期里程碑:
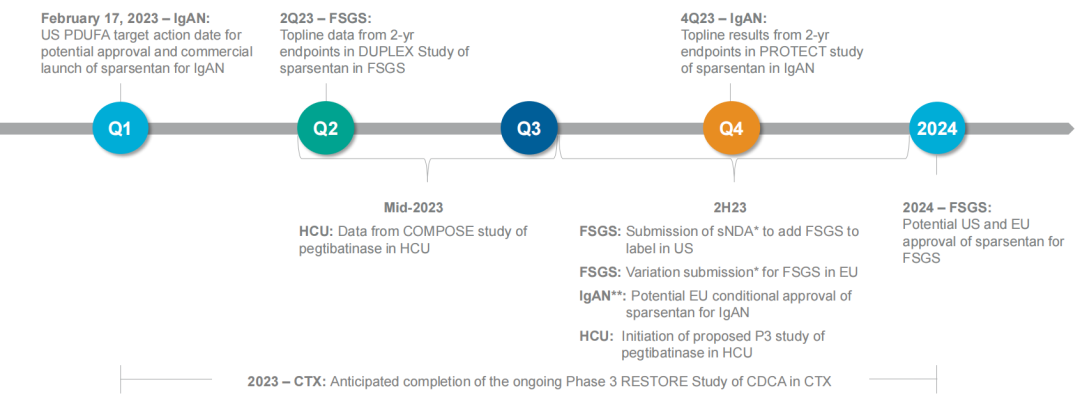
02.临床前研究
针对临床前研究,Travere正在与美国国立卫生研究院的国家转化科学推动中心(NCATS)和患者组织Alagille综合征联盟合作,旨在识别治疗Alagille综合征(ALGS)的潜在小分子疗法。Alagille综合征是一种累及多系统的显性遗传性疾病,患者肝内胆管发育不良,是具有表型特征的慢性胆汁淤积的最常见原因。目前还没有治疗ALGS的药物获批。同时,据披露,公司已不再针对NGLY1缺乏症开展小分子治疗药物项目。
03.已获批上市产品
● Thiola(硫普罗宁)
用于治疗胱氨酸尿症,公司在2014年从私人持有的Mission Pharmacal收购了该药在美国和加拿大的权利。2019年推出肠溶片剂Thiola EC(硫普罗宁片)。
● Cholbam(胆酸胶囊)
用于治疗因单一酶缺乏而导致的胆汁酸合成障碍,以及过氧化物酶体生物合成障碍(齐薇格谱系障碍)的辅助治疗。该药由公司在2015年收购自Asklepion Pharmaceuticals。
● Chenodal(鹅去氧胆酸,CDCA)
用于治疗可透过射线的胆囊结石,并被作为脑腱黄瘤病(CTX)的标准治疗药物(该适应症尚未获得监管批准)。该药来自于公司在2014年收购的Manchester Pharmaceuticals。
四、从Retrophin到Travere
由上述产品管线可以看出,Travere Therapeutics当前产品组合皆为收购得来。该公司先前名为Retrophin,专注于严重罕见疾病药物,公司前CEO是争议人物Martin Shkreli,当时他利用Retrophin频繁收购老药并提高药价,此举使得他成为“全美最招恨的人”。2014年,Retrophin董事会将Martin Shkreli解雇并在2015年对他提起诉讼。2017年,Martin Shkreli因证券欺诈罪被判入狱7年。2022年,联邦法院裁定其终身禁入制药行业。
Martin Shkreli离开公司后,Retrophin继续以其专业性和科学实力维护其在生物医药领域的地位。2020年11月,公司宣布更名为Travere Therapeutics,反映了公司坚定不移地致力于帮助患者应对罕见病的生活,并与患者一起开辟新的道路,带来希望和创新,并以此纪念公司的卓越发展。

目前公司战略:
- 专注于具有严重未满足医疗需求的罕见疾病治疗药物开发
- 采取严格的决策标准以评估潜在in-licensing候选药物,从而建立可持续发展的产品管线
- 建立加强商业化能力,有效支持产品的商业推出
- 倾听患者声音
- 支持早期诊断
五、财务业绩
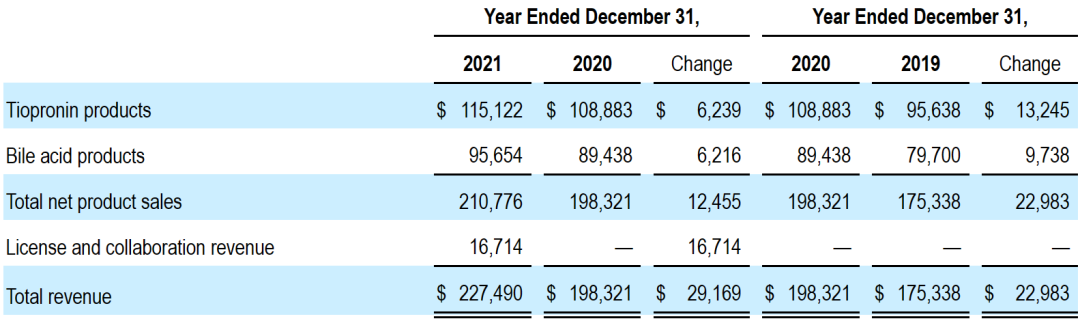
2021全年Travere Therapeutics公司总收入为2.275亿美元,包括2.108亿美元的产品净销售额(+6%)和1670万美元的授权与合作收入。全年研发费用为2.103亿美元,销售、一般及行政开支为1.499亿美元,总运营开支为3.893亿美元。
按照产品划分,公司全年硫普罗宁产品(Thiola和Thiola EC)业绩为1.151亿美元,胆酸产品(Chenodal和Cholbam)业绩为9565万美元。
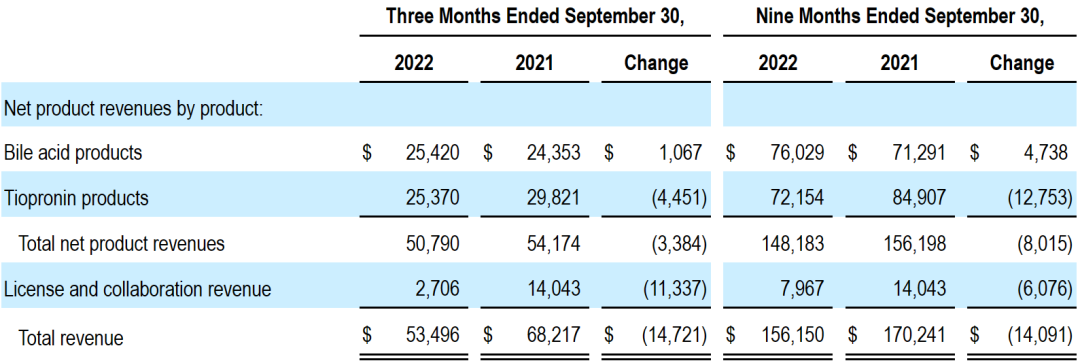
2022年前三季度公司总收入为1.562亿美元,包括1.482亿美元的产品净销售额(-5%)和796.7万美元的授权与合作收入。前三季度研发费用为1.755亿美元,销售、一般及行政开支为1.573亿美元,总运营开支为3.559亿美元。
公司前三季度胆酸产品业绩为7603万美元,硫普罗宁产品业绩为7215万美元。
公司预计2022全年产品净销售额约为2.01亿美元。截至2022年第三季度,公司拥有现金、现金等价物和有价证券总计5.063亿美元。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据,vip.pharnexcloud.com/?zmt-mhwz;
FDA/EMA/PMDA;
相关公司公开披露(除标注外,正文图片均来自企业官方);
https://ir.travere.com/;
https://clarivate.com/drugs-to-watch/drugs-to-watch-listing/sparsentan/;
https://www.niddk.nih.gov/health-information/kidney-disease/iga-nephropathy;
https://www.calliditas.se/en/calliditas-therapeutics-announces-commercial-availability-and-initial-sales-of-tarpeyo/;
https://ir.travere.com/news-releases/news-release-details/ligand-licenses-dara-program-retrophin;
https://www.viforpharma.com/us/vifor-pharma-and-travere-therapeutics-announce-licensing-agreement-commercialization-sparsentan#;
https://www.fiercebiotech.com/biotech/retrophin-announces-acquisition-of-exclusive-right-to-purchase-cholic-acid-from-asklepion;
https://www.benzinga.com/government/21/11/23904774/wall-street-crime-and-punishment-martin-shkreli-the-self-destructive-pharma-bro;等等。
想要解锁更多药企信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论