

2022年3月18日,驯鹿生物发布全新品牌LOGO,与此同时公司简称由“驯鹿医疗”正式变更为“驯鹿生物”。该公司成立于2017年3月,是一家专注于细胞治疗和抗体药物开发和产业化的创新生物制药公司。驯鹿生物以开发血液肿瘤细胞类药物和抗体药物为创新的基石,向实体瘤和自身免疫疾病拓展,拥有完整的从早期发现、注册申报、临床开发到商业化生产的全流程平台能力及包括了全人源抗体发现平台、高通量CAR-T药物优选平台、通用CAR技术平台、生产技术平台、临床转化研究平台在内的多个技术平台。
01 融资情况
- 2018年3月完成A轮6000万人民币融资;
- 2019年10月获得高瓴资本B轮独家投资6000万美金;
- 2020年8月完成1.08亿美元C轮融资。
02 研发管线
驯鹿生物专注于自主开发细胞治疗及抗体药物。
驯鹿生物产品信息(部分)
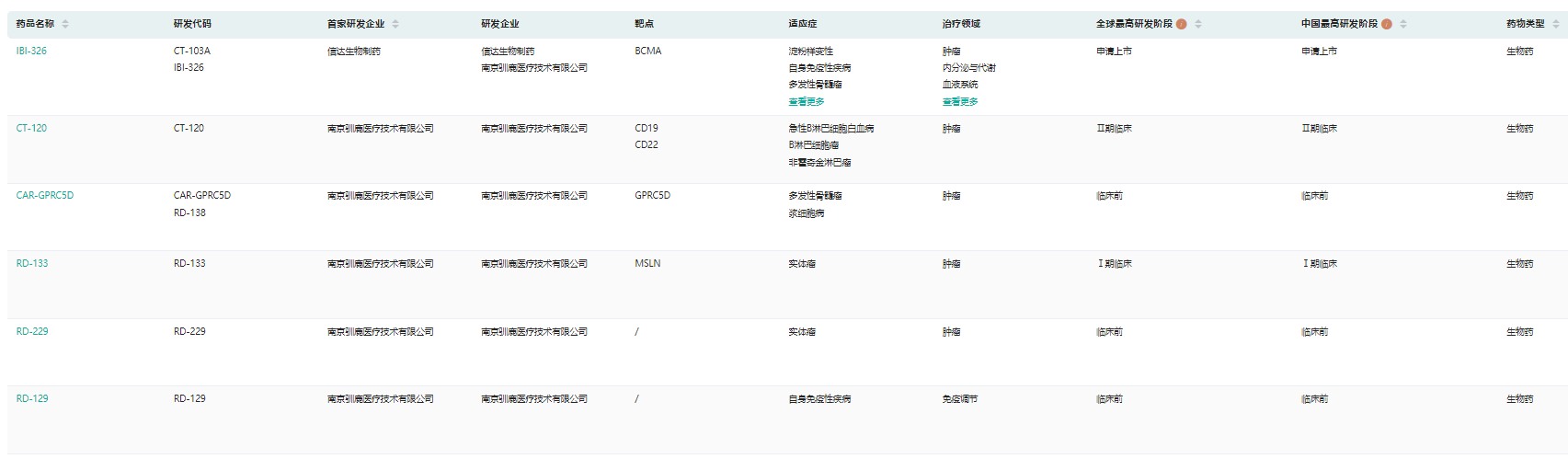
截图来源:药融云全球药物研发数据库
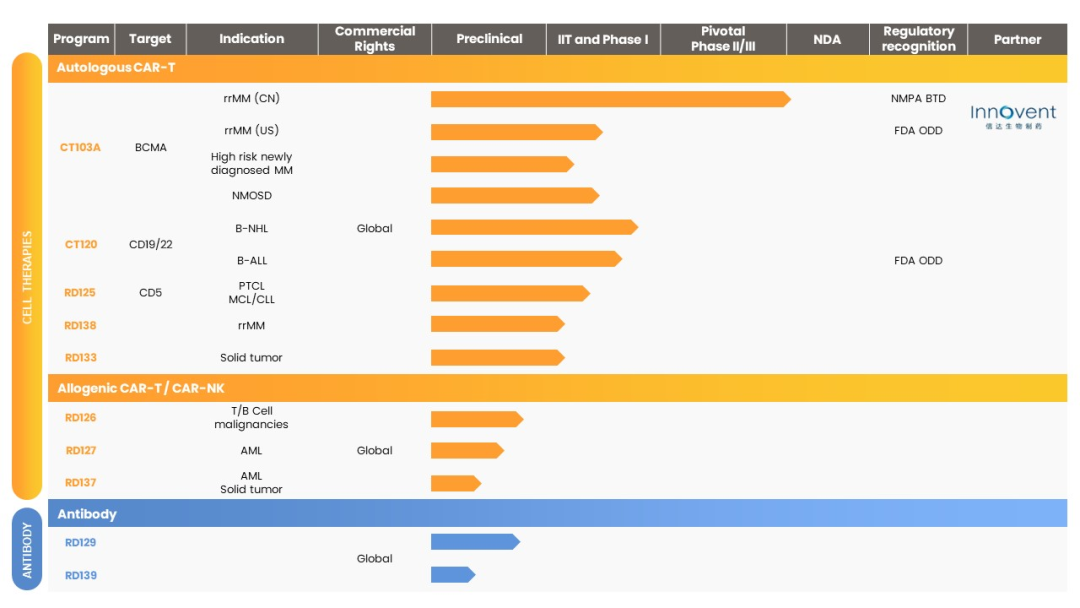
图片来源:驯鹿生物企业官网
03 研发项目
据药融云数据库显示,驯鹿生物现有10个在研品种处于不同研发阶段,其中进展最为迅速的候选产品伊基仑赛注射液(IBI-326)治疗复发/难治性多发性骨髓瘤(R/R MM)的新药上市申请已获国家药品监督管理局(NMPA)正式受理。该产品是驯鹿生物旗下的一款BCMA靶向的CAR-T细胞疗法产品,并在此前已相继获NMPA纳入“突破性治疗药物”品种及获FDA授予“孤儿药(ODD)”认定;
伊基仑赛注射液(IBI-326)基本信息
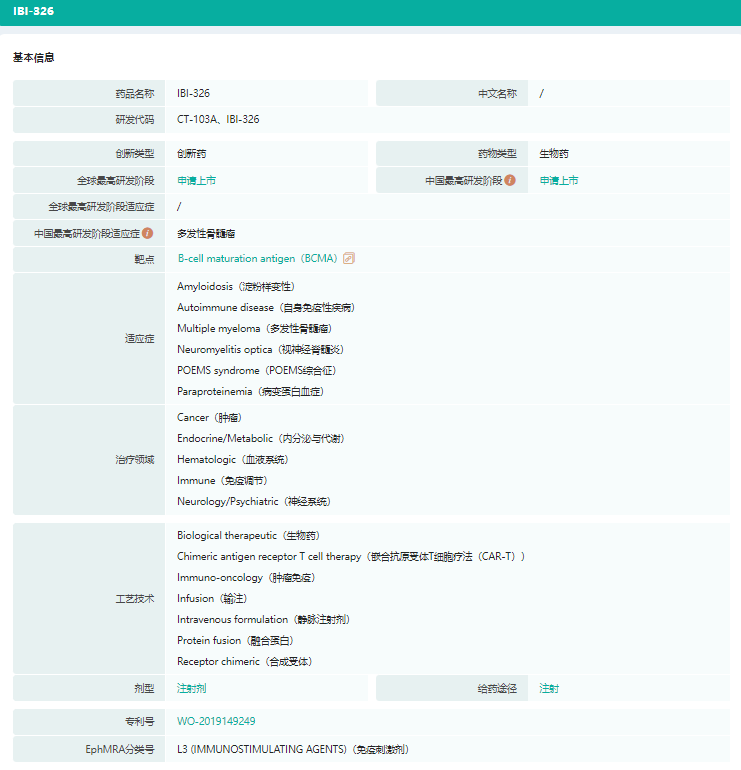
伊基仑赛注射液(IBI-326)适应症研发阶段
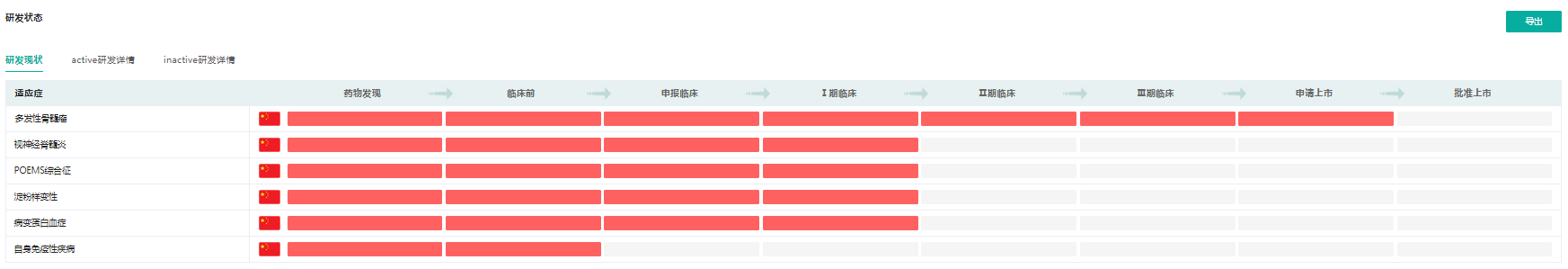
截图来源:药融云全球药物研发数据库
除多发性骨髓瘤外,NMPA已正式受理驯鹿生物伊基仑赛注射液新增扩展适应症–抗体介导的视神经脊髓炎谱系疾病(NMOSD)的临床试验申请(IND);
驯鹿生物自主研发的创新候选产品CT120(全人源CD19/CD22双靶点CAR-T细胞注射液)已进入临床Ⅰ期研究阶段,适应症分别为CD19/CD22阳性的复发/难治性B细胞非霍奇金淋巴瘤(B-NHL)和复发/难治性急性B淋巴细胞白血病(B-ALL),并已获得FDA授予“孤儿药(ODD)”认定。
CT120适应症研发阶段
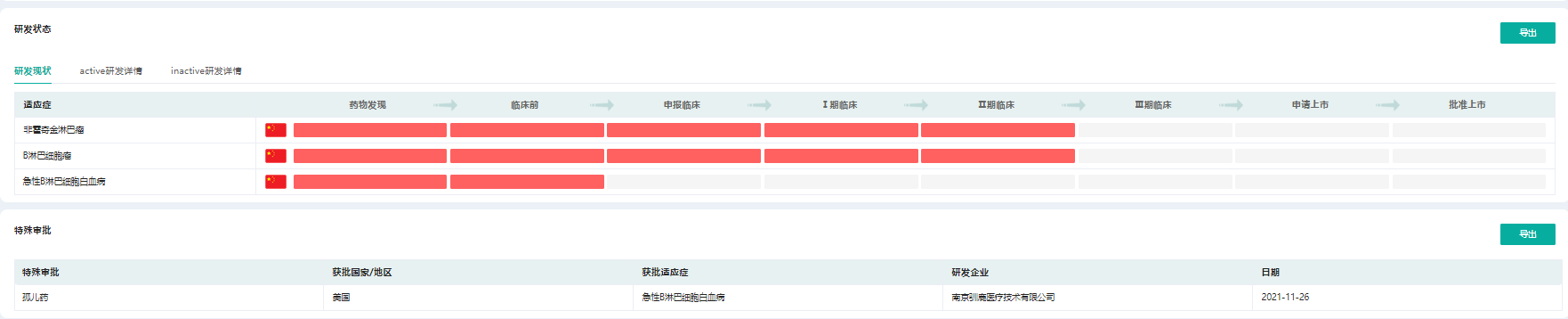
截图来源:药融云全球药物研发数据库
04 技术平台
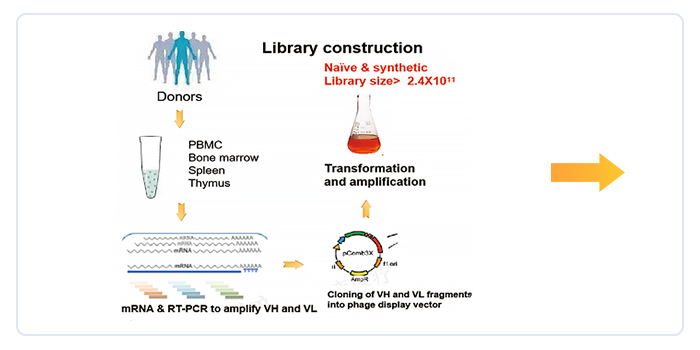
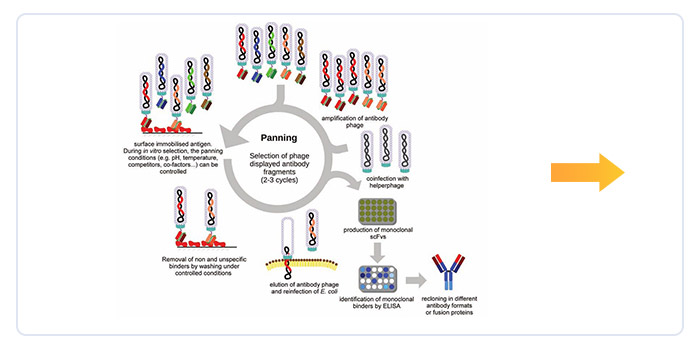
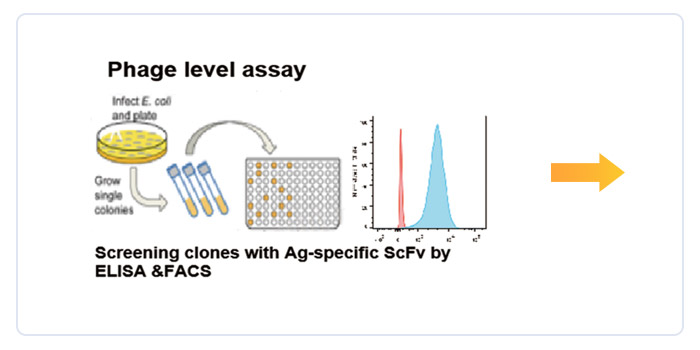
(一)全人源抗体发现平台
库容超过2400亿,强化抗体成药性的全合成抗体库,针对双靶点CAR/双抗开发的全人源单域抗体库,成功应用于20个内部项目开发,其中4个进入临床开发阶段。
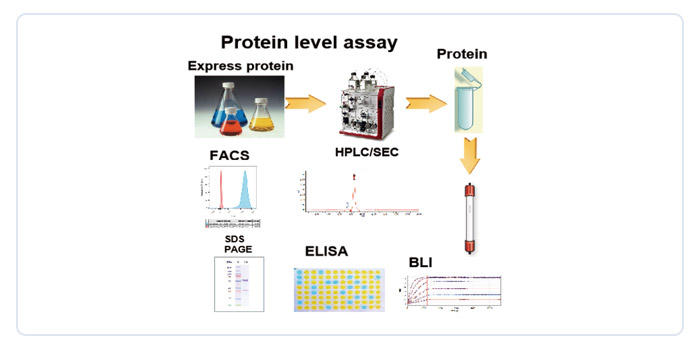
(二)高通量CAR-T药物优选平台
采用前沿的单细胞分析和NGS技术,实现CART先导药物的高通量功能性筛选,全方位评价CAR-T候选药物的细胞表型和功能,大幅缩短候选药物筛选时间。
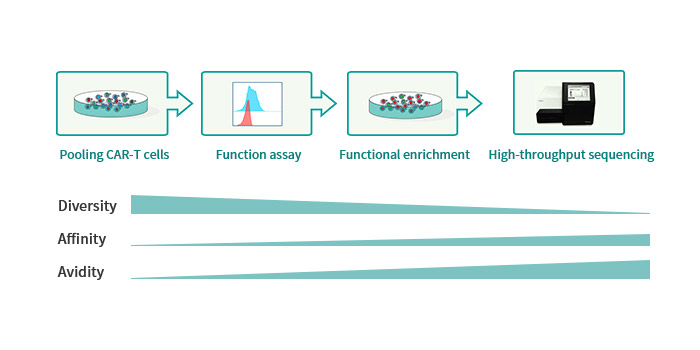
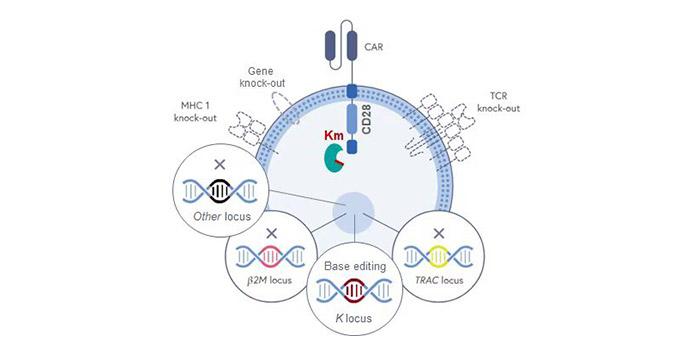
(三)通用CAR技术平台
驯鹿生物原创的具有自主知识产权的异体CAR-T细胞技术,可与现有通用CAR-T策略组合应用,适用于T,NK,NKT,iPSC来源的多种免疫细胞。
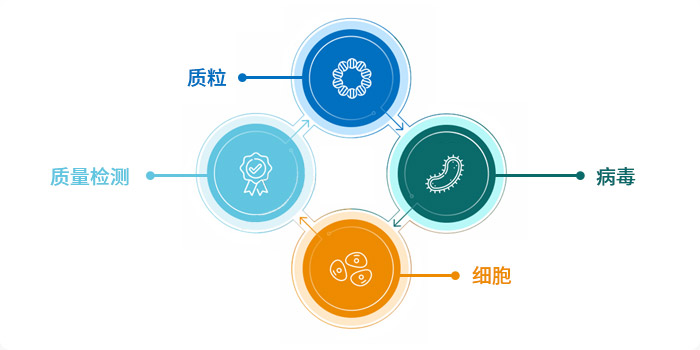
(四)生产技术平台
拥有高效可控的,从质粒、慢病毒载体到CAR-T细胞的全流程生产及检定平台,近万平米的GMP生产设施,CAR-T细胞产能超过3000人份/年。
(五)临床转化研究平台
丰富的研究型医生及意见领袖资源和细胞治疗领域临床经验,与国内一流三甲医院建立联合实验室,候选药物可迅速进入临床转化研究阶段,快速获得早期临床验证结果。
05 最新进展
- 2022年5月28日,NMPA已正式受理驯鹿生物的全人源BCMA嵌合抗原受体自体T细胞注射液(伊基仑赛注射液,福可苏®,研发代号CT103A)新增扩展适应症抗体介导的视神经脊髓炎谱系疾病(NMOSD)的临床试验申请(IND),这是全球第一个CAR-T在NMOSD疾病领域的IND申请。
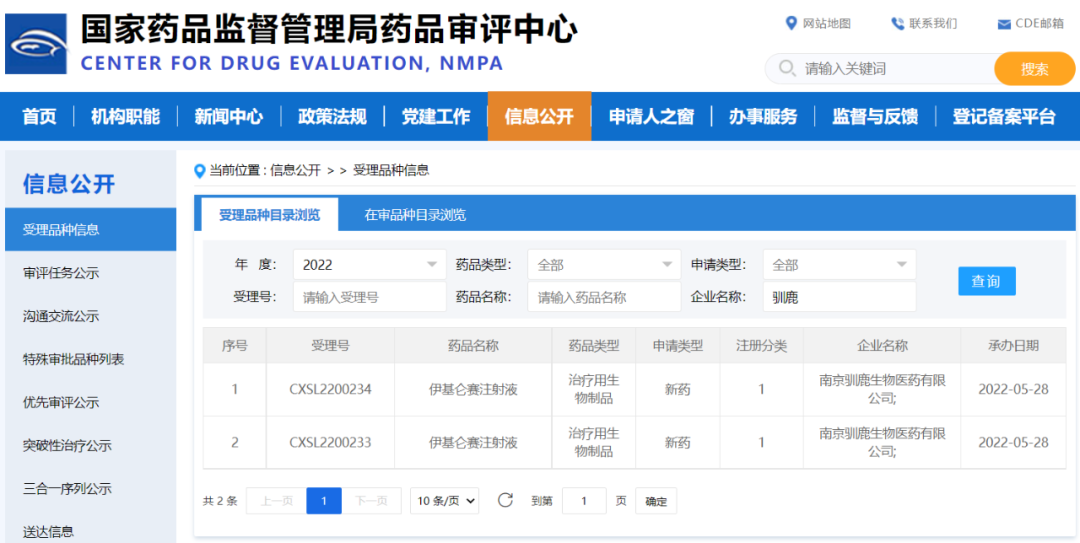
- 2022年6月2日,驯鹿生物与信达生物共同宣布NMPA正式受理由双方合作开发的伊基仑赛注射液(驯鹿生物研发代号:CT103A;信达生物研发代号:IBI326)治疗复发/难治性多发性骨髓瘤(R/R MM)的上市许可申请(NDA)。伊基仑赛注射液是国内第一款全流程自主研发的CAR-T细胞治疗产品,是国内首家递交新药上市获受理并有望成为国内首款获批的靶向BCMA的自体嵌合抗原受体T细胞免疫治疗产品。
- 2022年6月13日,驯鹿生物与信达生物共同宣布,在维也纳进行的2022年第27届欧洲血液学协会(EHA)年会上,以口头报告形式,展示双方共同开发的全人源自体B细胞成熟抗原(BMCA)嵌合抗原特异性CAR-T细胞(CT103A)治疗复发/难治性多发性骨髓瘤患者的最新1/2期注册性临床研究结果(摘要编号:S187)。研究结果显示,伊基仑赛注射液在人体内具有优异的安全性和有效性,并拥有长效持久的体内存续时间,有望成为复发难治性多发性骨髓瘤患者的突破性治疗手段。报告人为华中科技大学同济医学院附属同济医院的李春蕊教授。
参考资料:
[1] NMPA官网
[2] 药融云数据库
[3] 驯鹿生物
相关阅读:
想要解锁更多药企产品管线信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企产品布局、基本信息、研发阶段、最新进展、临床试验信息、市场规模与前景,可否投入研发!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>




















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论