
导读:25日,CDE又发布《人用狂犬病疫苗临床研究技术指导原则(试行)》、《人纤维蛋白原临床试验技术指导原则(试行)》,详情见下。

为指导和规范人用狂犬病疫苗临床试验,提供可参考的技术规范,在国家药品监督管理局的部署下,药审中心组织制定了《人用狂犬病疫苗临床研究技术指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
特此通告。
附件:人用狂犬病疫苗临床研究技术指导原则(试行)
国家药监局药审中心
2022年2月18日

为指导和规范人纤维蛋白原用于先天性纤维蛋白原缺乏症和获得性纤维蛋白原缺乏症的临床试验,在国家药品监督管理局的部署下,药审中心组织制定了《人纤维蛋白原临床试验技术指导原则(试行)》(见附件)。
根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
特此通告。
附件:人纤维蛋白原临床试验技术指导原则(试行)
国家药监局药审中心
2022年2月17日
《人用狂犬病疫苗临床研究技术指导原则(试行)》
一、概述
狂犬病(Rabies)是一种急性侵袭性病毒性脑炎,由狂犬病病毒属病毒感染引起,一旦发病病死率为 100%。暴露后及时、规范地进行包括人用狂犬病疫苗接种在内的处置措施可有效预防狂犬病的发生。狂犬病疫苗根据注射途径不同可分为肌肉注射和皮内注射,目前境内均采用肌肉注射途径;根据狂犬病病毒暴露与接种疫苗的时间关系,分为暴露前和暴露后免疫程序。
目前,肌肉注射途径的狂犬病疫苗暴露后免疫程序有五剂程序(Essen 法,第 0、3、7、14 和 28 天各接种 1 剂)、四剂程序(Zagreb 法,第 0 天接种 2 剂,第 7、21 天各接种 1剂,即 2-1-1 程序)和简易四剂程序(第 0、3、7 天各接种 1剂、14~28 任意一天接种 1 剂,即 1-1-1-1 程序)。为规范人用狂犬病疫苗的临床试验,特制定本指导原则。
二、适用范围
本指导原则旨在为人用狂犬病疫苗(以下简称狂犬病疫苗)的临床试验设计和评价提供技术指导。本指导原则着重对境内采用的肌肉注射途径狂犬病疫苗的暴露后免疫程序临床试验进行阐述,主要讨论现有不同免疫程序临床试验设计,以及有效性和安全性评价的重点关注内容。
本指导原则适用于注册分类为预防用生物制品 3.3 类(境内已上市疫苗)的狂犬病疫苗临床试验的设计及评价。
对于皮内注射途径的狂犬病疫苗、创新型狂犬病疫苗或其它免疫程序的狂犬病疫苗临床研究,需根据实际情况进一步考虑并具体开展沟通交流。应用本指导原则时,还应同时参考药物临床试验质量管理规范(GCP)、疫苗临床试验技术指导原则、预防用疫苗临床可比性研究技术指导原则、国际人用药品注册技术协调会(ICH)以及其他已发布的相关指导原则。
本指导原则仅代表药品监管部门当前的观点和认识,不具有强制性的法律约束力。随着科学研究的进展,本指导原则中的相关内容将不断完善与更新。
三、临床试验设计和评价
(一)总体设计
1. 研究计划
对于适用于本指导原则范围的狂犬病疫苗,通常开展Ⅰ 期和Ⅲ期临床试验,其中Ⅰ期临床以评价疫苗安全性为主, 受试人群年龄及入组顺序应符合相关通用技术要求,安全性观察指标应全面。通过Ⅰ期临床试验对安全性进行初步评价后再开展Ⅲ期临床。Ⅲ期临床通常评价疫苗在目标人群中的有效性和安全性,一般采用随机、盲法、阳性疫苗对照试验设计。
由于狂犬病疫苗临床试验可能涉及不同免疫程序间的比较,临床试验应更加关注实施过程中盲态的维持。
2. 对照的选择
对于已注册上市的狂犬病疫苗申请增加新的免疫程序的,应采用已批准的免疫程序作为对照,并使用同一批次疫苗开展试验。如申请人尚无狂犬病疫苗上市,应选择已上市疫苗作为对照时,除考虑细胞基质和/或毒株亲缘性因素外, 还应考虑所选择的对照疫苗在实际使用中具有一定代表性。
试验疫苗和对照疫苗应至少进行同步的效价检测,避免由于试验疫苗与对照疫苗差异较大导致临床试验结果无法评价。
3. 受试人群的选择
临床试验受试者的选择应充分考虑对目标人群的代表性。由于狂犬病疫苗的使用人群覆盖全年龄段人群,故临床试验的设计应考虑分层入组不同年龄段受试者。世界卫生组织(WHO)数据显示狂犬病最常见于 15 岁以下人群,约 40% 的暴露后免疫用于 4~15 岁人群;境内分析数据显示狂犬病病例中 17%为 15 岁以下人群。因此在临床试验中应考虑根据疫苗实际使用情况合理确定各年龄段受试者的比例。
(二)有效性评价
1. 评价人群
鉴于狂犬病 100%的致死性和暴露后通过疫苗接种尽快获得保护的预期(尤其是对于抗体阴性者),故狂犬病疫苗临床试验应以接种前阴性人群作为主要评价人群。同时结合接种前阳性人群及全人群的免疫原性结果辅助评价。
狂犬病疫苗临床试验涉及的采血点相对较多,应合理定义作为主要分析数据集的符合方案集(PPS),其中涉及采血和抗体检测方面建议为完成各时间点采血并获得检测结果的受试者。同时需合理制定接种、采血窗口期以保证临床结果的科学评价。
2. 评价标准
免疫原性替代终点及评价标准在狂犬病疫苗的评价中发挥了重要作用。狂犬病疫苗免疫原性主要基于抗狂犬病病毒中和抗体(Rabies Virus Neutralizing Abs,RVNA)的阳转率和几何平均浓度(Geometric mean concentration,GMC)及个体的抗体水平进行评价。境内 RVNA 检测方法基本采用快速荧光灶抑制试验(Rapid Fluorescent Focus Inhibition Test, RFFIT)。对于接种前阴性受试者(RVNA<0.5IU/ml),接种后RVNA≥0.5IU/ml为 阳 转 ; 接 种 前 阳 性 受 试 者(RVNA≥0.5IU/ml),接种后 4 倍及以上增长为阳转。在进行组间免疫原性结果的比较分析和总结时,应提供包括接种前基线、接种后血清抗体阳转率、GMC 及其置信区间的数据。鼓励选择合适的采血点开展细胞免疫的探索。
无论是对于已注册上市疫苗申请增加新的免疫程序,还是首次申请上市的疫苗,免疫原性评价应达到以下标准:
(1) 鉴于狂犬病的 100%致死性,原则上自首剂接种开始抗体阳转率应尽快达到 100%;
(2) 首剂接种后 14 天的抗体阳转率达到非劣效,即试验组与对照组阳转率率差双侧 95%置信区间(CI)下限≥-5%;
(3) 首剂接种后 14 天的抗体 GMC 达到非劣效,即试验组与对照组 GMC 比值双侧 95%CI 下限≥2/3;
(4) 首剂接种后 42 天(或末剂接种后 14 天)的抗体阳转率达到非劣效,即试验组与对照组阳转率率差双侧95%CI下限≥-5%。
首剂接种后 42 天(或末剂接种后 14 天)的 GMC 作为 关键次要终点,其他次要终点依据不同免疫程序而具体设计。
3. 具体设计
(1) 已注册疫苗申请新免疫程序
对于五剂程序已注册上市的狂犬病疫苗申请增加新免疫程序的,应以获批的五剂程序作为对照。试验组和对照组至少应确保首剂接种后 14 天、首剂接种后 42 天(或末剂接种后 14 天)的血样标本采集。申请 2-1-1 程序:除上述采血点外,还需增加首剂接种后 7 天血样的采集,分析抗体阳转率及 GMC 较五剂程序可能具有的优势,同时作为次要终点。为评价 2-1-1 程序首次
接种 2 剂的必要性,鼓励探索更早时间点的免疫应答情况。申请简易四针程序:鉴于该程序的末剂次为 14~28 天范围内任意时间接种,为确保免疫原性的充分比较,疫苗免疫程序的尽量统一,应充分开展末剂次在不同时间接种的研究。试验组应至少设置末剂次于 14 天或 28 天接种的两个组(分别为 0、3、7、14 天各接种 1 剂和 0、3、7、28 天各接种 1 剂两个程序),并同时满足研究假设。试验组和对照组还应采 集首剂接种后 28 天的血样标本用于分析,相应指标作为次要终点。
(2) 首次申请上市
对于首次申请狂犬病疫苗上市的,应选择已获批五剂程序的上市疫苗作为阳性对照疫苗,申请的免疫程序试验组与对照组分别进行比较。申请五剂程序的,试验组和对照组应在首剂接种后 14 天、首剂接种后 42 天进行血样标本采集;申请 2-1-1 程序或简易四剂程序的,具体设计同上。
为更好的评价各免疫程序,建议同时开展 2-1-1 程序、简易四剂程序试验组与五剂程序试验组之间的比较。
4. 免疫持久性
目前 WHO 和国家卫生健康部门均建议对于完成全程免疫者 3 个月内再次暴露不需接种疫苗。基于此建议可考虑以全程接种后 3 个月为目标,开展全程接种 3 个月后的采血和免疫原性随访;申请人可在获得 3 个月持久性结果后申请上市并继续进行 6 个月的免疫持久性观察。鼓励随访至 12 个月以积累持久性数据。
(三)安全性评价
临床试验中应对疫苗的安全性进行全面评价。安全性观察内容应至少包含已上市同类疫苗临床试验中的不良反应、临床应用或文献中报告的常见不良反应、预期偶见和非预期不良反应。
安全性分析内容一般包括总体不良事件、总体不良反应、局部/全身(接种部位/非接种部位)不良反应、其它不良事件(与疫苗无关的不良事件)、单个症状(体征、疾病、临床 指标等)、严重不良事件等;部分疫苗还需监测疫苗的特殊关注不良事件(AESI)和可疑且非预期严重不良反应(SUSAR)等。分析指标一般包括发生频率和严重程度。必要时还应按 照发生时间、接种剂次、亚组人群(如特定年龄段)进行单独分析。对于 2-1-1 程序,需关注首次接种 2 剂疫苗后的安全性。
可参考国内外同类疫苗安全性相关研究数据、文献或报告,密切监测和报告研究疫苗发生的 SUSAR 和潜在的安全性风险;如已有重大安全性风险警示或报告,应制定风险控制计划和采取必要措施,以保护受试者安全。同时应按照相关要求定期汇总、分析和提交临床试验中安全性监测资料。
(四)样本量估算
样本量的估算应符合相关疫苗临床试验的通用指导原则及统计学分析的要求。从安全性的角度考虑试验疫苗组的总样本量一般应不少于 500 例。若有同类疫苗安全性信号提示存在特定的安全性风险时样本量应尽量保守估算。对于已上市且经大量使用积累了安全性数据的疫苗,申请增加新的免疫程序时可在确保安全性研究基本要求的前提下,根据免疫原性估算样本量。对于申报 2-1-1 免疫程序,基于首次接种后不良反应增加的可能和产生早期免疫应答的预期,同样应保守估算样本量以利于各程序间获益风险的比较。
从免疫原性的角度考虑,因狂犬病疫苗临床试验涉及多个主要终点,故应综合考虑各评价指标合理确定样本量,也可采用免疫原性亚组的设计。同时,建议评估受试者基线情况,保证用于免疫原性主要分析人群即接种前阴性受试者的样本量。
(五)其他考虑
1. 再次暴露的免疫程序
WHO 和国家卫生健康部门均建议对于完成全程免疫者3 个月后再次暴露需于 0 天和 3 天各接种 1 剂,共 2 剂。鼓励申请人结合免疫持久性研究,对再次暴露者疫苗接种程序进行探索,为临床应用积累数据。如基于注册试验的受试者, 有计划的在末剂次接种 3 个月后一定时间分批次再次接种疫苗并与全程免疫的免疫应答情况进行比较。
2. 暴露前免疫程序
目前,已上市狂犬病疫苗说明书暴露前免疫程序均按照0、7、21 或 28 天各注射 1 剂,全程共肌肉注射 3 剂的程序进行接种。WHO 现行的狂犬病疫苗立场文件推荐暴露前免疫程序变更为 0、7 天各接注射 1 剂,全程共注射 2 剂程序。在保障受试者安全性的前提下,鼓励对疫苗暴露前免疫程序进行探索以积累充分的临床数据,为临床应用提供有力证据支持。暴露前免疫程序的研究也应关注免疫持久性。
3. 特殊人群的研究
暴露后接种狂犬病疫苗不设禁忌症,但注册临床试验因条件限制均设置了较多的排除标准,无法充分观察特殊人群(如哺乳期和妊娠期妇女,伴基础性疾病者、免疫功能低下者等)接种疫苗的安全有效性。鼓励申请人在上市后主动收集特殊人群自然暴露后接种狂犬病疫苗的安全性和免疫原性数据,以进一步支持在该人群中的应用。
4. 批间一致性临床研究
一般来说,对于生产工艺的一致性或质量稳定性变异度高的试验疫苗,建议进行多批次间一致性的临床比较研究。原则上,批间一致性临床研究应包括至少连续三批上市规模疫苗,对各批次试验疫苗的免疫原性进行两两比较,评价指标同注册临床试验。其结果应达到等效性评价标准,即各批次疫苗组间 GMC 比值的双侧 95%置信区间在 0.67~1.5 范围内。
对于上市规模产品与临床试验样品存在较大生产变更的产品,建议同时考虑与临床试验用样品的 GMC 非劣效比较分析。
《人纤维蛋白原临床试验技术指导原则(试行)》
一、前言
纤维蛋白原(Fibrinogen,Fg)即凝血因子 I,是一种分子量约为 340kDa 的可溶性血浆糖蛋白。通常情况下,健康人血浆中含量约为 150~450 mg/dL,消除半衰期约为 4 天。在凝血酶的作用下纤维蛋白原先形成蛋白单体再聚合为纤维蛋白,直接参与凝血过程。此外,纤维蛋白原还可介导血小板聚集反应,促进凝血。
纤维蛋白原缺乏症,分为先天性纤维蛋白原缺乏症(congenital fibrinogen deficiency,CFD)和获得性纤维蛋白原缺乏症(acquired fibrinogen deficiency,AFD)。先天性纤维蛋白原缺乏症是常染色体遗传性疾病,包括血浆纤维蛋白原完 全缺失或低于 检测下限的无 纤维蛋白原血 症(afibrinogenemia)、血浆纤维蛋白原水平<150 mg/dL 的低纤维蛋白原血症(hypofibrinogenemia)、血浆纤维蛋白原功能异常的异常纤维蛋白原血症(dysfibrinogenemia)。获得性纤维蛋白原缺乏症可能由肝实质病变引起纤维蛋白原合成不足导致,也可能由疾病或药物引起纤维蛋白原消耗过度、纤维蛋白原溶解所致。
纤维蛋白原缺乏时的临床表现从无症状到危及生命的 出血、血栓栓塞事件不等。对于纤维蛋白原缺乏症的急性出 血治疗和围手术期出血管理,通常选用纤维蛋白原替代疗法。现阶段,临床上使用的含纤维蛋白原的产品主要是新鲜冰冻血浆、冷沉淀制剂和人纤维蛋白原制剂,均来源于人类供体血浆。
与新鲜冰冻血浆、冷沉淀制剂相比,人纤维蛋白原制剂是经过分离、纯化的浓缩制剂,临床输液所需体积更小,并可避免输注不必要的其他凝血因子。人纤维蛋白原制剂生产过程中包括经验证的病毒灭活工艺,其病毒灭活过程更加严格。新鲜冰冻血浆和冷沉淀制剂是按照临床输血相关规定进行管理,人纤维蛋白原制剂是按照药品相关法律法规进行监管,其上市前应按照药品研发要求完成相应适应症的临床试验。
本指导原则主要适用于人纤维蛋白原制剂申请上市许 可、或已上市产品发生药学变更需开展临床试验时提供建议。本指导原则主要对纤维蛋白原用于治疗先天性/获得性纤维 蛋白原缺乏症患者的临床试验的关键内容进行了阐述,可能 无法涵盖临床试验的所有内容,对于实际应用中的特定问题, 应视具体情况具体研究决定。
本指导原则仅代表药品监管部门当前的观点和认识,不具有强制性的法律约束力,随着科学研究的进展,本指导原则中的相关内容将不断完善与更新。
应用本指导原则时,还请同时参考药物临床试验质量管理规范(GCP)、国际人用药品注册技术协调会(ICH)和其他国内外已发布的相关指导原则。
二、临床试验的程序
人纤维蛋白原的临床适应症包括先天性纤维蛋白原缺乏症和获得性纤维蛋白原缺乏症,因此临床试验可根据拟申请适应症范围考虑相应的试验内容。
上市前应至少完成针对先天性纤维蛋白原缺乏症受试者的临床试验。
1. 针对先天性纤维蛋白原缺乏症受试者的临床试验
建议首先开展单次给药的药代动力学研究和初步安全性评价,然后开展有效性和安全性评价。
临床试验中,若纳入儿童受试者,建议在成人受试者中获得初步的安全性数据后再入组儿童受试者,并根据儿童受试者的特点,设计合理的给药剂量和采血时间点。
2. 针对获得性纤维蛋白原缺乏症受试者的临床试验
若产品上市拟申请用于获得性纤维蛋白原缺乏症患者的急性出血治疗和围手术期出血管理,应在完成针对先天性纤维蛋白原缺乏症受试者的有效性和安全性评价之后,再考虑在获得性纤维蛋白原缺乏症受试者中开展人纤维蛋白原的有效性和安全性评价。
三、上市前临床试验
(一)药代动力学研究
药代动力学研究是在先天性纤维蛋白原缺乏症受试者中评价外源性人纤维蛋白原单剂量输注后在人体内的代谢过程,以指导临床用药。
入组受试者为临床确诊的先天性无纤维蛋白原血症或先天性低纤维蛋白原血症患者(功能性纤维蛋白原基线水平<50 mg/dL)。受试者应为非出血状态。
为获得稳定可靠的数据,同时考虑到先天性纤维蛋白原缺乏症的发病率,药代动力学研究若仅纳入成人受试者,样本量至少10例;若试验中同时纳入儿童受试者,样本量至少16例,其中儿童受试者至少6例。
建议根据试验药的纤维蛋白原活性水平,并基于受试者纤维蛋白原基线水平,设计单次给药剂量。一般情况下,成人受试者的推荐给药剂量为60~70 mg/kg。
药代动力学参数应包括最大血药浓度(cmax)、药峰时间(tmax)、表观分布容积(Vd)、消除半衰期(t1/2)、血药浓度-时间曲线下面积(AUC)、清除率(Clearance)、体内回收率(IVR)、增量回收率(incremental IVR)等。
最大血药浓度,指血浆中纤维蛋白原的峰值水平。纤维蛋白原水平即血浆中的纤维蛋白原检测值,其测定方法有多种,目前国内常用的方法是功能测定法,即采用基于凝固时间的Clauss法检测功能性的纤维蛋白原水平,也可以增加其他纤维蛋白原检测方法检测同一份血浆样本(如免疫测定法),从不同方面评估纤维蛋白原含量。
增量回收率,由输注结束后纤维蛋白原的峰值水平(cmax)计算得出,单位为[mg/dL]/[mg/kg],其计算方法如下:

药代动力学研究的血浆样本检测建议在中心实验室进行,且应提供充分的方法学验证资料。
参与药代动力学研究的受试者可继续参加后续有效性和安全性评价。
(二)有效性和安全性评价
1. 先天性纤维蛋白原缺乏症
针对先天性纤维蛋白原缺乏症受试者的临床试验,可采用单臂试验设计。
受试者至少20例,其中若包含儿童受试者,儿童受试者不低于6例。入组的受试者为临床确诊的先天性无纤维蛋白原血症或先天性低纤维蛋白原血症患者,排除异常纤维蛋白原血症患者。进行按需治疗(自发性或创伤性)的急性出血受试者,其功能性纤维蛋白原水平应<50 mg/dL;计划择期手术(包括有创操作)的受试者,其功能性纤维蛋白原水平应<100 mg/dL。
给药剂量和持续时间取决于疾病的严重程度、出血的部位和程度以及患者的临床状况。所需剂量应根据试验药药代动力学特征和拟提升的人纤维蛋白原水平确定给药剂量。

在治疗期间,应监测受试者的纤维蛋白原水平,对于轻微出血,推荐的血浆纤维蛋白原目标值为100 mg/dL;对于严重出血,推荐的血浆纤维蛋白原目标值为150 mg/dL。
1.1 有效性评价
可根据试验药的特征和试验目的设计合理的疗效评价指标和随访时间。
(1) 主要疗效指标
一般情况下,主要疗效指标需同时考虑输注后纤维蛋白原提升水平和止血疗效。其中,针对先天性纤维蛋白原缺乏症受试者自发性或创伤性急性出血的按需治疗或计划择期手术(包括有创操作)的围手术期出血管理,应完成至少10 例次出血事件的止血疗效评价。若试验中包含儿童受试者, 其止血疗效评价不低于3例次。
①活性回收率(又称输注效率值)
通过计算所有受试者首次输注试验药后纤维蛋白原的活性回收率,评价纤维蛋白原提升水平。纤维蛋白原水平的检测时间点可考虑:首次给药前、给药后药峰时间(tmax)和给药后24小时。
活性回收率计算方法如下:

②急性出血和围手术期出血管理的止血疗效评价
急性出血(自发性或创伤后)和围手术期出血管理的止血疗效评价可按照既定的“四级止血疗效评分量表”进行临床评估,止血成功被定义为止血疗效评分分级为“极好”和“良好” 的出血治疗或出血管理,评分标准可参考下表。
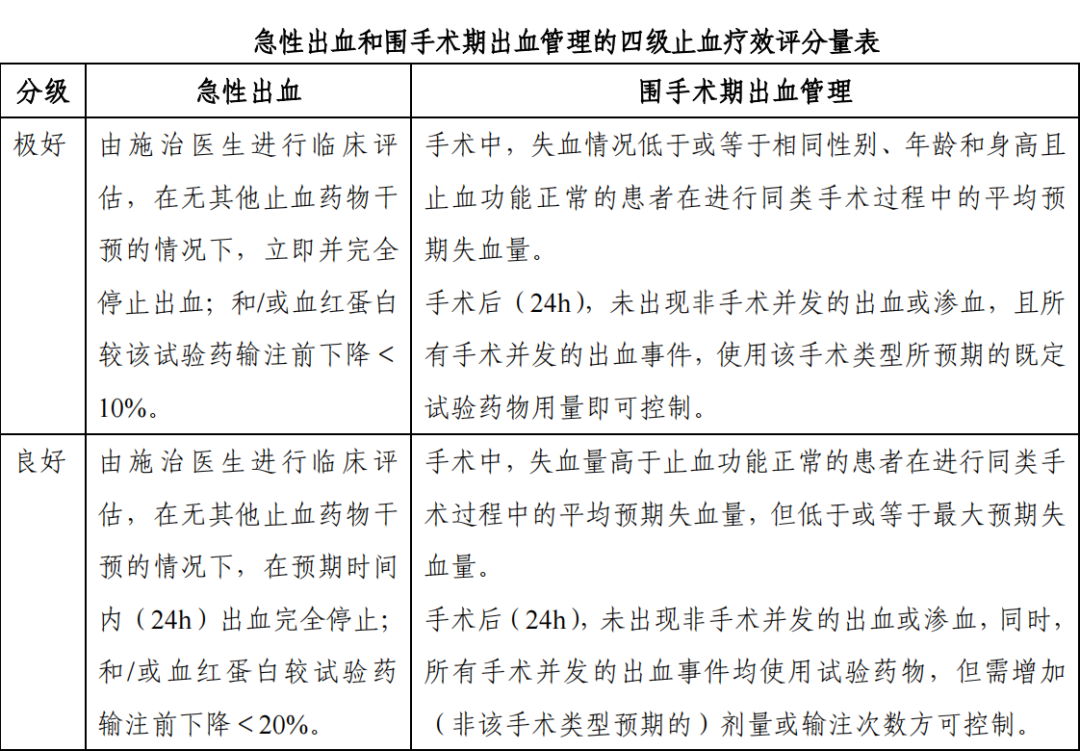
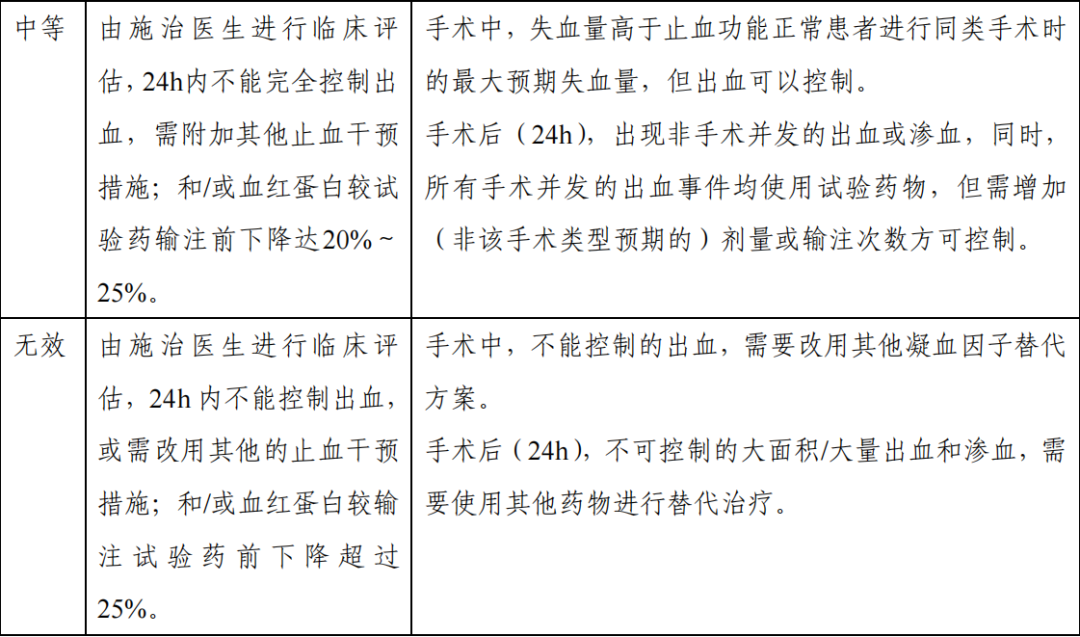
(1) 次要疗效指标
包括凝血功能指标、对于每次新发出血治疗的给药剂量(包括平均注射剂量和总用量)、给药次数、输注试验药后纤维蛋白原水平达到预计值的受试者比例、输注试验药后不同纤维蛋白原水平的受试者比例等。
对于围手术期出血管理的临床疗效评价,还可以包括术中和术后24小时失血和输血需求等情况。
1.1 安全性评价
临床试验期间,应对所有接受纤维蛋白原的受试者进行包括生命体征在内的安全性评估,对出现的所有不良事件进行记录,并就其与受试药物的因果关系、严重性和预期结果进行分析判断。
除了血液制品常规的安全性指标,纤维蛋白原的安全性应重点关注包括血栓栓塞、过敏或超敏反应、免疫原性在内的不良事件。
病毒安全性方面,研究者应按照临床试验的标准规范监测受试者的病毒安全性。临床试验中发现相关病毒学标志物转阳时,需及时复查,并进行病毒核酸检测,必要时延长随访时间。对其他传染性病原体进行安全监测的基本原则与病毒一致。
血栓栓塞:特别是大剂量或反复给予纤维蛋白原治疗有血栓形成的风险,临床试验期间应密切观察受试者血栓形成的症状和体征,重点监测动、静脉血栓形成相关的生物标志物(如D- 二聚体、FDP等),必要时可以辅助超声等影像学检查。
监测时间点的选择,应结合临床实际,重点选择易发血栓的监测时间点。
过敏或超敏反应:受试者使用人纤维蛋白原制品后可能发生过敏或超敏反应,也可能与制品生产过程中使用的辅料等有关。
试验过程中应密切关注和监测过敏或超敏反应,如果发生过敏或超敏反应,应立即停止输注。如果发生过敏性休克, 应实施标准的休克医学治疗。
免疫原性(抑制物):建议在中心实验室进行纤维蛋白原抑制物的检测,采样时间为首次输注前、输注后14天、1个月和出组前。样本检测前,须对检测方法进行充分的方法学验证。若抑制物检测结果呈阳性,则需要重新采集受试者的血样进行复检,并按严重不良事件报告。
对于产生抑制物的受试者,应根据受试者情况及临床治疗经验及时给予恰当的治疗。临床试验中应对疑似产生抑制物或已经产生抑制物的受试者的血浆样本进行妥善储存,以便在监管部门需要时再次实施抑制物分析。
2. 获得性纤维蛋白原缺乏症
针对获得性纤维蛋白原缺乏症受试者的临床试验,建议采用随机、双盲、阳性对照的非劣效试验设计。
获得性纤维蛋白原缺乏症的病因较多,疾病临床表现也呈多样性且严重程度各异。临床试验可以选择单一病因或非单一病因引起的获得性纤维蛋白原缺乏症患者,可包括(自发性或创伤性)急性出血患者或计划择期手术(包括有创操作)患者。
建议根据受试者病情及临床检验结果(包括凝血试验指标和纤维蛋白原水平等)综合考虑,确定给药方案。
有效性和安全性评价可参考针对先天性纤维蛋白原缺乏症受试者的有效性和安全性评价。
对于获得性纤维蛋白原缺乏症受试者,还需充分考虑治疗原发病的合并用药对试验药疗效评价的影响。
此类受试者除了纤维蛋白原水平降低,往往同时伴有其他凝血因子水平的异常,因此应考虑在临床试验过程中重点监测凝血、抗凝血、纤溶系统的变化,密切关注血栓形成及其风险评估。
四、上市后临床试验
若上市前临床试验中未纳入儿童受试者,可在上市后开展针对先天性纤维蛋白原缺乏症儿童受试者的临床试验。
应首先在至少6例受试者中开展药代动力学研究,然后开展有效性和安全性评价,应完成≥10例受试者的≥5例次出血事件(包括急性出血治疗和围手术期出血管理)的止血疗效评价。
在充分考虑儿童受试者临床实际的基础上,其他内容可参照上市前临床试验。
五、药学变更时的临床试验
药学变更可能对人纤维蛋白原的分子结构和生物学特性产生影响,进而可能影响临床疗效和安全性。如果不能排除上述影响,应考虑开展证明生产工艺变更后制品在质量、安全性和疗效方面与变更前制品具有可比性的研究,具体要求可参考相关的药学变更研究技术指导原则。
递交变更申请时,需要说明药学变更对产品疗效和安全性可能造成的潜在影响,并对临床试验计划的合理性进行阐述和论证。
经评估如需开展临床试验,至少应在先天性纤维蛋白原缺乏症受试者中开展试验,临床试验的具体要求可参考上市前该人群临床试验。
六、风险管理计划
风险管理计划应结合产品特点,并基于风险管理计划的一般指导原则进行制定。
制定的风险管理计划应包括但不限于本部分论述的内容,可从以下几点进行考虑:在上市前临床试验中,应根据 受试者人群特征、产品特点等内容设置合理的风险管理计划;上市后风险管理计划中,需要对未纳入临床试验的人群制定 风险管理计划和药物警戒计划。未纳入临床试验的人群主要 是基于前期临床试验相关的患者排除标准而得出,该部分人 群可能成为纤维蛋白原的使用人群,但限于临床试验设计而 无法从临床试验中获得其使用人纤维蛋白原的信息;在风险 管理计划中应包含对重要的已识别风险、重要的潜在风险及 非预期风险的监控及处理措施。
人纤维蛋白原已识别和可能的安全风险包括:血栓栓塞、过敏或超敏反应、免疫原性、输液反应和血液制品病原体传 播感染等。






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论