
随着全球范围内对心血管疾病和代谢性疾病认识的加深,GLP-1(胰高血糖素样肽-1)药物的研究与开发已成为热点。当前,GLP-1赛道的竞争日益激烈,全球在研药物数量众多,国内药企亦积极参与其中。本文将对国内部分具有代表性的GLP-1药物研发企业进行梳理,以供参考。(相关阅读:2024年GLP-1药物发展趋势:降糖减重药内卷,探索五大发展前沿!)
一、GLP-1药物市场概览
药融云数据库显示,目前全球临床在研GLP-1药物多达100多款,其中近一半来自中国。在中国,除了已上市的8款GLP-1受体激动剂外,还有多款药物处于临床研发阶段,有约11家中国企业研发的药物处于临床Ⅲ期阶段,涉及信达生物、派格生物、先为达生物等,市场竞争日益激烈。同时,GLP-1药物在糖尿病、肥胖症、非酒精性脂肪性肝炎(NASH)等领域的应用研究也在不断深入。
全球在研GLP-1药物研发阶段分布
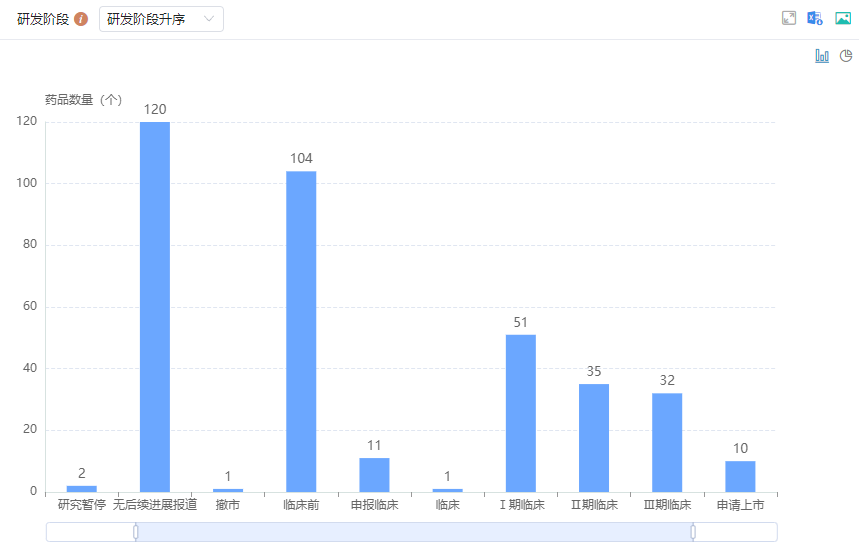
 图片来源:药融云全球药物研发数据库
图片来源:药融云全球药物研发数据库
二、部分代表性企业及其药物梳理
(排名不分先后)
1. 华东医药
华东医药是国内减重赛道第一阵营,不仅拥有首款获批的利拉鲁肽生物类似药利鲁平,还围绕GLP-1及其相关靶点开展了一系列包括口服、长效GLP-1产品研究。
目前,华东医药产品管线达46项,其中围绕GLP-1靶点方面深度布局,已构筑包含口服、注射液在内的长效及多靶点创新药/类似物产品管线共9款,包括1款上市,6款临床在研,2款临床前。
重点研发产品介绍
HDM1002:作为口服小分子GLP-1RA,HDM1002可强效激活GLP-1受体,改善糖耐受、降糖和减重,并显示出良好的安全性。在国内,其糖尿病适应症IND已获批,肥胖适应症已进入II期临床。
药融云可实时追踪HDM1002适应症研发现状
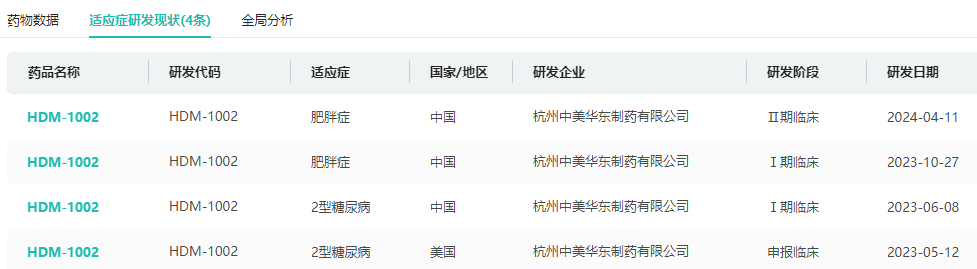
图片来源:药融云全球药物研发数据库
HDM1005:华东医药自主研发的GLP-1R/GIPR双靶点长效多肽类激动剂,已获得临床试验默示许可,适应症为超重或肥胖人群的体重管理、2型糖尿病。
DR10624:作为全球首款进入临床的GLP-1R/GCGR/FGF21R三靶点激动剂,DR10624在超重或肥胖人群的体重管理领域取得了重要进展。其中国IND申请已于2023年7月获批,糖尿病适应症和重度高甘油三酯血症适应症的中国IND申请也相继递交。
DR10628:针对糖尿病、非酒精性脂肪肝(NASH)等代谢疾病的GLP-1R/GIPR双靶点激动剂,由于脂肪酸链更长,DR10628具有更长的体内半衰期,临床拟采用每周给药一次的方案。
DR10627:是一款GLP-1R/GIPR双激动剂,是化学合成的含39个氨基酸的小肽,其以GLP-1序列为基础引入GIP活性相关的突变位点,并在此基础上交联长链脂肪酸以延长药物半衰期。在临床前动物试验中,DR10627呈现极其显著的降糖和减重药效。适应症为糖尿病、非酒精性脂肪肝(NASH)等代谢疾病。目前,DR10627已经进入I期临床研究阶段。
2. 恒瑞医药
恒瑞医药围绕GLP-1靶点布局丰富,目前已有5款相关产品处于不同的研发阶段,涵盖了口服、双靶点、复方制剂等多种产品类型。这些临床产品的顺利推进,不仅体现了恒瑞医药在药物研发方面的实力,其强大的销售能力有望为其在减肥市场中的领先地位奠定基础。
HRS9531:GIPR/GLP-1R双靶点激动剂
HRS9531是恒瑞医药子公司盛迪医药在研的一款减肥药,目前其用于减重适应症已经进入Ⅱ期临床。HRS9531是一款GIPR/GLP-1R受体激动剂,对标药物是礼来的替尔泊肽。据临床前研究数据显示,HRS9531在最高剂量(5.4mg)组治疗36天后,能够实现减重8.0kg(10%)的显著效果。
HR-1816:GCGR抗体/GLP-1融合蛋白药物
HR-1816是恒瑞医药的另一款重要产品,目前处于治疗糖尿病的临床1期研究阶段。作为GCGR抗体/GLP-1融合蛋白药物,HR-1816在糖尿病治疗领域具有较大的潜力。
HR17031:长效胰岛素/GLP-1复方制剂
HR17031为一款长效胰岛素与GLP-1的复方制剂,处于治疗糖尿病的临床III期研究阶段。目前,临床阶段尚无国内企业开发同类药物。诺和诺德的 Xultophy(德谷胰岛素+利拉鲁肽)和赛诺菲的Soliqua(利司那肽+甘精胰岛素)是国内获批仅有的同类药物,获批时间分别为2021和2023年。
药融云查询HR17031临床III期(CTR20241516)试验信息
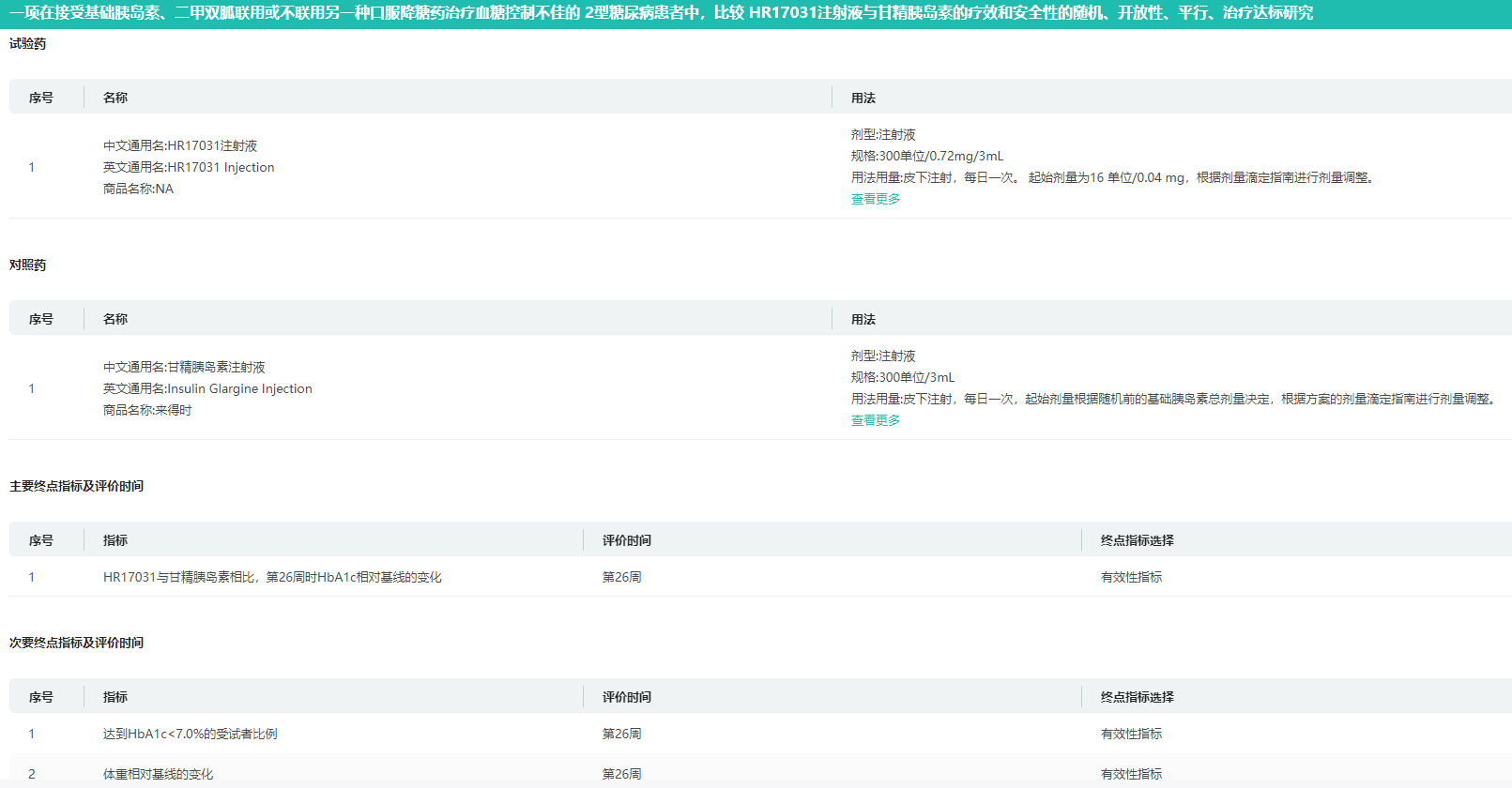
图片来源:药融云中国临床试验数据库
3. 仁会生物
贝那鲁肽——全人源GLP-1受体激动剂
仁会生物自主研发的贝那鲁肽注射液于2016年年底已在国内获批上市,是全球首个且唯一的氨基酸序列与人源完全一致的GLP-1类药物。一举实现了中国糖尿病领域创新药(除中药外)的“零”突破,打破了国外大型药企对GLP-1领域内新药的垄断,让国内的患者用上了糖尿病治疗领域的首个“国货之光”。
2023年7月,贝那鲁肽注射液(菲塑美®)超重/肥胖适应症上市许可申请获得批准,用于成年人的体重管理。意味着贝那鲁肽成为国内减重领域首款原创新药,也是继诺和诺德研发的利拉鲁肽、司美格鲁肽之后,全球范围内第三款获批的GLP-1类减重新药,为超重肥胖患者带来全新的治疗选择。
4. 先为达生物
伊诺格鲁肽注射液(XW003)
伊诺格鲁肽注射液(Ecnoglutide,XW003)是一种具有cAMP偏向性长效胰高血糖素样肽-1(GLP-1)激动剂,经优化提高了生物活性,降低了生产成本,并满足每周给药一次。目前,正被开发用于治疗肥胖症(临床III期)、2型糖尿病(临床III期)、非酒精性脂肪型肝炎NASH(临床I期)以及阿尔兹海默症(临床前)。
Ecnoglutide(XW003)治疗中国成人2型糖尿病(T2DM)患者III期临床试验的积极结果。数据显示,治疗24周后,Ecnoglutide显著降低了受试者HbA1c水平,大多数受试者HbA1c低于7%(美国糖尿病协会推荐的糖尿病患者治疗目标),相当一部分降低至正常水平范围(低于5.7%)。同时,Ecnoglutide组受试者的体重也显著下降。
口服伊诺格鲁肽(XW004)
口服伊诺格鲁肽(XW004)是一种伊诺格鲁肽的口服制剂,用于治疗肥胖症(临床I期)、2型糖尿病(临床I期)和NASH(临床I期)。XW004通过与口服吸收增强剂的结合,可防止活性物质Ecnoglutide在胃肠道的降解并有助于其入血,以达到每日一次甚至更长时间口服给药,进一步提高了患者依从性。XW004现已在中国、澳大利亚启动I期临床研究。
XW014:口服小分子GLP-1RA
XW014是一种新型口服小分子GLP-1受体激动剂,目前正在被开发用于治疗肥胖症和2型糖尿病。现已在美国启动I期临床研究。
作为口服小分子药物,XW014不仅更易于生产,并且具有高度的口服生物利用度。同时,XW014还具有与其他机制互补的口服药物共同开发联合制剂的潜力,从而达到更佳的临床疗效。
XW017:GIP受体激动剂与XW003联合使用
XW017是一种新型、长效的GIP肽类似物,针对生物活性和体内稳定性进行了优化。该药物是先为达2021年从赛诺菲手里授权获得。
经验证,在临床试验中,与GLP-1类似物联合使用的注射型GIP受体激动剂可以改善血糖控制和促进代谢健康,并且有着更为显著的减重效果。
5. 信达生物&礼来
玛仕度肽(IBI362):GLP-1R/GCGR双重激动剂
玛仕度肽(IBI362)为信达生物与礼来共同开发的一款GLP-1R/GCGR双重激动剂。可通过激动GLP-1R,从而促进胰岛素的分泌,并且降低血糖和减轻体重。此外还可以还可通过激动GCGR,增加能量消耗,由此减重效果可大幅增强。
其III期临床研究(GLORY-1)显示,在中国超重或肥胖成人受试者中达成主要终点和所有关键次要终点。2024年02月,玛仕度肽注射液的上市申请获得NMPA受理,用于治疗肥胖症患者,这也是全球首款GLP-1R/GCGR双靶点激动剂,将于2024年底或2025年初获批上市。
除了此次申报的6mg剂量,玛仕度肽还在进行高剂量9mg减重的三期临床,历史数据横向对比,玛仕度肽9mg剂量组的减重疗效优异,超出市场上的司美格鲁肽、替尔泊肽等竞品。
药融云查询玛仕度肽全球临床试验信息
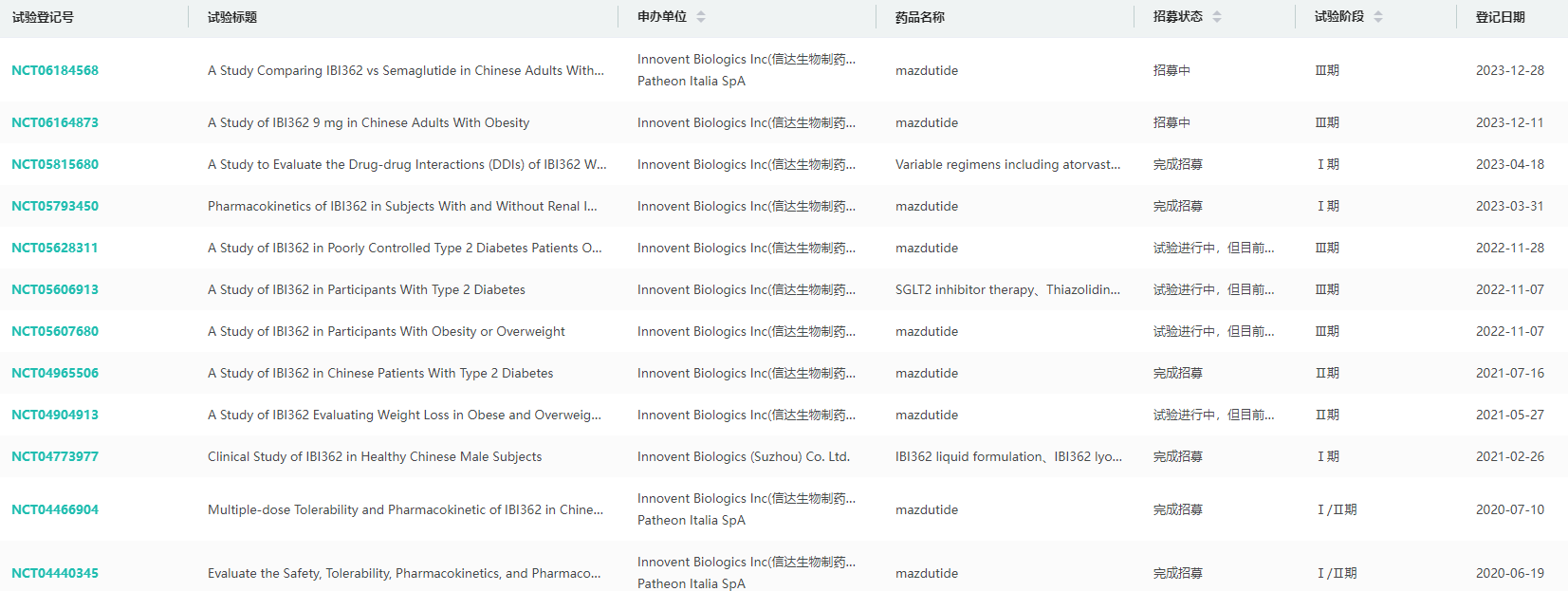
图片来源:药融云全球临床试验数据库
6. 石药集团
TG103(SYSA1803):长效重组人源GLP-1-Fc融合蛋白
TG103是天境生物与天士力合作开发的一款长效重组人源GLP-1-Fc融合蛋白,其药理作用稳定有效、安全性好、药物半衰期长。2018年,石药集团与天境生物达成合作协议,以1.5亿元人民币获得了该药物在中国的独家临床开发和商业化权益。
TG103注射液已完成2型糖尿病和超重/肥胖适应症的Ⅱ期临床试验。2023年8月,TG103用于治疗减重的适应症已进入Ⅲ期临床。2024年1月,石药集团启动了GLP-1-Fc融合蛋白TG103对比度拉糖肽治疗2型糖尿病患者的头对头III期临床试验(SYSA1803-009)。
除了已经推进至III期阶段的肥胖和2型糖尿病适应症,石药集团也正在探索将TG103用于治疗非酒精性脂肪性肝炎(NASH)和阿尔兹海默病的潜力。
司美格鲁肽注射液
石药集团也在布局司美格鲁肽生物类似药或改良型新药。2023年8月,石药集团的司美格鲁肽注射液(2.2类化药新药)获得NMPA临床试验批准,用于成人2型糖尿病患者的血糖控制。
2024年3月,石药集团的司美格鲁肽注射液用于减少热量饮食和增加体力活动的基础上对成人超重或肥胖患者的体重管理适应症的临床试验获批,也是该产品获批临床试验的第二个适应症。
7. 鸿运华宁
目前,鸿运华宁已经打造出了两大技术平台:GPCR抗体技术平台以及Mbody技术平台。在两大技术平台上,鸿运华宁开发了一系列GLP-1与GPCR抗体的融合蛋白,包括GLP-1R抗体、GIPR抗体和GCGR抗体与GLP-1的融合蛋白,其中进展最快的为GLP-1R抗体/GLP-1融合蛋白GMA102。
GMA102
作用靶点为GLP-1R,是全球第一个直接作用于GLP-1R的抗体类候选药物,具有和GLP-1受体双重结合位点,也是唯一一个具有GLP-1R偏好性(Biased)的抗体新分子。与现有GLP-1类药物相比,GMA102安全窗较大,可实现较高的给药剂量,在安全性上占有明显的优势,并且每月仅需给药一次。目前,其用于2型糖尿病适应症处于申请上市阶段,用于肥胖症适应症处于II期临床。
GMA105
GMA105注射液是鸿运华宁自主研发的全球唯一一款具有激动GLP-1受体作用的人源化单克隆抗体,其GLP-1部分与天然人GLP-1序列相似性约为90%,可抵抗二肽基肽酶4(DPP-4)的降解,分子量大可降低肾清除,延长了半衰期,允许每周给药一次(肥胖症)或每两周给药一次(T2DM)。
GMA105注射液作为GLP-1受体激动剂可促进胰岛素的合成与分泌,抑制胰高血糖素的分泌,还可延迟胃排空,使人体产生饱腹感,降低食欲与能量摄入,从而具有降糖和减重等作用,在同类产品中具有最优潜力。目前,正在准备启动中国Ⅲ期临床研究。
8. 质肽生物
围绕代谢性疾病,质肽生物已经建立了四个技术平台:QLFold高效包涵体蛋白复性技术平台;QLLong长效技术平台;QLFusion融合蛋白技术平台;QLOral口服药物技术平台。
基于技术平台,搭建了5条GLP-1RA管线,包括ZT001注射剂(司美格鲁肽生物类似药)、ZT002长效制剂、ZT003注射剂(GLP-1/FGF21双靶点抑制剂)、ZT006片剂(口服小分子)、ZT007注射剂(新型减肥机制GDF-15),涵盖口服制剂、新型作用机制药物、专门治疗NASH的GLP-1RA等。
ZT002注射剂:新型长效GLP-1受体激动剂
ZT002是基于多肽长效技术平台(QLLong)开发的新型超长效GLP-1受体激动剂,用于在饮食控制和运动基础上,接受二甲双胍和/或磺脲类药物血糖不达标的成人2型糖尿病患者的血糖控制,及降低伴有心血管疾病的2型糖尿病成人患者的主要心血管不良事件(心血管死亡、非致死性心肌梗死或非致死性卒中)风险。
临床前研究证实ZT002分子与目前临床治疗用GLP1有相同疗效,但2-3倍长的半衰期,有希望成为全球第一个每月仅给药一次的GLP1受体激动剂。
2024年1月,ZT002第四项适应症获得CDE临床试验默示许可,拟开发用于治疗非酒精性脂肪性肝炎。此前,ZT002已获批的适应症有成人肥胖或超重患者减重治疗、成人2型糖尿病患者的血糖控制及阿尔兹海默症。预计2024年底完成Ⅱ期临床。
ZT003注射剂:GLP-1/FGF21双靶点激动剂
ZT003是一款创新产品GLP-1/FGF21双靶点激动剂,瞄准了治疗手段几乎空白的非酒精性脂肪性肝炎(NASH),潜在药物市场达到200亿美元以上。目前该项目已实质性进入IND准备阶段。
ZT007注射剂:新型GLP-1/GDF15长效双激动剂
ZT-007是一种新型GLP-1/GDF15长效双激动剂,主要治疗肥胖症。生长分化因子 -15(GDF-15)具有强有力的肥胖治疗潜力,通过连接 GLP-1 分子,使得 ZT007 获得同时调控血糖代谢、食欲调控等方面的功效,并有望实现25%以上的减重效果。
9. 派格生物
PB-119(维派那肽):长效GLP-1受体激动剂
PB-119是派格生物自主研发的长效GLP-1受体激动剂,在中美两国已完成针对2型糖尿病的II期临床研究,国内外临床研究数据均显示PB-119具有显著的降糖作用,且兼具减重及改善整体脂代谢谱的效果,安全和耐受性良好。
目前,PB-119正在国内进行多项III期临床研究,包括单药以及分别联合二甲双胍、基础胰岛素、SGLT-2抑制剂治疗2型糖尿病等;针对2型糖尿病患者心血管结局的研究,也已获批开展临床研究。2023年9月,PB-119在中国用于治疗T2DM的新药上市申请获国家药监局受理,有望跻身首批商业化的国内研发长效GLP-1受体激动剂。
药融云查询PB-119临床试验结果信息
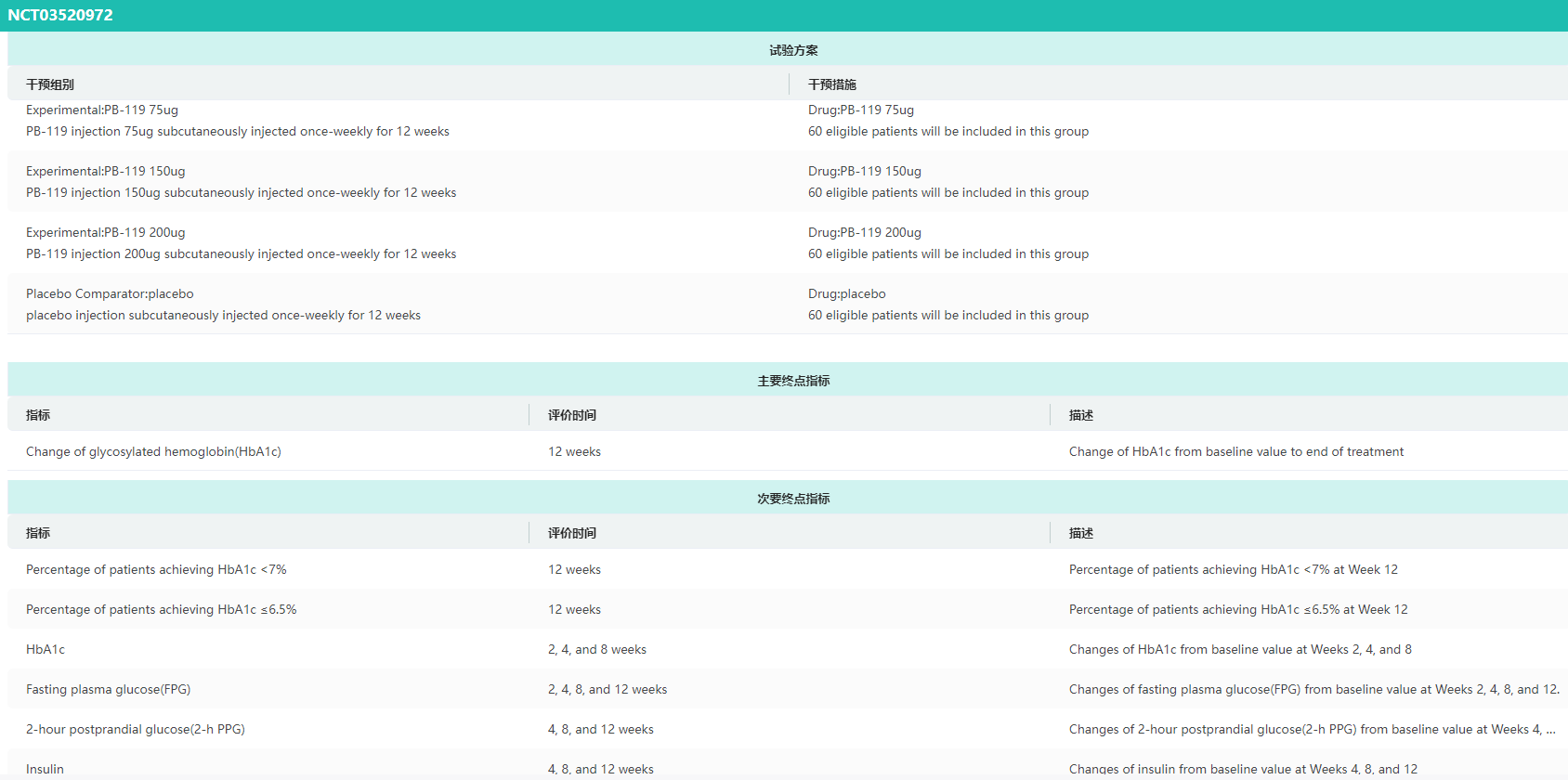
图片来源:药融云临床试验结果数据库
PB-718:长效GLP-1/GCG 受体双激动剂
作为一款双受体激动剂,能够同时激活GLP-1及GCG受体,通过平衡两种受体的激活程度,产生协同作用,实现优于单一作用机制的减重及改善脂肪代谢的效果。
PB-718是一款长效GLP-1/GCG 受体双激动剂,可以同时激活GLP-1及GCG受体,通过平衡两种受体的激活程度,产生协同作用,实现优于单一作用机制的减重及改善脂肪代谢的效果;同时,通过调节和筛选PB-718组合物中两种受体激动剂的比例,控制两种受体的激活程度,在确保药物安全性的同时,达到最优的减重和改善非酒精性脂肪肝病的效果。
PB-718经聚乙二醇化修饰的组合物,延长了药物半衰期,稳定了血药浓度,实现了一周一次给药,减少了频繁给药带来的危害与不便。目前,PB-718已完成美国I期临床。在国内,PB-718已经通过IND申请,进入临床试验阶段,
PB-119:长效GLP-1受体激动剂
PB-119是一款长效GLP-1受体激动剂,主要用于2型糖尿病及肥胖症的治疗;通过抑制食欲,作用于肠胃道,减弱肠胃运动,延缓胃排空,增加饱腹感,从而减少能量的摄入,进而达到减肥的目的。
PB-119目前进度最快的适应症是2型糖尿病,2023年9月上市申请获得受理,成为重要的商业化节点。目前,PB-119已获得NMPA针对肥胖适应症临床研究许可。
此外,派格生物的临床前候选药PB-2301和PB-2309分别有潜力成为同类最佳GLP-1/ GIP双受体激动剂和GLP-1/GIP/GCG三受体激动剂,其亦为采用创新技术的潜在同类首创激动剂。
10. 甘李药业
GZR18:长效GLP-1受体激动剂
GZR18是甘李药业开发的一款注射频率为每周1次的GLP-1R激动剂,通过葡萄糖浓度依赖性机制发挥作用,增强胰岛素分泌,有效降低血糖水平。2021年10月,GZR18首次获国家药监局批准开展临床试验。2023年6月,GZR18推进至II期临床阶段。2023年8月,GZR18分别完成适应症为成人2型糖尿病(T2DM)和肥胖/超重的两项中国IIb期临床研究的首例受试者给药。
11. 诚益生物
ECC5004:小分子GLP-1受体激动剂
ECC5004是由诚益生物内部药物发现平台发现的一款每日1次、低剂量、小分子GLP-1RA,目前正在美国进行针对2型糖尿病患者的I期临床试验(NCT06293742),预计该研究于2024年4月完成主要研究指标。ECC5004具有口服利用度高,成药性好等优势,是潜在的同类最佳的小分子GLP-1受体激动剂。诚益生物于2023年11月9日与阿斯利康达成独家许可协议,进行心血管代谢疾病领域小分子GLP-1受体激动剂ECC5004的开发和商业化。
12. 东阳光药业
HEC88473:GLP-1/FGF21双重激动剂
HEC88473注射液是一款胰高血糖素样肽-1受体(GLP-1)/成纤维细胞生长因子-21(FGF21)双重激动剂,GLP-1是一类肠促胰岛素肽,可增强葡萄糖刺激的胰岛素分泌,减少食物摄入,而FGF21属于FGF家族,具有促进葡萄糖利用、增加胰岛素敏感性、促进脂肪酸分解、减少脂质新生、调节胆固醇平衡等多种生理学活性。GLP-1/FGF21双重激动剂有望产生降糖、减重协同效果。HEC88473是国内首个获批临床的GLP-1/FGF21双重激动剂,目前处于2期临床研究阶段。
药融云可查看HEC88473注射液—药品研发历程时间轴
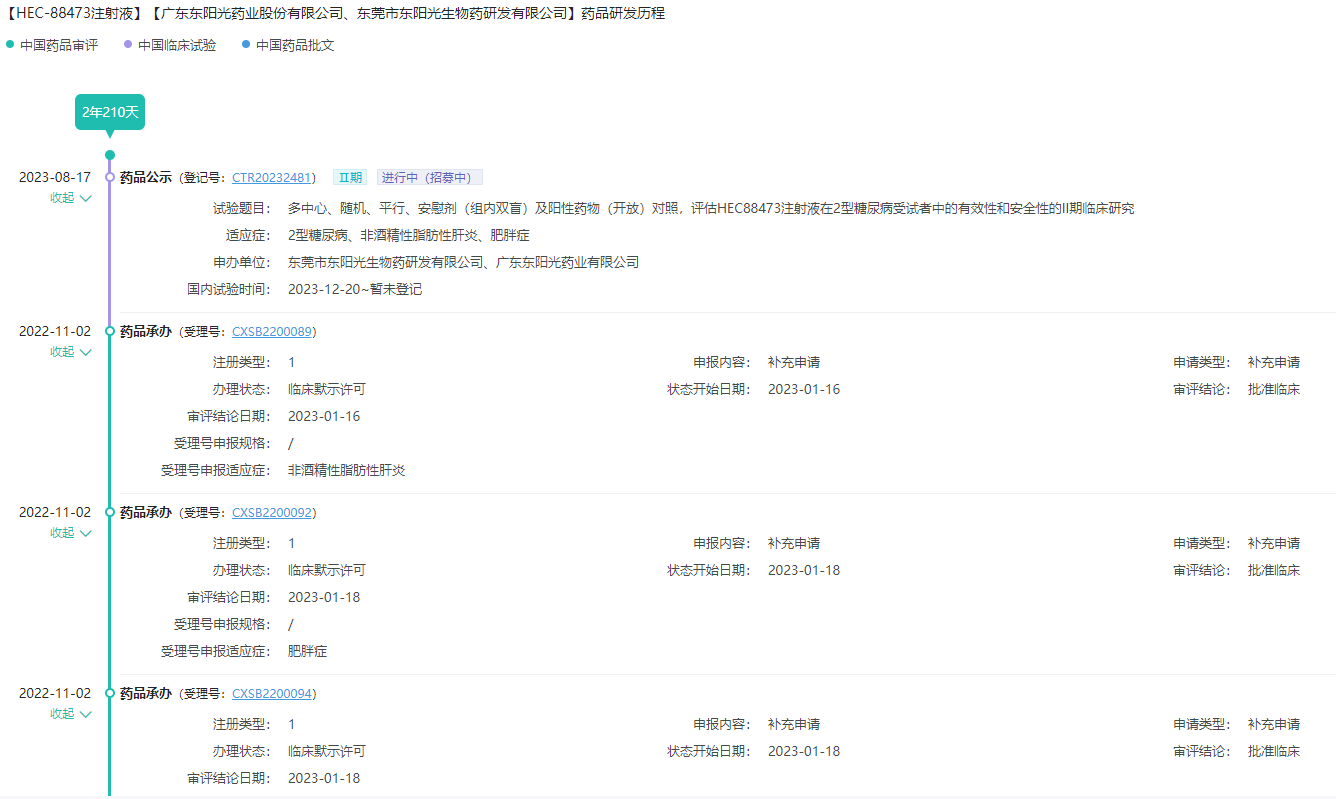
图片来源:药融云中国药品审评数据库
13. 豪森药业
聚乙二醇洛塞那肽:长效GLP-1受体激动剂
豪森药业自主创新的中国首个长效降糖药聚乙二醇洛塞那肽注射液(商品名:孚来美),于2019年5月获批上市,是国内第三个上市的长效GLP-1类药物。
聚乙二醇洛塞那肽是长效GLP-1受体激动剂,可促进葡萄糖依赖的胰岛素分泌,配合饮食控制和运动,单药或与二甲双胍联合,用于改善成人2型糖尿病患者的血糖控制。因其分子结构,每周仅需给药一次,即可实现长效治疗。
14. 常山药业
艾本那肽:长效GLP-1受体激动剂
艾本那肽由常山药业的控股子公司常山凯捷健负责研发。艾本那肽注射液是长效胰高血糖素样肽-1(GLP-1)类药物,采用独特的专利技术——药物亲和力偶合(DAC)技术,对GLP-1受体激动剂类药物Exendin-4进行化学修饰,使其能与重组人血白蛋白(rHA)相结合,从而形成稳定的Exendin-4白蛋白偶合物,通过抵抗快速降解和快速肾清除克服了天然Exendin-4较短血浆半衰期的缺点,延长了药物体内半衰期及药效持续时间,达到一周给药1次的效果。2024年4月,常山凯捷健生物提交的艾本那肽注射液上市许可申请已获国家药监局受理。
15. 银诺医药
苏帕鲁肽注射液:人源长效GLP-1RA
苏帕鲁肽注射液是中国自主知识产权的新一代人源长效GLP-1RA,通过独特的较链设计,将GLP-1与重链lgG2 Fc段结合,形成融合蛋白的分子结构,使其具备半衰期长、免疫原性低的优点。苏帕鲁肽注射液的新药上市申请已获CDE受理,用于单药治疗在饮食和运动干预后血糖控制不佳的2型糖尿病以及联合治疗二甲双胍治疗后血糖控制不佳的2型糖尿病。并且针对肥胖适应症已进入Ⅱ期临床。
结语:
基于在减肥领域的突破以及多项其他效果,《Science》杂志将GLP-1药物评选为2023年度十大科学突破之首。除降糖及减肥效果外,临床试验发现GLP-1类药物还具治疗心血管疾病、阿尔茨海默病以及帕金森病的作用。在诺和诺德、礼来两家垄断的市场之外,还存在未被填补的市场需求。国内药企如果能在价格、机制、或者产能中做得够好,都可以进一步填补未被满足的市场需要,国内药企如何卷出新意,卷出效果,最终卷出市场,是患者与资本共同的期待。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论