
在全球范围内,慢性HBV感染已成为一个备受关注的公共卫生问题。慢性乙型肝炎(CHB)是由HBV引起的、以肝脏受累为主的乙类传染性疾病。据统计,全球约有2.4亿慢性乙肝患者,而中国现存的慢性乙肝患者数量高达2000-3000万,每年新增患者多达100万,其中有700万人因严重肝脏疾病和癌症发病风险需要紧急治疗。
乙肝作为发病率最高的病毒性肝炎,如果不及时进行有效的抗病毒治疗,慢性乙肝患者的疾病进程可能会逐渐发展为肝硬化、肝衰竭甚至肝癌。在中国原发性肝癌和肝硬化的患者中,由乙肝病毒引起的比例更是达到了80%和60%。
慢性乙型肝炎药物治疗市场潜力巨大
目前,干扰素和核苷(酸)类药物是临床上批准用于治疗慢性乙肝的药物。药融数据显示,核苷类似物药物市场规模从2016年的111.6亿人民币下降至2020年的55.3亿人民币,预计随着诊断率的进一步提升,核苷(酸)类药物市场将从2025年的123.3亿增长到2030年的183.7亿;随着更多创新型乙型肝炎病毒药物陆续上市,市场将开始大幅增长。
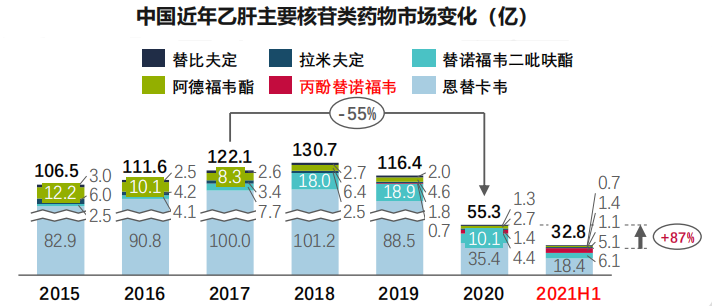
数据来源:药融云数据库
与核苷(酸)类药物单药治疗相比,序贯/联合长效干扰素的治疗策略可以提高慢性乙肝患者HBsAg的清除率,特别是部分优势患者治疗效果更显著。2021年我国长效干扰素市场容量为18.92亿元,预计到2024年增长至25.91亿元,2019-2024年CAGR为11.52%。
然而,大量的临床数据显示,干扰素在治疗48周后的标准治疗后达到程度性治愈率仅为约7%,而核苷(酸)类药物基本无法实现程度性治愈。因此,临床治疗迫切需要能够高效实现乙肝治愈的创新药物,以改善患者的治疗结局和生活质量。
在研乙肝药物主要药物类型
除抑制乙肝病毒已经上市的核苷(酸)类药物及干扰素类药物外,目前尚未有全新作用机制药物获得批准上市。乙肝治疗药物在研主要药物类型包括核苷(酸)类似物、RNA干扰类药物、病毒进入抑制剂、衣壳抑制剂、HBsAg 抑制剂、反义分子、治疗性乙肝疫苗、靶向先天免疫防御途径药物、宿主靶向途径(Host Acting Pathway)药物、基因编辑等。
国产在研全新机理乙肝新药——贺普拉肽
贺普拉肽作为一款有望实现慢性乙肝的程度性治愈的国产治疗药物,其研发进展一直备受关注。贺普拉肽(L47,Hepalatide)是上海贺普药业自主研发的1.1类创新化学药品,是一种来自乙肝病毒(HBV)Pre-S1衍生的47aa合成肽,可通过与肝细胞表面的HBV进入受体牛磺酸胆酸钠共转运多肽(NTCP)竞争性地结合以阻断HBV进入肝细胞。
贺普拉肽基本信息
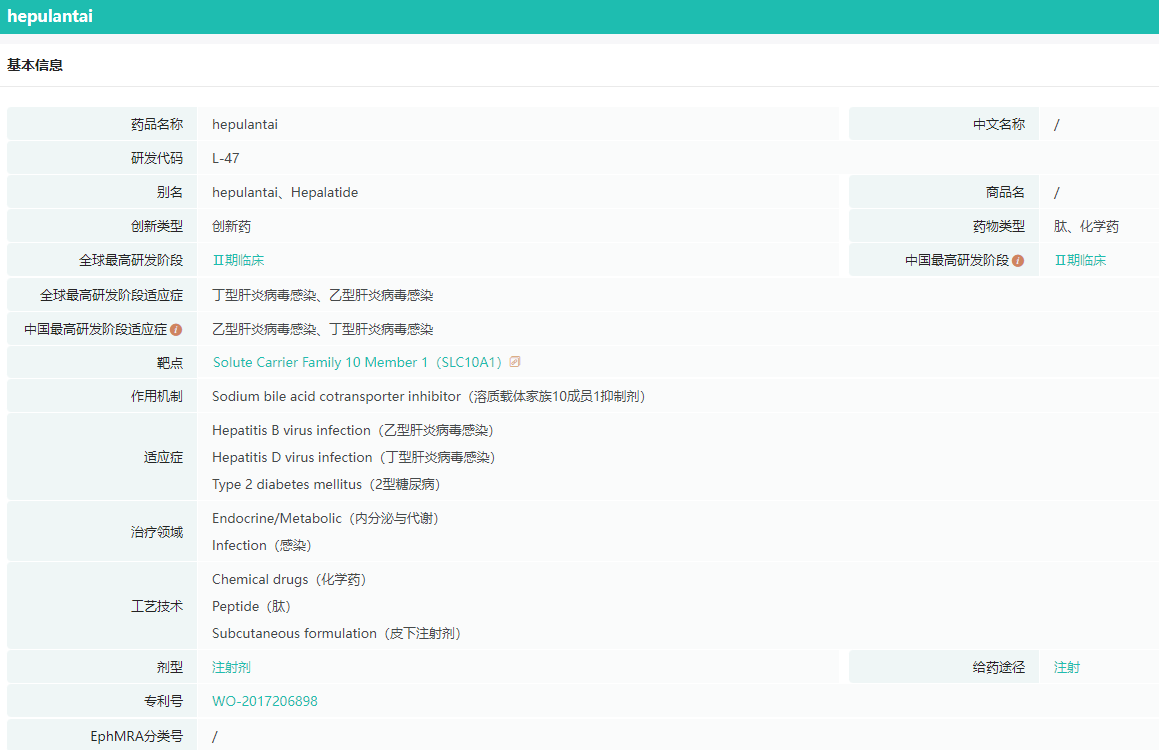
图片来源:药融云全球药物研发数据库
贺普拉肽是全新机理的抗乙肝多肽药物,通过与HBV肝细胞感染受体钠-胆酸转运蛋白NTCP特异性结合,阻断HBV感染肝细胞,打断了乙肝现有治疗中病毒清除-再感染的反复循环,保护新生健康肝细胞,提高慢性乙肝的治疗效率。其已先后获得2项“重大新药创制”国家科技重大专项支持。
贺普拉肽有望实现乙肝功能性治愈吗?
乙肝病毒(HBV)感染需要病毒进入人体后与细胞表面受体分子结合,随后渗入肝细胞内并在DNA中造成损伤。目前市场上的一些抗病毒药物主要通过抑制病毒复制来清除病毒,这些药物仅对已感染肝细胞内的HBV发挥作用,而无法保护健康的肝细胞免受HBV再次感染。
而贺普拉肽是一种新型的病毒进入抑制剂类药物,它通过抑制肝细胞表面的乙肝病毒受体,模拟健康肝细胞的受感染状态,从而限制HBV的感染能力。这就像是为病毒提供了一个“位置”,当病毒试图与肝细胞表面的受体结合并不断复制和感染新的肝细胞时,发现这个“位置”已经被贺普拉肽占据。由于“位置”已被新药占据,病毒无法找到寄生的场所,这就打破了病毒不断循环感染的过程,从而实现治愈的可能性。
贺普拉肽的疗效如何?有何优势?
据药融云全球临床试验数据库收录的公开信息显示,贺普拉肽体内阻断HBV感染评价方面,显示高、中剂量组治疗9天后HBV-DNA水平均降至检测限以下,高、中、低剂量组治疗21天血清ALT(IU/ml)水平均降至检测限以下。药代研究显示贺普拉肽具有显著的肝靶向性。
注射用贺普拉肽随机、双盲、空白对照剂量递增I期临床试验,针对单纯抗HBVPre-S1抗体阳性患者,按4:1双盲、随机进入试验和对照组。PhaseIa入组患者45例,PhaseIb入组患者35例。临床试验结果显示,药物安全性优异,获得了临床推荐剂量并验证了胆汁酸升高(TBA)呈剂量依赖关系。
据I期研究公布的数据显示,贺普拉肽联合干扰素可迅速降低HBVDNA,同时降低HBsAg、ALT和HBcrAg,临床安全性优异。在2023欧洲肝病学会年会(EASL2023)上,研究人员公布了其PhaseII期临床(NCT-04426968)数据,该项研究旨在评估贺普拉肽(Hepalatide)在未经治慢乙肝患者中的安全性和有效性。
贺普拉肽全球临床试验信息查询(部分)

图片来源:药融云全球临床试验数据库
其II期临床初步数据显示,贺普拉肽(Hepalatide)与Peg-IFN联合治疗的安全性和耐受性良好。重要的是,HBVDNA水平以贺普拉肽(Hepalatide)剂量依赖的方式迅速下降,突出了其在抗HBV治疗中的治疗潜力。
贺普拉肽研发到什么进度了?
2020年11月,注射用贺普拉肽(L47)联合聚乙二醇干扰素治疗HBeAg阳性慢性乙型病毒性肝炎随机、双盲安慰剂对照、多中心、量效关系Ⅱ期临床试验正式启动。
2023年5月,贺普药业顺利完成了贺普拉肽治疗慢性乙肝的II期临床试验(NCT04426968)最后1例受试者入组(lastpatientin,LPI)。(查看更多详情请点击:First in Class!贺普拉肽治疗慢性乙肝,II期临床试验完成入组!)该研究为一项包含96例受试者的随机双盲、安慰剂对照的临床研究,旨在探索贺普拉肽联合聚乙二醇干扰素α治疗HBeAg阳性慢性乙型肝炎的量效关系以及安全性。该临床研究预计在2023年第四季度完成,揭盲后确定贺普拉肽联合干扰素治疗乙肝的有效性。
其另一项随机双盲、安慰剂对照、多中心II期研究(NCT05244057)旨在评估三联疗法Hepalatide+聚乙二醇干扰素α +TAF对核苷经治≥ 2年的慢性乙型肝炎患者的有效性,目前正在进行受试者招募。
后续贺普拉肽将开展关键性国际多中心临床试验,根据与药监部门沟通确定的临床方案,以达到程度性治愈(HBVDNA在用药结束后6个月检测不到)为临床评价终点,达到临床终点后将有望在全球多个国家或地区进行上市注册。
贺普拉肽还在开发什么适应症?
除了乙型肝炎适应症之外,2023年2月,国家药监局药品审评中心(CDE)信息显示,注射用贺普拉肽获临床试验静默许可,拟申请用于慢性丁型病毒性肝炎。这是国内企业获得的首个丁肝适应症临床批件,具有突破性的意义。丁肝在我国尚无有效治疗药物。
贺普拉肽在研适应症全球研发现状
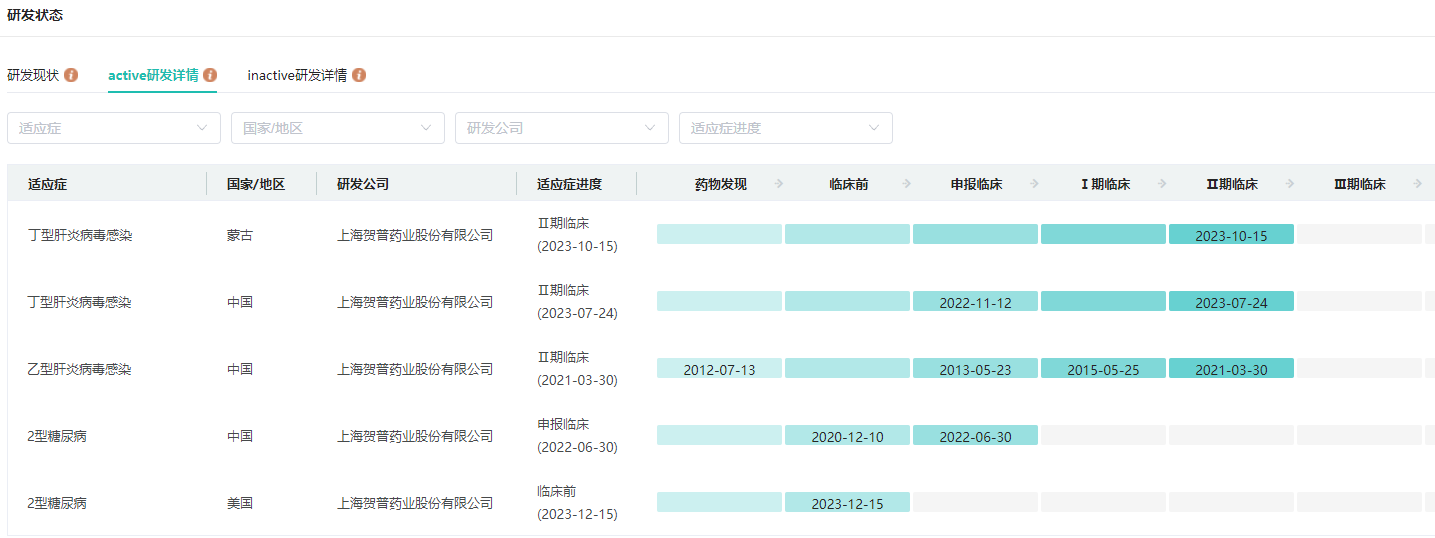
图片来源:药融云全球药物研发数据库
目前,经中国国家药品监督管理局和蒙古国卫生部批准,贺普拉肽正在中蒙联合开展治疗丁型肝炎II期临床研究,并于2023年10月15日在蒙古国家临床研究机构完成首批7名丁肝患者临床研究入组。预期于2025年完成III期临床试验,提交中蒙首个丁型肝炎治疗药物的上市申请。
另外,贺普药业还在开发贺普拉肽的糖尿病等适应症。其治疗糖尿病已收到美国FDA糖尿病Ic/IIa临床试验申请pre-INDmeeting回复,同意提交IND申请,正在准备美国IND申报;在国内,针对其2型糖尿病适应症目前正处于申报临床阶段。
关于贺普药业
贺普药业是一家病毒性肝炎领域创新药物研发企业,专注于原研新药的研发,具备从新药概念设计、临床前研究、中试研究到临床研究和新药量产的整体研发能力。 目前在研包括贺普拉肽在内的乙肝研发、糖尿病研发、非酒精性脂肪肝病的研发、高脂血症研发等。
药融云医药投融资数据库显示,贺普药业在2022年7月完成了数千万元的Pre-B轮融资,本轮融资由上海张科领弋基金独家投资。据悉,贺普药业已累计获得超过1亿元人民币投资,这些资金的加码正助力其进入新的发展阶段。
附:全球乙肝在研抗病毒新药进展统计表(2023年12月更新)
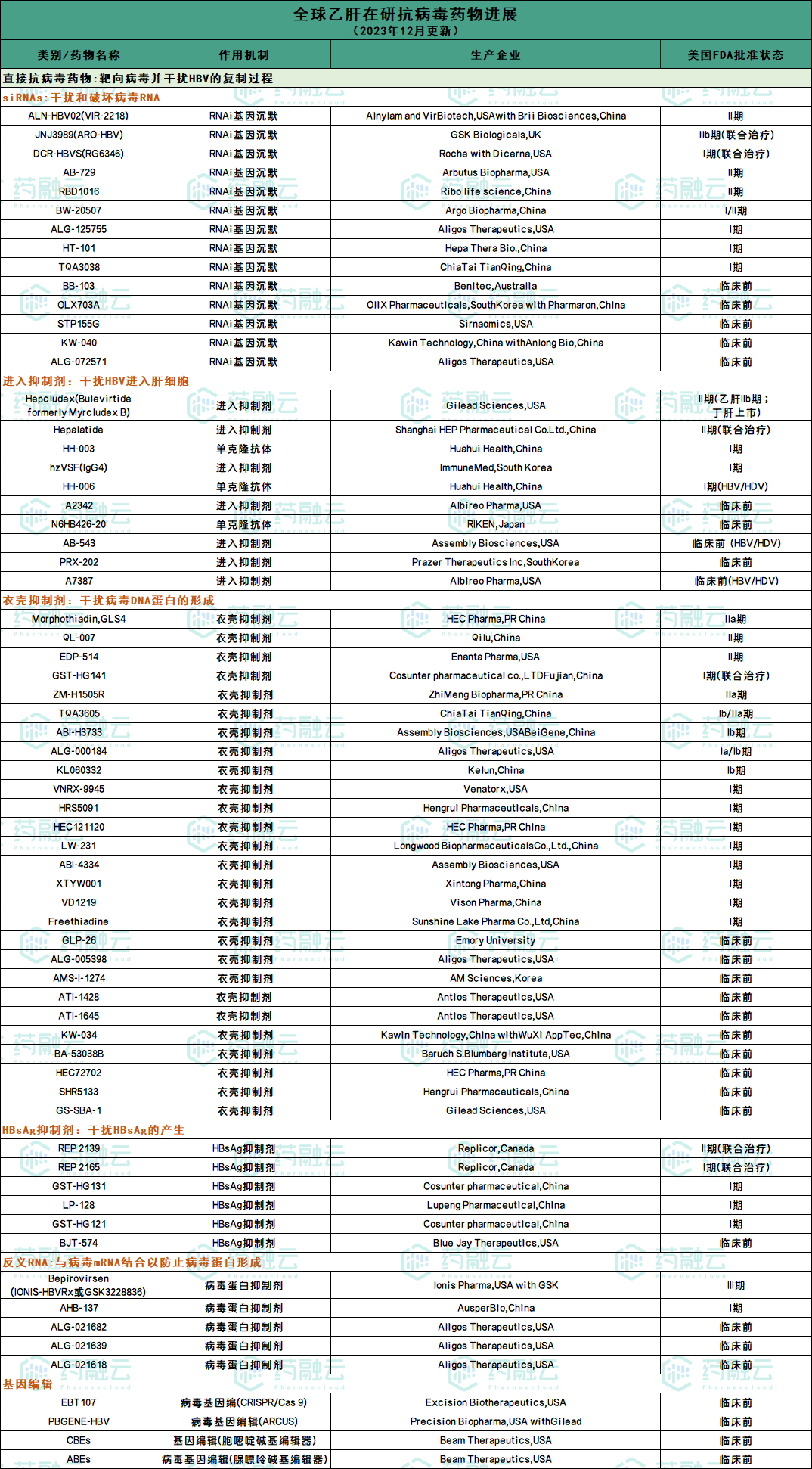
部分国产乙肝新药研发进展
RBD1016
RBD1016是瑞博生物自研的一种小干扰RNA(siRNA)药物,由siRNA与N-乙酰半乳糖胺递送系统组成,靶向慢性乙型肝炎病毒(HBV)X基因的保守区,可同时抑制HBV的4个基因转录物。目前,RBD1016正在多国进入第2期临床开发。
BW-20507
BW-20507注射液是舶望制药自主研发的一种靶向HBV的siRNA药物,目前正在中国香港、澳大利亚和泰国进行I/II期临床,以评估在健康受试者(ACTRN12623000709640)及慢乙肝患者(ACTRN12623000708651)中的安全性、耐受性、药代特征及疗效。
HT-101
HT-101注射液是复星医药旗下一款GalNAc偶联的siRNA药物,主要针对乙肝表面抗原(HBsAg)的清除。2024年2月,HT-101的临床申请获得美国FDA批准直接开展针对慢性乙型肝炎病毒感染的Ib期临床试验。
STSG-0002
STSG-0002是舒泰神研发的一款siRNA药物,由于Ia及Ib/II期临床试验中观察到的初步有效性数据未达到预期,舒泰神及全资子公司北京三诺佳邑生物近日宣布终止STSG-0002注射液的临床试验及后续开发。
QL-007
齐鲁制药自主研发的QL-007是基于衣壳抑制剂(Capsid Inhibitors)靶点的在研乙肝新药,是一种小分子HBV核心蛋白组装抑制剂。QL-007具有中等程度的血浆蛋白结合率,动物实验显示其在肝脏中具有较高的组织分布,肝血分布比为10~20,具有良好的生物利用度。目前其处于II期临床研究阶段。
推荐阅读:
2. 2025治疗乙肝新药最新消息丨ASO药物AHB-137揭盲在即,GSK836、GLS4...谁将率先冲线?
3. 2025年贺普拉肽最新动态丨II期临床证实cccDNA清除,乙肝患者迎治愈曙光
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!




















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论