
和新药上市一样,专利到期也是医药行业的一个生命周期。数据显示,从2001年开始,平均每年约有164亿美元的品牌药物面临全球各地市场专利到期。药物专利包括药品产品专利、药品制备工艺专利、药物用途专利等不同的类型。药品专利主要有药物化合物、西药复合制剂、中药组方和中药活性成分等。
2021年,一些创新药物即将丧失专利保护,这些药物为仿制药生产商提供了占领市场份额的新机会。
专利到期是所有成功的制药商最终都必须要面对的挑战。每年都会有大量的药品专利过期,一旦品牌药失去专利的保护,大量便宜的仿制药就会涌向市场,企业依靠专利保护获得的销售额和利润会一落千丈,这也正是我们熟知的“专利悬崖”。
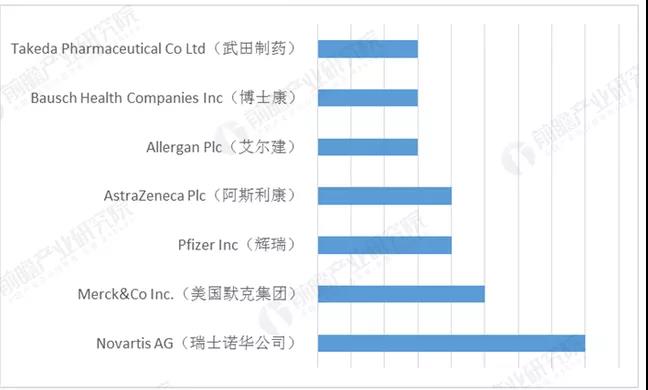
(全球专利药到期企业排名)
但是对于仿制药企业来说,与专利药相比,仿制药的研发成本和时间成本远低于专利药,仿制药在剂量、安全性、效力、作用、质量以及适应症上却完全相同,甚至均价只有专利药的20%~40%,个别品种甚至相差10倍以上。据EvaluatePharma统计,在2020-2024年仍有接近1590亿美元销售额的原研药品专利到期,原研药的大规模专利到期对仿制药引入的市场影响起到了积极作用。
获取一手数据 提前锁定目标
首仿药在美国指的是根据《药品价格竞争和专利期恢复法》在“专利无效或者批准正在申请的药物不会侵犯专利”的情况下,第一个仿制申请者将拥有180天的市场专卖权。
而在国内指的是在专利保护药品保护期结束后,自国内第一家企业生产的仿制药品上市起5年内,前3个仿制药品的政府指导价,以被仿制药品政府指导价为基础,依次递减10%制定;被仿制药品在国内没有上市销售的,以第1个仿制药品的定价成本为基础制定政府指导价,第2-3个仿制药品的政府指导价,以此为基础依次递减10%。
可以看出来相关企业一旦抢得首仿药上市,不仅可以享有一段时间的独占期,还可以在定价政策上也比后续的跟进者更有优势。在欧美市场上,Teva、Sandoz等一众仿制药企业的成功证明了这一点。而且提前上市更意味着更快铺开市场,市场占有率也有可能更高。但是,当前国内企业对于未来到期专利药的抢先研发非常激烈,目光甚至已经聚焦到10年之后专利到期的药品上。
仿制药企想要抢先占领仿制药市场份额的话,首先需要依托生物医药大数据库,掌握涵盖专利题目、拥有企业、发明人、专利申请人、优先权号、同族专利等全面信息,来解决长期以来仿制药企业存在的:信息支持不足、信息资源利用不充分,信息时效性低等问题;还需要根据时间筛选出国外知名药企前期立项和研发的API品种等数据,结合市场、专利、合成路线来评估,最后制定出有市场前景、竞争度低,适合企业自身且可以避开专利的最佳API品种。
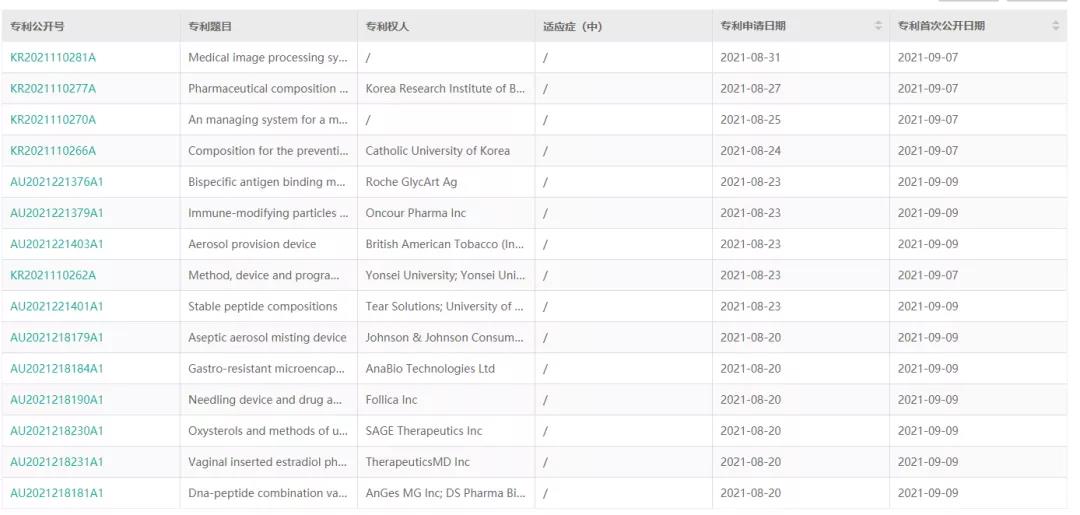
(药融云全球药物研发数据库 全球医药专利专栏一览)
深度分析同族专利 提高市场份额
我国作为仿制药生产大国,目前国内医药产品的70% 为仿制药,约有 90% 的本土制药企业以仿制药的业务为主,但从市场实际情况来看,由于中国国产仿制药的质量并不高,其占据的市场份额非常小,也很难出口到境外。
其主要原因是对于我国大部分中小型仿制药企来说,锁定仿制目标只是立项的第一步,但是往往忽略了很多大型药企会通过专利组合(包括剂型专利、制造专利等)、对已申请专利的化合物拓展新的治疗领域等手段来延长自己的专利时间,而且在国内一致性评价推出后对仿制药企的技术实力又提出了更高的要求。
在专利技术壁垒较高的情况下,我国仿制药企需要依靠分析大量的专利文献,特别是通对专利的同族情况进行追踪分析,研究专利权人对原研药的完整专利布局,追溯技术演变的全过程,找到技术源头,采用避开工艺、改变晶型、形成新组合物等方式绕开从属专利的限制。同时增加在创新研发阶段的投入,在创新中有仿制,在仿制中有创新,仿制、创新相结合,对可能进行改进的方面及时进行二次创新,生产出较高质量的药品,制定更高回报的产品管线,树立自己的技术优势,确保企业占领首仿药地位,在为市场贡献高质量仿制药品的同时为企业创造更高的效益。
—END—





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论