
创新非坦途。专利悬崖给一些MNC药企的基石治疗领域致命打击。因此外部继续买买买候选分子或者收购新药公司,是长期要做的事情。
近期,百时美施贵宝(纽约证券交易所代码:BMY)与强生公司联合宣布,决定终止 III 期 Librexia ACS 临床试验。该试验旨在评估急性冠脉综合征(ACS)近期发病患者在标准治疗(传统抗血小板治疗)基础上联合使用 米维沙星(milvexian)的疗效与安全性。此次终止决定基于独立数据监测委员会(IDMC)的预设中期分析结果,该分析判定试验大概率无法达到主要疗效终点。
未发现与该研究性疗法相关的新安全性问题,其安全性特征与此前公布的米维沙星相关研究一致。
Librexia 临床试验项目还包括另外两项 III 期试验:针对心房颤动(AF)患者的 Librexia AF 试验,以及用于卒中二级预防(SSP)的 Librexia STROKE 试验。IDMC 建议这两项试验按原计划继续推进,预计 2026 年公布顶线数据。(终止一项3期,其他的继续还有推进)
百时美施贵宝免疫与心血管药物研发高级副总裁、医学博士罗兰・陈(Roland Chen)表示:“我们与强生公司仍对米维沙星重塑抗凝治疗的潜力充满信心,有望为患者和临床医生提供一种新型治疗选择 —— 在降低血栓风险的同时,不会显著增加潜在出血风险。我们对卒中二级预防和心房颤动相关研究的信心十足,这一信心源于在相关患者群体及不同基础治疗方案下开展的大型 II 期临床试验所提供的可靠数据。Librexia SSP 和 AF 试验与 Librexia ACS 试验在多个方面存在差异,包括患者群体、试验终点、基础治疗的类型和持续时间以及疾病病理机制。”
研究调查人员将收到最新通知,相关数据将在未来的医学大会上向科学界分享。
威尔康奈尔医学院院长、康奈尔大学医学事务教务长、医学博士罗伯特・A・哈林顿(Robert A. Harrington)同时担任 Librexia 项目主席,他表示:“今日的消息证实了急性冠脉综合征治疗的复杂性,也凸显了进一步深化该疾病认知的必要性。尽管米维沙星在本试验中未引发任何新的安全性问题,但 XIa 因子抑制仍是广义血栓治疗领域中极具前景的作用机制,有望在血栓性疾病的标准治疗之外取得新的突破。”
百时美施贵宝与强生公司向参与 Librexia ACS 试验的患者、研究人员及临床试验机构表示感谢。
关于急性冠脉综合征(ACS)
急性冠脉综合征是一个统称,指供应心肌的血液突然减少的一系列情况,通常由血栓引起。其包括心肌梗死(MI,俗称心脏病发作)和不稳定型心绞痛 —— 表现为突发的剧烈胸痛,通常发生在患者休息或轻微活动时。全球每年有超过 700 万人被诊断为急性冠脉综合征。首次发病后一年内,心肌梗死、缺血性卒中及心血管死亡等复发性心血管事件的风险仍高达 5% 以上。尽管抗血栓治疗已取得一定进展,但由于潜在的出血风险,抗凝治疗并不常与抗血小板治疗联合使用,导致许多急性冠脉综合征患者仍面临血栓事件的威胁。
关于米维沙星(milvexian)
米维沙星是一种研究性口服高选择性 XIa 因子(FXIa)抑制剂,属于一类新型在研抗凝药物。其研发目标是在预防阻碍血流的有害血栓形成的同时,保留正常的凝血过程(止血功能)。因此,米维沙星有望在减少由有害血栓引发的主要心血管事件的同时,不显著增加出血风险。目前,该药物正在 III 期 Librexia 项目中进行研究,这是迄今为止最全面的 XIa 因子临床开发项目,旨在预防主要血栓性疾病。
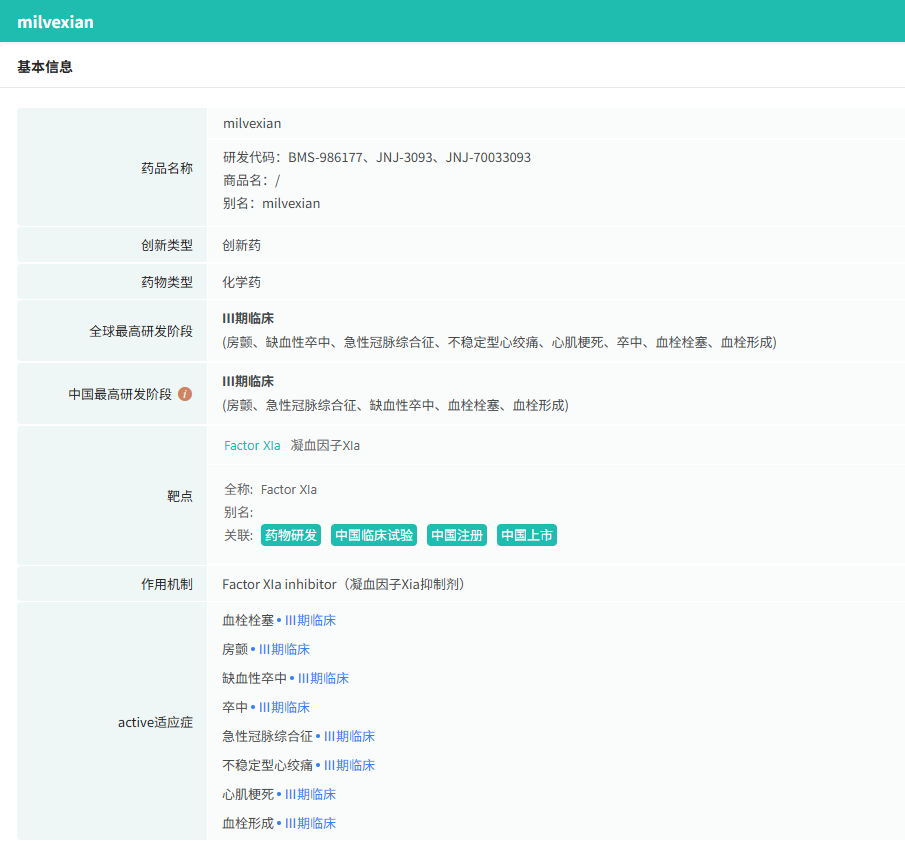
截图来源:摩熵医药数据库-全球药物研发数据库
米维沙星属于研究性药物,尚未在任何国家获得针对任何适应症的上市批准。
关于 Librexia 项目Librexia 项目由强生公司与百时美施贵宝联合开展,是目前最全面的抗 XIa 因子临床开发项目。该项目在三项 III 期研究中纳入了超过 5 万名患者,包括急性冠脉综合征相关事件减少研究(Librexia ACS)、心房颤动卒中预防研究(Librexia AF)以及急性缺血性卒中或高危短暂性脑缺血发作后的卒中预防研究(Librexia STROKE)。基于可靠的 II 期数据,Librexia 项目旨在评估特定患者群体的获益 - 风险特征 —— 这些患者本应接受治疗,但由于潜在的出血风险增加而可能未得到治疗。该项目的设计和样本量足以有望突破现有标准治疗,帮助改善各类血栓性疾病患者的预后。
关于 Librexia ACS 试验
Librexia ACS 试验(NCT05754957)是一项随机、双盲、安慰剂对照、事件驱动型研究,旨在评估急性冠脉综合征近期发病患者使用米维沙星的疗效与安全性。
入组合格患者为 18 岁及以上成人,急性冠脉综合征发病 7 天内,已接受心脏导管插入术联合经皮冠状动脉介入治疗,或接受保守治疗(无论是否进行导管插入术),且正在接受标准抗血小板治疗。此外,患者必须具备至少两项与复发性缺血事件风险增加相关的风险增强因素。
主要终点为:在传统抗血小板治疗基础上联合米维沙星与安慰剂相比,至首次发生主要不良心血管事件(MACE,包括心血管死亡、心肌梗死和缺血性卒中)的时间。次要终点包括:至首次发生全因死亡(AMC)、心肌梗死和缺血性卒中复合终点的时间;至心血管死亡的时间;至全因死亡的时间。
关于 Librexia AF 试验
Librexia AF 试验(NCT05757869)是一项随机、双盲、双模拟、平行组、活性对照研究,旨在评估米维沙星与阿哌沙班在心房颤动(AF)患者中的疗效与安全性。
入组合格患者为 18 岁及以上成人,病情稳定,适合长期抗血栓治疗,且患有适合接受抗凝治疗的心房颤动。此外,患者必须满足以下一类或两类风险因素:a)具备以下一项或多项风险因素:i)年龄≥75 岁;ii)有任何类型卒中病史(包括任何症状性卒中);b)具备以下两项或多项风险因素:i)年龄 65-74 岁;ii)高血压;iii)糖尿病;iv)动脉粥样硬化性血管疾病;v)心力衰竭。
主要终点为:至首次发生卒中及非中枢神经系统(CNS)全身性栓塞复合终点的时间。次要终点包括:至首次发生以下事件的时间 —— 国际血栓与止血学会(ISTH)定义的大出血;ISTH 大出血与临床相关非大出血(CRNM)复合终点;卒中、非中枢神经系统全身性栓塞与 ISTH 大出血复合终点;心血管死亡、心肌梗死、卒中与非中枢神经系统全身性栓塞复合终点;心血管死亡;全因死亡、心肌梗死、卒中与非中枢神经系统全身性栓塞复合终点;心血管死亡、心肌梗死、卒中、任何意外血运重建或缺血肢体截肢以及因缺血性血管原因(包括深静脉血栓形成和肺栓塞)紧急住院的复合终点。
关于 Librexia STROKE 试验
Librexia STROKE 试验(NCT05702034)是一项 III 期、随机、双盲、平行组、安慰剂对照研究,旨在评估在单药或双联抗血小板治疗基础上联合使用米维沙星,对急性缺血性卒中或高危短暂性脑缺血发作患者的卒中预防疗效与安全性。
入组合格患者为 40 岁及以上成人,患有缺血性卒中,存在可归因于急性脑梗死的神经功能缺损,美国国立卫生研究院卒中量表(NIHSS)评分≤7 分,且满足以下至少一项条件:随机化时仍存在缺血事件的持续体征或症状;经标准神经影像学检查确认存在急性缺血性脑部病变;接受过溶栓或取栓治疗;或短暂性脑缺血发作(根据病史或检查,存在归因于脑部局灶性缺血的急性起病神经功能缺损,且缺损症状完全缓解,神经影像学检查未发现脑梗死)。患者在确定合格后尽快随机分组,且需在事件发生后 48 小时内完成分组。
主要终点为:至首次发生缺血性卒中的时间。次要终点包括:至首次发生以下事件的时间 —— 心血管死亡(CVD)、心肌梗死(MI)或缺血性卒中复合终点的任何组成部分;90 天内发生的缺血性卒中;主要不良血管事件(包括心血管死亡、心肌梗死、缺血性卒中、主要不良肢体事件、症状性肺栓塞或深静脉血栓形成)复合终点的任何组成部分。
参考来源:
[1] NMPA/CDE官网
[2] 摩熵医药(原药融云)数据库
[3] FDA/EMA/PMDA
[4] https://www.businesswire.com/news/home/20251113242684/en/Update-on-Phase-3-Librexia-ACS-Trial
[5] investor.relations@bms.com等
扩展阅读:
3. 遭赛诺菲分手的SGL1/2抑制剂Zynquista临床成功 媲美恩格列净
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论