
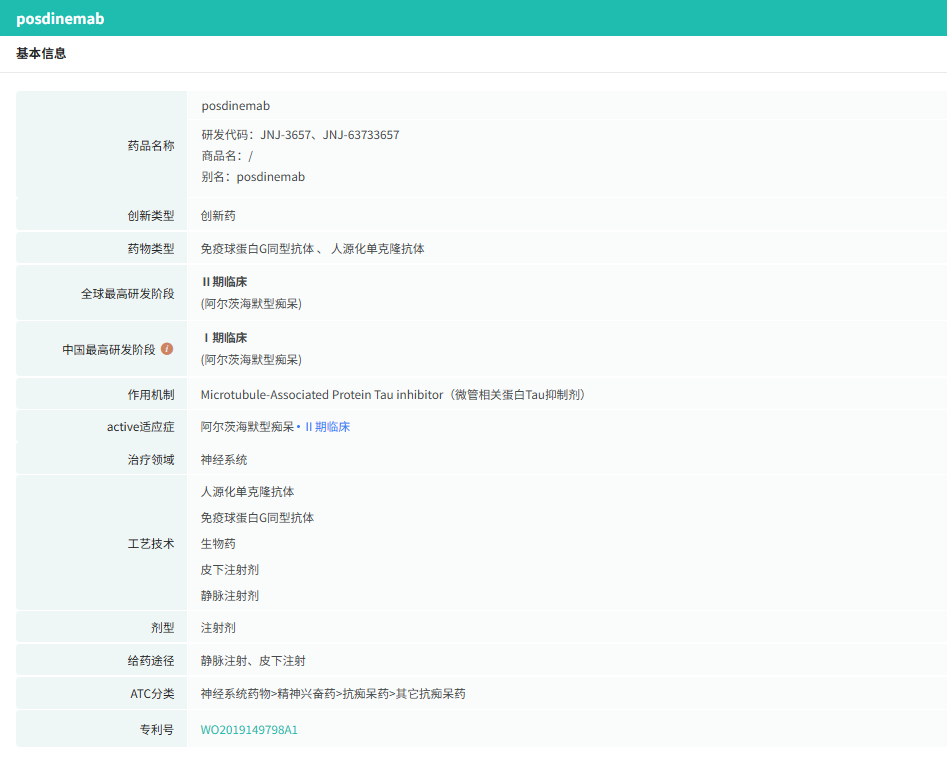
近日,强生宣布终止了一款针对阿尔茨海默病的posdinemab单抗临床试验,终止研究的决定是在一次预定的审查之后做出的,审查结果显示posdinemab在减缓临床衰退方面未达到统计学意义。
截图来源:摩熵医药数据库-全球药物研发数据库
Posdinemab是一种单克隆抗体,其作用是靶向磷酸化的疾病相关tau蛋白。尽管posdinemab的试验结果令人失望,但强生对阿尔茨海默病领域继续开发。除了posdinemab之外,强生的tau蛋白靶向策略还包括JNJ-2056。JNJ-2056是一种靶向磷酸化tau蛋白的主动免疫疗法,目前正与AD Immune合作开发。该候选药物最近已进入II期测试,旨在延迟或预防无症状AD患者的认知衰退。
其实,强生在此前已终止含posdinemab在内的4项临床试验,涵盖肿瘤、抑郁症、类风湿性关节炎等多个领域重点项目。
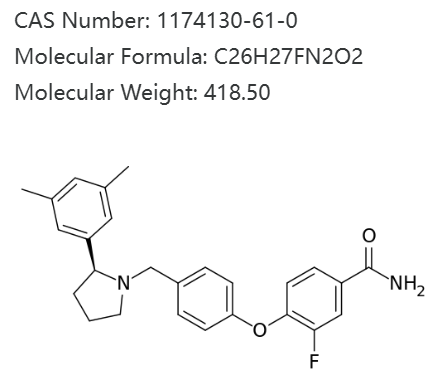
3月6日,强生宣布,已决定终止 Ventura III期临床开发项目,该项目旨在评估κ-阿片受体拮抗剂aticaprant作为重度抑郁症(aMDD)辅助治疗的疗效。由于在目标患者群体中疗效不足,该项目被叫停。
aticaprant分子结构
8月29日,强生公司宣布其靶向FcRn尼卡利单抗(nipocalimab)联合抗肿瘤坏死因子α(抗TNFα)疗法治疗难治性类风湿关节炎的IIa期概念验证研究(DAISY)未达到主要终点。
这项多中心、随机、双盲研究显示,治疗第12周时,联合疗法组与安慰剂组相比,在疾病活动度评分上没有显著差异。基于这些发现,强生决定不再推进尼卡利单抗在该适应症上的后续临床开发。
尼卡利单抗最初由AnaptysBi开发,之后卖给了Momenta公司。2020年8月,强生以65亿美元价格收购Momenta,获得了这款药物。今年4月末,尼卡利单抗首次在美国获批上市,用于治疗重症肌无力。
11月14日,BMS和强生共同宣布,决定终止 Librexia ACS III 期临床研究。该研究旨在评估在标准护理(常规抗血小板治疗)基础上加用 milvexian 对于近期发生急性冠状动脉综合征(ACS)事件患者的疗效和安全性。
终止试验的决定是基于独立数据监察委员会(IDMC)进行的一项预先计划的中期分析结果,该分析认为该试验不太可能达到主要疗效终点。未发现与试验药物相关的新的安全性问题。其安全性特征与先前报告的 milvexian 研究结果一致。
Milvexian 是一种在研的口服、高选择性 XIa 因子(FXIa)抑制剂,旨在预防导致血流受限的有害凝血(血栓形成),同时保留正常的凝血过程(止血)。
参考来源:
[1] 公司官网/官网披露
[2] 摩熵医药(原药融云)数据库
扩展阅读:
1. 强生LAZERTINIB+Amivantamab组合疗法获批:针对EGFR突变NSCLC疗效显著
2. 强生尼卡利单抗Ⅱ/Ⅲ 期研究:青少年重症肌无力治疗取得积极成果
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



































![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yry-public-oss.pharnexcloud.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)



















 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论