1.4.1 本周全球TOP10创新药研发进展
(1)绿叶制药双靶点新药LY03017在美国获批临床
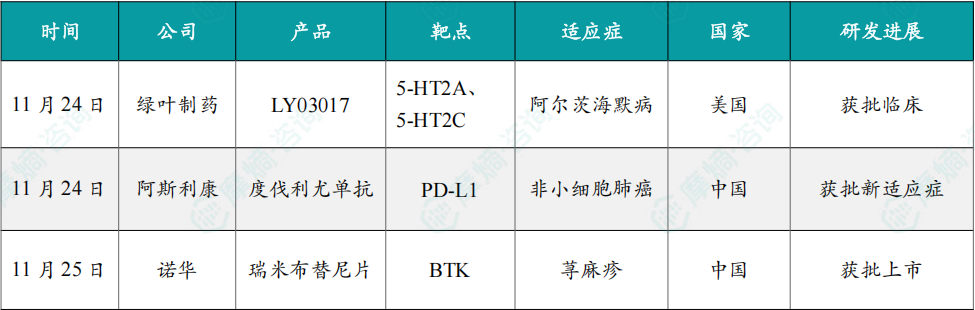
11月24日,绿叶制药宣布,其自主研发的新一代5-羟色胺2A型受体(5-HT2AR)反向激动剂和5-羟色胺2C型受体(5-HT2CR)拮抗剂 LY03017 已获得美国FDA许可开展临床试验。
LY03017 拟用于治疗阿尔茨海默病精神病性障碍、帕金森病精神病性障碍、精神分裂症阴性症状。FDA本次豁免了其1期临床试验中单次给药剂量递增(SAD)试验环节,该药物后续可直接启动多次给药剂量递增(MAD)以及后续的临床试验。
LY03017 基于绿叶制药的新分子实体/新治疗实体技术平台开发,是该公司又一款在中国和美国同步开发的中枢神经系统(CNS)治疗领域创新药。目前,LY03017 也在中国处于1期临床阶段。
(2)阿斯利康PD-L1抑制剂度伐利尤单抗在华获批新适应症,针对肺癌
11月24日,阿斯利康(AstraZeneca)宣布,PD-L1抑制剂度伐利尤单抗获中国国家药品监督管理局(NMPA)批准,适用于在接受铂类药物为基础的同步或序贯放化疗后未出现疾病进展的未携带已知表皮生长因子受体(EGFR)敏感突变或间变性淋巴瘤激酶(ALK)重排的不可切除III期非小细胞肺癌(NSCLC)患者的治疗。基于PACIFIC-5 3期临床试验结果(无论患者接受的是同步放化疗还是序贯放化疗,该产品治疗均显示出显著获益),本次批准将适用人群扩展至接受序贯放化疗的患者。
此次获批是基于PACIFIC-5 3期临床试验的阳性结果,该结果于2024年12月在新加坡举行的欧洲肿瘤内科学会(ESMO)亚洲大会上公布。在盲法独立中心评审(BICR)下的临床结果显示,与安慰剂相比,接受度伐利尤单抗治疗的患者疾病进展或死亡风险估计降低25%。亚组分析显示,无论患者接受的是同步CRT还是序贯CRT,均能从度伐利尤单抗治疗中获益。
(3)诺华BTK抑制剂在中国获批治疗慢性自发性荨麻疹
11月25日,诺华公司(Novertis)宣布,其创新药物瑞米布替尼片获得中国国家药品监督管理局批准,适用于H1抗组胺药控制不充分的成人慢性自发性荨麻疹(CSU)患者。
新闻稿指出,瑞米布替尼片的获批有望构建CSU治疗新格局,开启口服小分子靶向治疗新篇章。此外,瑞米布替尼片的获批也代表了布鲁顿酪氨酸激酶(BTK)靶点在自身免疫和过敏性疾病中的重要拓展。
公开资料显示,目前临床上主要采用抗组胺药治疗CSU。然而,超过50%的CSU患者在仅使用标准剂量H1抗组胺药的情况下仍然无法有效控制症状。瑞米布替尼片是一种高选择性共价结合BTK抑制剂,可阻断BTK级联反应并抑制导致瘙痒性风团和肿胀的组胺及其他介质释放。
(4)信达生物玛仕度肽高剂量9mg在中国申报上市,针对中重度肥胖人群
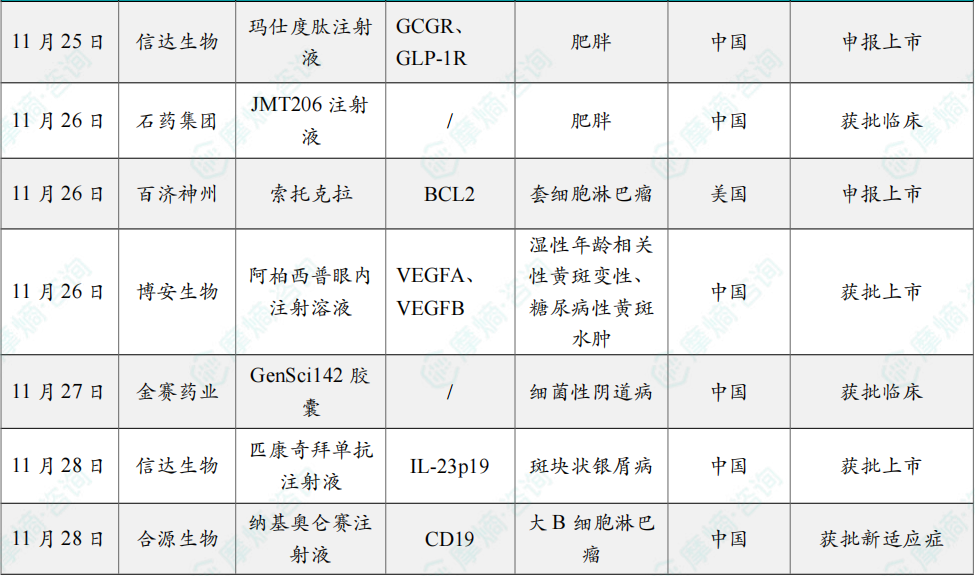
11月25日,信达生物宣布:玛仕度肽注射液(胰高血糖素[GCG] /胰高血糖素样肽-1[GLP-1] 双受体激动剂)高剂量9mg用于成人中重度肥胖患者长期体重控制上市申请已获中国国家药品监督管理局(NMPA)药品审评中心(CDE)受理。
玛仕度肽有望在减重手术之外,为中国中重度肥胖人群提供一个强效、安全的新治疗选择。 本次上市申请基于玛仕度肽9mg在中国中重度肥胖人群中开展的3期注册临床研究GLORY-2(NCT06164873)的结果。该研究近期达成了主要终点和所有关键次要终点。
玛仕度肽(IBI362)是信达生物与礼来制药共同推进的一款GCG/GLP-1双受体激动剂。作为一种哺乳动物胃泌酸调节素(OXM)类似物,玛仕度肽除了通过激动GLP-1R促进胰岛素分泌、降低血糖和减轻体重外,还可通过激动GCGR增加能量消耗增强减重疗效,同时改善肝脏脂肪代谢。
(5)石药集团减重1类新药获批临床
11月26日,石药集团宣布,该公司开发的重组全人源抗ActRIIA/IIB单克隆抗体药物 JMT206注射液 已在中国获得临床研究默示许可,拟开发治疗肥胖或超重合并至少一种体重相关合并症人群的体重管理。
据石药集团新闻稿介绍,JMT206 可同时特异性结合激活素受体IIA型(ActRIIA)与IIB型(ActRIIB),阻断激活素A(ActivinA)、肌抑素(GDF8)以及生长分化因子11(GDF11)与激活素受体II型(ActRII)的结合,从而抑制下游信号通路的激活,减少肌肉流失,并促进骨胳肌维持与增长,以达到增肌减脂的效果。同时,该产品亦可协助GLP-1受体激动剂实现更高质量的减重疗效。
(6)百济神州BCL2抑制剂索托克拉在美国申报上市
11月26日,百济神州宣布FDA已受理新一代BCL2抑制剂索托克拉的新药上市申请(NDA),并授予优先审评资格,拟用于治疗接受过布鲁顿氏酪氨酸激酶(BTK)抑制剂治疗的复发或难治性(R/R)套细胞淋巴瘤(MCL)患者。
索托克拉是一款新一代且具有同类最优潜力的在研BCL2抑制剂,具有独特的药代动力学和药效学特征。实验室和早期药物开发研究结果表明,索托克拉是一种具有强效性和特异性的BCL2抑制剂,半衰期短且无蓄积。
索托克拉在多种B细胞恶性肿瘤中表现出良好的临床活性,正在进行单药和联合疗法的开发,其中包括和百悦泽的联合治疗。
值得关注的是,在早期临床试验中,索托克拉联合百悦泽治疗初治慢性淋巴细胞白血病(CLL)患者在短时间内显示出前所未有的微小残留病不可检出(uMRD)率。迄今为止,共有超过2200例患者入组了该药物全球开发项目。
(7)博安生物阿柏西普生物类似药获批上市
11月26日,博安生物宣布其自主研发的 博优景®(阿柏西普眼内注射溶液)正式获得国家药监局的上市批准,用于治疗成人的新生血管(湿性)年龄相关性黄斑变性(nAMD)和糖尿病性黄斑水肿(DME)。
该药物是继齐鲁制药的 卓初明®(QL1207)之后第二款获得国家药监局批准的阿柏西普生物类似药。博安生物将携手国内领先的眼科医药平台公司欧康维视共同开展该产品在中国大陆的商业化。
博优景®是艾力雅®(英文商品名:EYLEA®)的生物类似药,其活性成分阿柏西普为一种人源化融合蛋白,能够与血管内皮生长因子(VEGF-A、VEGF-B)及胎盘生长因子(PlGF)结合,与抗VEGF单抗类药物相比作用靶点更广泛。作为nAMD、DME等多种眼底疾病的一线用药,阿柏西普对眼内VEGF的抑制时间久,可有效改善视力,具有长期疗效,且总体安全性和耐受性良好。
(8)金赛药业抗感染1类新药获批临床
11月27日,长春高新发布公告称,金赛药业1类新药 GenSci142胶囊 获批临床,拟开发治疗细菌性阴道病。这是一款1类创新生物制品。
细菌性阴道病(BV)是育龄期女性中最常见的阴道感染性疾病之一。BV病理机制主要表现为兼性及专性厌氧菌,尤其以加德纳菌的过度增殖最为显著。
根据公告介绍,GenSci142胶囊通过生物信息学筛选序列,通过AI设计优化分子结构,可直接破坏细菌细胞壁,选择性快速杀细菌性阴道炎的主要病原体,充分保留保护性乳杆菌,同时,穿透并瓦解生物膜,使致病菌无藏身死角,减少复发。本产品临床反应迅速,有望12小时内症状显著减轻,对甲硝唑耐药感染(90%的耐药比例)依然有效,通过阴道局部给药,无全身暴露风险,使用安全。与传统药物相比,具有快速起效、精准杀菌、深度清除、低耐药风险和局部作用安全等核心优势。
(9)信达生物的匹康奇拜单抗注射液获批上市,治疗银屑病
11月28日,信达生物宣布,重组抗白介素23p19亚基(IL-23p19)抗体匹康奇拜单抗注射液(研发代号:IBI112)获得中国国家药品监督管理局(NMPA)批准,用于适合系统性治疗的中重度斑块状银屑病成人患者。
银屑病呈慢性、复发性特征,常伴瘙痒、疼痛、鳞屑与外观改变,显著影响患者生活质量与心理健康。
匹康奇拜单抗作为一款IL-23p19单抗,创新性地对抗体Fc段进行改造,显著延长了药物半衰期,具有更优皮损清除疗效和更长维持间隔的综合获益优势。该产品在临床研究中展现出较好的短期疗效并实现长期疗效的良好维持;维持期每12周给药一次,极大改善了患者的用药便利性与依从性。
(10)合源生物CAR-T疗法获批新适应症,治疗淋巴瘤
11月28日,合源生物宣布,其自主研发的CAR-T细胞治疗产品纳基奥仑赛注射液新药上市获得中国国家药品监督管理局的批准,用于治疗经过二线及以上系统性治疗后复发或难治性大B细胞淋巴瘤(r/r LBCL)。这是纳基奥仑赛注射液继2023年11月获批治疗成人复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL)后,在中国获得的第二个新药上市批准。
淋巴瘤是最常见的恶性血液系统肿瘤之一,大B细胞淋巴瘤(LBCL)是成人非霍奇金淋巴瘤(NHL)中最常见的类型。一线治疗后,约40%的患者会出现进展或复发,这类患者预后较差,临床治疗面临巨大挑战。此项新适应症上市获批是基于一项纳基奥仑赛注射液用于治疗r/r LBCL的单臂、开放、多中心关键性2期临床研究(NCT04586478)的积极结果。
1.4.2 本周全球TOP10积极/失败临床结果
(1)华奥泰IL-17A靶向单抗HB0017注射液3期临床达终点
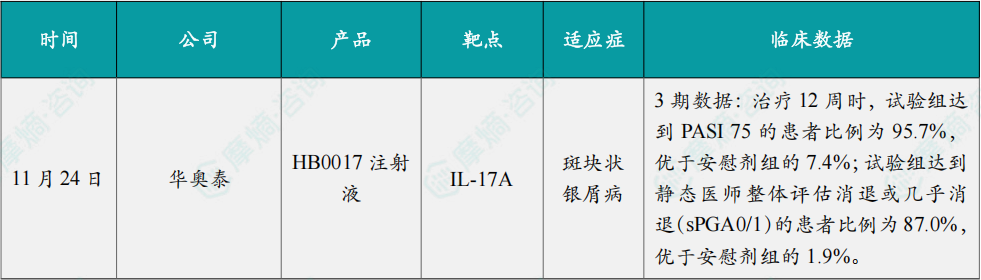
11月24日,华奥泰宣布,其自主研发的HB0017注射液治疗中重度斑块状银屑病的关键性3期临床研究已完成揭盲,达到所有主要和关键次要终点。新闻稿表示,这一积极结果为公司向中国国家药监局(NMPA)提交上市申请奠定基础。HB0017注射液是一款以白介素-17A(IL-17A)为靶点的单克隆抗体,拟用于治疗中重度斑块状银屑病、强直性脊柱炎及其他自身免疫疾病。
这是一项多中心、随机、双盲、安慰剂对照3期临床试验,共纳入408例中国中重度斑块状银屑病患者。研究达到预设的所有主要疗效终点(第12周时达到PASI 75的受试者比例、第12周时达到sPGA 0/1的受试者比例)和关键次要疗效终点(第12周达到PASI 90的受试者比例)。顶线数据显示,HB0017的核心治疗期(前12周)和维持治疗期(12-52周)疗效数据达到了预设的研究目标:治疗12周时,试验组达到PASI 75的患者比例为95.7%,优于安慰剂组的7.4%;试验组达到静态医师整体评估消退或几乎消退(sPGA0/1)的患者比例为87.0%,优于安慰剂组的1.9%。关键次要终点也达成,治疗12周时,试验组达到PASI 90的患者比例为88.0%,优于安慰剂组的1.9%。
(2)君实生物的特瑞普利单抗皮下注射3期临床达主要终点
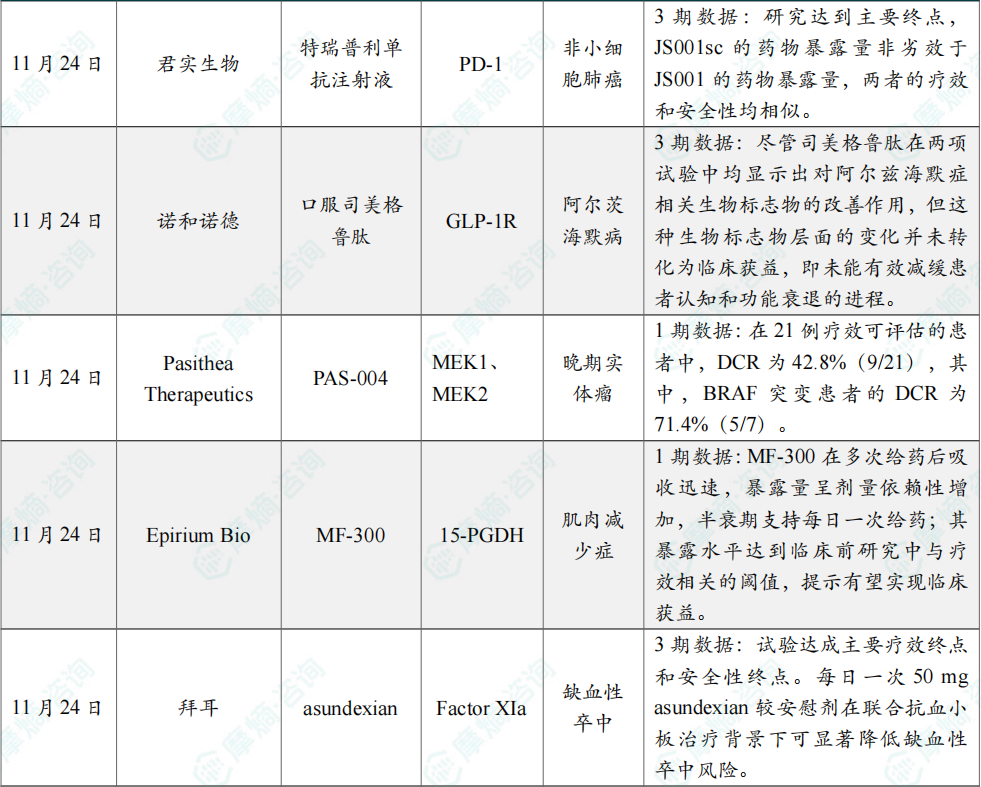
11月24日,君实生物宣布,由公司自主研发的特瑞普利单抗注射液(皮下注射)(产品代号:JS001sc)对比特瑞普利单抗注射液(产品代号:JS001)联合化疗一线治疗复发或转移性非鳞状非小细胞肺癌(NSCLC)的多中心、开放、随机对照3期临床研究(JS001sc-002-III-NSCLC研究)达到主要研究终点。
JS001sc-002-III-NSCLC研究(NCT06505837)是一项多中心、开放、随机对照的3期临床研究。该研究旨在比较JS001sc和JS001联合化疗在复发或转移性非鳞NSCLC中的药物暴露量、有效性和安全性。结果表明,JS001sc的药物暴露量非劣效于JS001的药物暴露量,两者的疗效和安全性均相似。本研究的详细数据将在近期的国际学术大会上公布。君实生物计划与监管部门沟通后,递交JS001sc用于拓益所获批的全部适应症的上市许可申请。
(3)诺和诺德口服司美格鲁肽治疗早期阿尔兹海默症两项3期研究失败
11月24日,诺和诺德公布了口服司美格鲁肽针对早期症状性阿尔茨海默病的III期evoke 和evoke+临床试验的两年期主要分析结果。这两项试验均为随机、双盲设计,共招募了3808名成年人,旨在评估与安慰剂相比,在标准治疗基础上加用口服司美格鲁肽的疗效和安全性。
该评估主要基于临床痴呆评定量表-总和评分相对于基线的变化。尽管司美格鲁肽在两项试验中均显示出对阿尔兹海默症相关生物标志物的改善作用,但这种生物标志物层面的变化并未转化为临床获益,即未能有效减缓患者认知和功能衰退的进程。基于这一总体疗效结果,诺和诺德已决定终止原计划的52周扩展治疗期。
(4)Pasithea Therapeutics公司公布PAS-004治疗晚期实体瘤的1期临床积极数据
11月24日,Pasithea Therapeutics公司公布了其大环MEK抑制剂 PAS-004 用于治疗MAPK通路驱动的晚期实体肿瘤的积极1期临床试验数据。与目前FDA批准的MEK抑制剂不同,PAS-004 是大环化合物,环化可增强药物与靶受体的结合,被认为有望改善药代动力学和安全性。
此次公布的结果显示,在21例疗效可评估的患者中,DCR为42.8%(9/21),其中,BRAF突变患者的DCR为71.4%(5/7)。一例BRAF V600E突变黑色素瘤患者(15 mg剂量组)实现未确认的部分缓解(肿瘤缩小31.9%),已持续治疗超过11个月;另一例同类患者(30 mg剂量组)获得持续超过6个月的疾病稳定(肿瘤缩小1.6%)。PAS-004 的安全性和耐受性良好,所有治疗相关不良事件均为1–2级,无眼部或心脏毒性,且皮疹、恶心、腹泻和呕吐为轻度。
(5)Epirium Bio公司公布MF-300 1期临床积极结果
11月24日,Epirium Bio公司宣布,其潜在“first-in-class”的口服15-羟基前列腺素脱氢酶(15-PGDH)抑制剂 MF-300,在针对肌肉减少症的1期临床试验中取得积极结果。5-PGDH是一种能将前列腺素E2(PGE2)转化为非活性代谢物的酶。MF-300 旨在可逆地结合到15-PGDH的PGE2结合位点上,阻止该酶转化PGE2。临床前研究表明,MF-300 能增强老年小鼠及其他神经源性萎缩临床前模型的肌肉力量并改善肌肉质量。
该临床研究在82名健康成人中评估了其安全性、药代动力学(PK)和药效学(PD)。研究结果显示,MF-300在多次给药后吸收迅速,暴露量呈剂量依赖性增加,半衰期支持每日一次给药;其暴露水平达到临床前研究中与疗效相关的阈值,提示有望实现临床获益。安全性方面未出现预期外或剂量限制性毒性、严重不良事件或提前停药。PD分析证实药物有效作用于靶点:尿液中PGE2升高,同时其主要代谢物PGE-MUM显著降低。PGE-MUM下降的幅度,与之前在老年小鼠实验中看到的、能带来肌肉质量提升和肌力增强的PGE-MUM降低程度是匹配的。总体而言,该研究在安全性、PK和PD所有预设指标上均达成成功标准,为 MF-300 的后续临床开发奠定了坚实基础。
(6)拜耳公布其小分子药物asundexian 3期试验积极结果
11月24日,拜耳(Bayer)宣布,其在研小分子疗法 asundexian 于全球3期临床研究OCEANIC-STROKE中取得积极主要结果。该研究在接受抗血小板治疗、发生过非心源性缺血性卒中或高危短暂性脑缺血发作(TIA)的患者中开展,结果显示,试验达成主要疗效终点和安全性终点。每日一次50 mg asundexian较安慰剂在联合抗血小板治疗背景下可显著降低缺血性卒中风险。
值得注意的是,与安慰剂联合抗血小板治疗相比,asundexian 联合抗血小板治疗并未增加国际血栓和止血学会(ISTH)定义的主要出血风险。在取得这一里程碑结果后,拜耳计划与全球监管机构开展沟通,为后续上市许可申请的提交做准备。
Asundexian是一款口服FXIa抑制剂,具有用于非心源性缺血性卒中患者卒中预防的潜力。
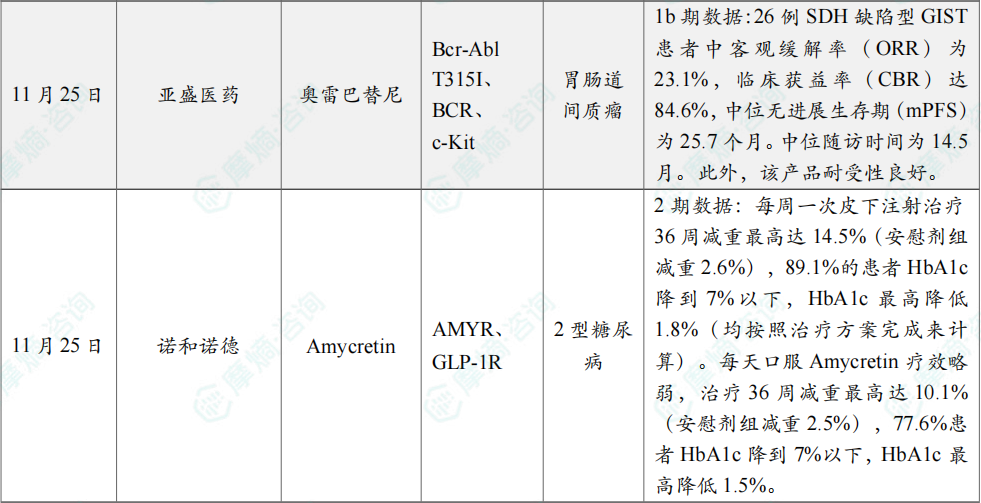
(7)亚盛医药公布奥雷巴替尼胃肠道间质瘤领域1b期研究进展
11月25日,亚盛医药宣布,奥雷巴替尼治疗胃肠道间质瘤(GIST)的转化医学和1b期临床研究结果在国际期刊《信号传导与靶向治疗》(Signal Transduction and Targeted Therapy)发表。研究结果表明奥雷巴替尼在琥珀酸脱氢酶(SDH)缺陷型GIST中具有良好的疗效与安全性。该研究还首次揭示奥雷巴替尼通过调控脂质代谢发挥抗肿瘤作用的全新机制。
此次发表在该期刊上的研究为一项1b期临床试验及转化研究,研究评估了奥雷巴替尼在66例不可切除/转移性GIST/其他实体瘤患者中的安全性和抗肿瘤活性,其中包括26例TKI治疗失败的SDH缺陷型GIST患者。研究结果显示,26例SDH缺陷型GIST患者中客观缓解率(ORR)为23.1%,临床获益率(CBR)达84.6%,中位无进展生存期(mPFS)为25.7个月。中位随访时间为14.5月。此外,该产品耐受性良好。
(8)诺和诺德公布Amycretin降糖2期研究数据
11月25日,诺和诺德发布了Amycretin治疗2型糖尿病的II期临床试验的积极结果。这是Amycretin在2型糖尿病患者中开展的首次评估,进一步展示了诺和诺德致力于推动2型糖尿病治疗创新的承诺。
结果显示,每周一次皮下注射治疗36周减重最高达14.5%(安慰剂组减重2.6%),89.1%的患者HbA1c降到7%以下,HbA1c最高降低1.8%(均按照治疗方案完成来计算)。每天口服Amycretin疗效略弱,治疗36周减重最高达10.1%(安慰剂组减重2.5%),77.6%患者HbA1c降到7%以下,HbA1c最高降低1.5%。
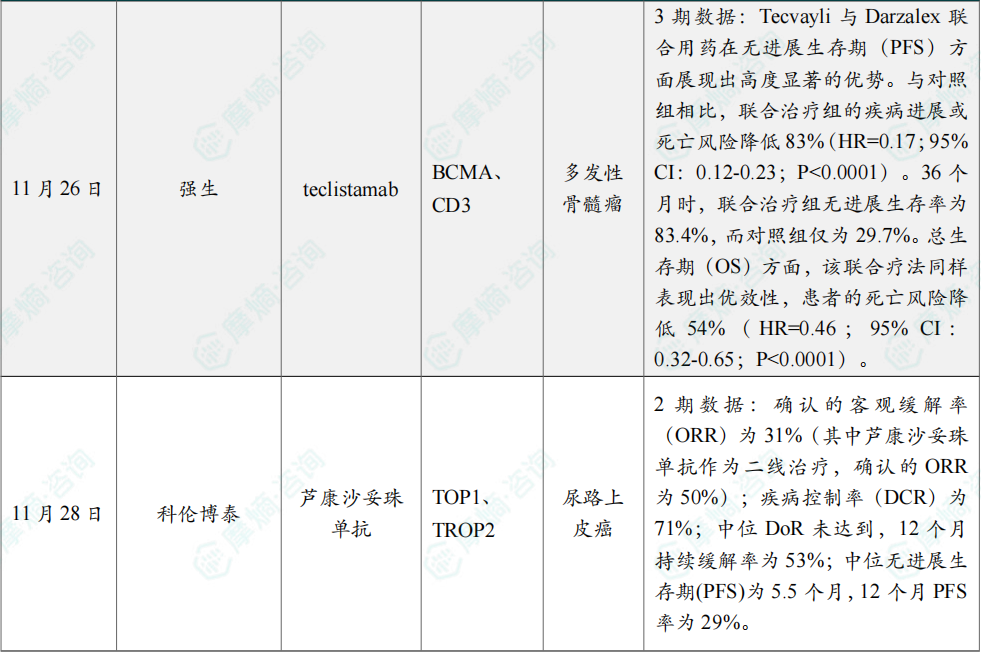
(9)强生双抗组合疗法3期试验亮眼结果公布
11月26日,强生(Johnson & Johnson)在2025年美国血液学会(ASH)会议摘要中公布,其B细胞成熟抗原(BCMA)与CD3靶向双特异性抗体 Tecvayli(teclistamab)与抗CD38抗体 Darzalex(daratumumab)联合疗法,在一项针对复发或难治性多发性骨髓瘤(RRMM)的3期临床研究中显著降低疾病进展或死亡风险。该3期MajesTEC-3研究共入组587名接受过1至3线治疗但疾病仍进展的RRMM患者,旨在比较 Tecvayli 联合 Darzalex 与当前标准三药组合方案(DPd或DVd)的疗效。
分析显示,Tecvayli 与 Darzalex 联合用药在无进展生存期(PFS)方面展现出高度显著的优势。与对照组相比,联合治疗组的疾病进展或死亡风险降低83%(HR=0.17;95% CI:0.12-0.23;P<0.0001)。36个月时,联合治疗组无进展生存率为83.4%,而对照组仅为29.7%。总生存期(OS)方面,该联合疗法同样表现出优效性,患者的死亡风险降低54%(HR=0.46;95% CI:0.32-0.65;P<0.0001)。在36个月时,Tecvayli+Darzalex组的总生存率达到83.3%,显著高于对照组的65.0%。
(10)科伦博泰ADC疗法2期临床结果发表于《肿瘤学年鉴》
11月28日,科伦博泰宣布其自主研发的TROP2 ADC 芦康沙妥珠单抗(sac-TMT,佳泰莱)单药治疗晚期或转移性尿路上皮癌(UC)患者的临床研究数据荣登国际知名学术期刊Annals of Oncology (《肿瘤学年鉴》,影响因子IF=65.4)。新闻稿表示,这项研究首次证实了芦康沙妥珠单抗在治疗晚期尿路上皮癌患者中可取得显著临床获益的潜力。此次期刊发表是基于一项评估芦康沙妥珠单抗(sac-TMT)单药治疗经化疗和免疫检查点抑制剂治疗进展的晚期或转移性尿路上皮癌疗效及安全性的2期临床研究(MK-2870-001/KL264-01)队列9的结果。
截至2025年2月17日,共有49名受试者接受芦康沙妥珠单抗(sac-TMT)治疗;其中76%的患者既往接受过≥2线治疗,中位随访时间为18.8个月。研究数据显示:确认的客观缓解率(ORR)为31%(其中芦康沙妥珠单抗作为二线治疗,确认的ORR为50%);疾病控制率(DCR)为71%;中位DoR未达到,12个月持续缓解率为53%;中位无进展生存期(PFS)为5.5个月,12个月PFS率为29%;芦康沙妥珠单抗(sac-TMT)安全性可控,最常见3级或4级治疗相关不良事件(≥5%)为血液学毒性和口腔粘膜炎,未出现发热性中性粒细胞减少事件或5级治疗相关不良事件。
同期事件:
1. 2025年第48周11.24-11.30国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第48周11.24-11.30国内仿制药/生物类似物申报/审批数据分析
3. 2025年第48周11.24-11.30国内医药大健康行业政策法规汇总
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.11.24-2025.11.30) },如需查看或下载完整版报告,可点击!
扩展阅读:
1. 2024年第48周11.25-12.01全球创新药研发概览
2. 2024年第47周11.18-11.24全球创新药研发概览
3. 2024年第39-40周09.23-10.06全球创新药研发概览
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!
























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论