1.1.1 总体概况
根据摩熵医药数据库统计,2025.11.24-2025.11.30期间共有86个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办(按受理号统计,不含补充申请)。其中国产药品受理号61个,进口药品受理号25个。
本周共计63款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药38款,生物药24款,中药1款。其中值得注意的有:
(1)JMT-206注射液
11月25日,CDE官网公示:上海津曼特的JMT-206注射液获得临床试验默示许可,拟用于肥胖或超重合并至少一种体重相关合并症人群的体重管理。
公开资料显示,JMT206可同时特异性结合激活素受体IIA型(ActRIIA)与IIB型(ActRIIB),阻断激活素A(ActivinA)、肌抑素(GDF8)以及生长分化因子11(GDF11)与激活素受体II型(ActRII)的结合,从而抑制下游信号通路的激活,减少肌肉流失,并促进骨胳肌维持与增长,以达到增肌减脂的效果。
(2)GenSci-142胶囊
11月26日,CDE官网公示:金赛药业的 GenSci-142胶囊 获得临床试验默示许可,拟用于细菌性阴道病。
公开资料显示,GenSci142胶囊 通过生物信息学筛选序列,通过AI设计优化分子结构,可直接破坏细菌细胞壁,选择性快速杀细菌性阴道炎的主要病原体,充分保留保护性乳杆菌,同时,穿透并瓦解生物膜,使致病菌无藏身死角,减少复发。
(3)TQF-3250胶囊
11月28日,CDE官网公示:正大天晴的 TQF-3250胶囊 获得临床试验默示许可,拟用于2型糖尿病。公开资料显示,是一款口服小分子偏向型GLP-1受体激动剂。
与传统小分子GLP-1RA相比,TQF3250通过选择性激活cAMP偏向的GLP-1R信号通路,高效促进胰岛素分泌,同时减少β-arrestin募集以及受体内吞,从而延长药效持续时间。
本周2款新药获批上市。国家药监局发布通知公告:批准Pfizer Inc.申报的马塔西单抗注射液(商品名:友瑞宁)上市,适用于患有以下疾病且体重 ≥ 35 kg的12岁及以上儿童和成人患者的常规预防治疗,以防止出血或降低出血发作的频率:不存在凝血因子VIII抑制物的重型A型血友病(先天性凝血因子VIII缺乏,FVIII<1%)或不存在凝血因子IX抑制物的重型B型血友病(先天性凝血因子IX缺乏,FIX<1%)。公开资料显示,马塔西单抗是一款非因子创新疗法,它并不直接替代缺失的因子,而是通过抑制体内一种天然抗凝血蛋白——组织因子途径抑制物(TFPI),促进凝血酶生成,从而恢复凝血与抗凝系统的平衡。这种凝血再平衡机制能够降低包括经治疗出血、关节出血、自发性出血、靶关节出血及总出血等在内的多种类型出血的风险。
国家药品监督管理局批准信达生物医药科技(杭州)有限公司申报的匹康奇拜单抗注射液(商品名:信美悦)上市,适用于适合系统性治疗的中重度斑块状银屑病成人患者。公开资料显示,匹康奇拜单抗(IBI112)为重组抗白介素23p19亚基(IL-23p19)抗体注射液,是由信达生物自主研发,具有自主知识产权的一种单克隆抗体,特异性结合IL-23p19亚基。通过阻止IL-23与细胞表面受体结合,阻断IL-23受体介导信号通路发挥抗炎作用。
1.1.2 本周获批临床创新药/改良型新药信息速览(不含补充申请)
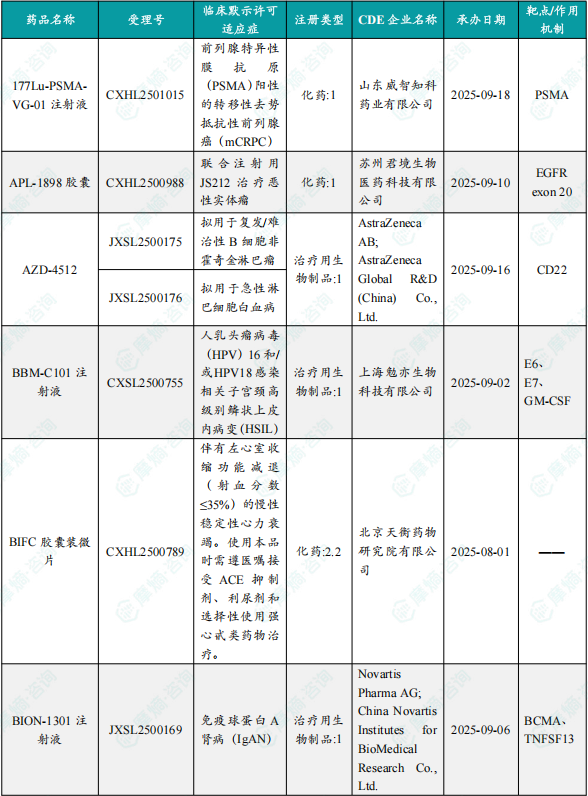
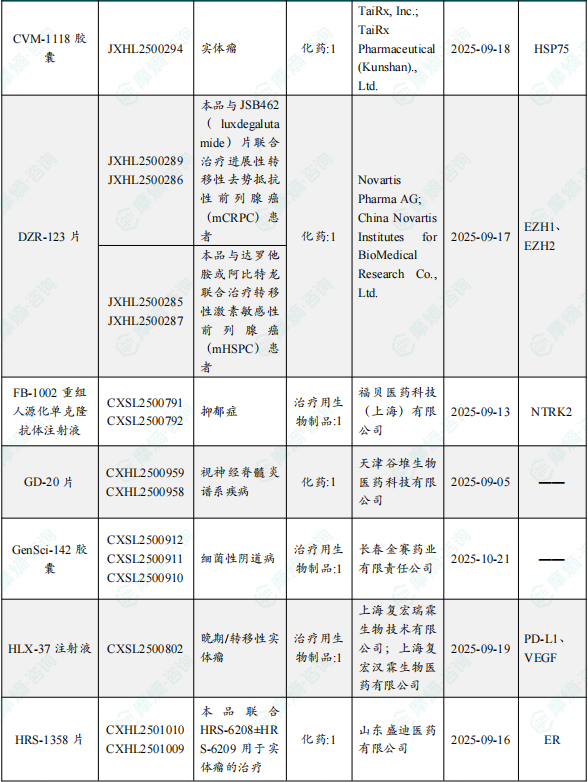
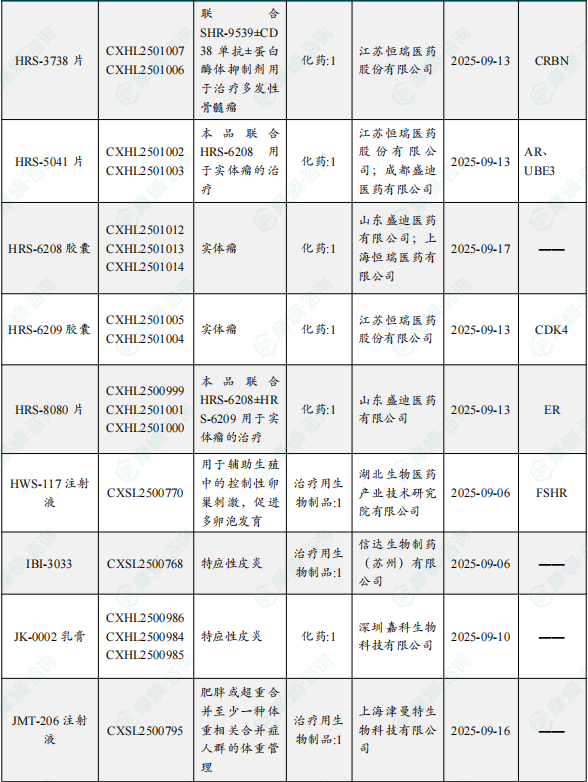
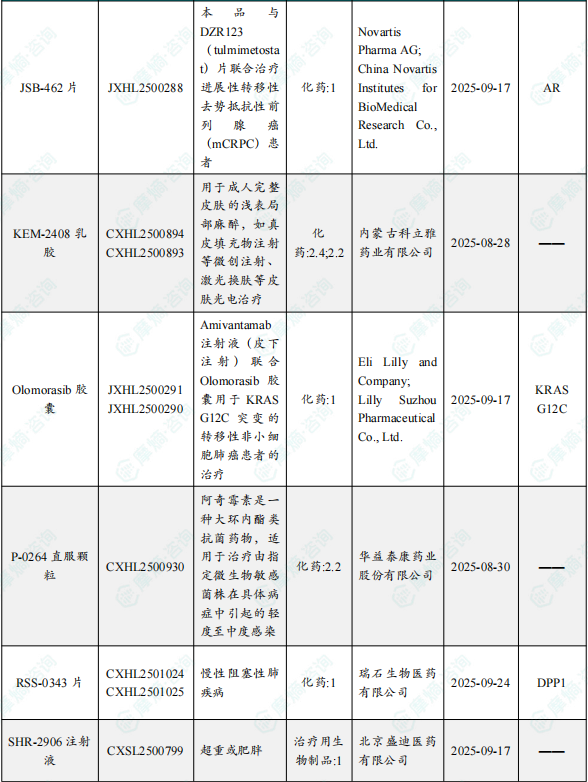
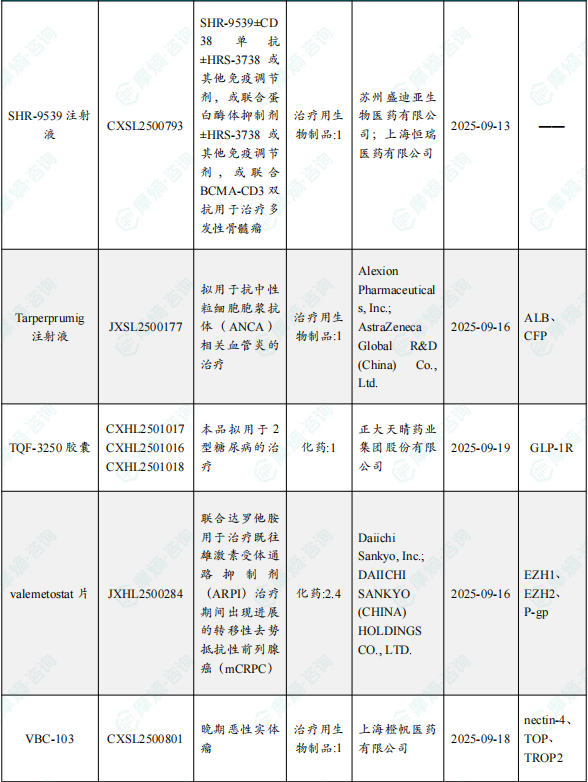
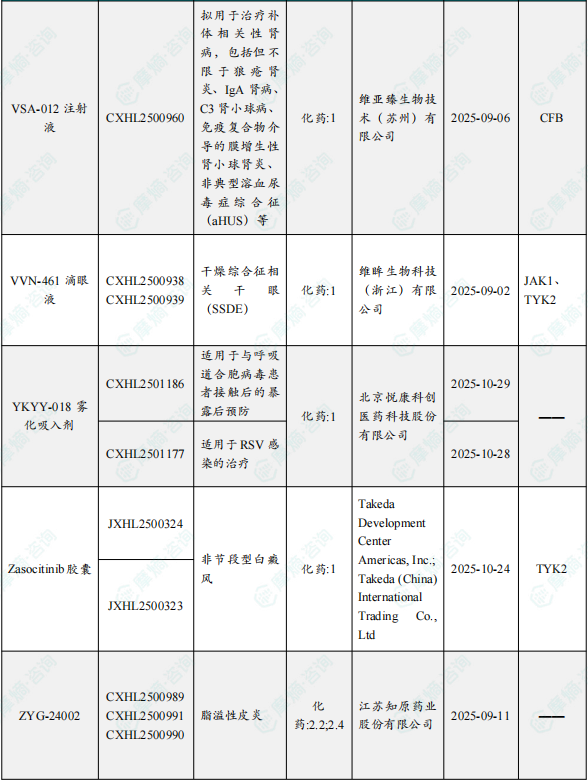
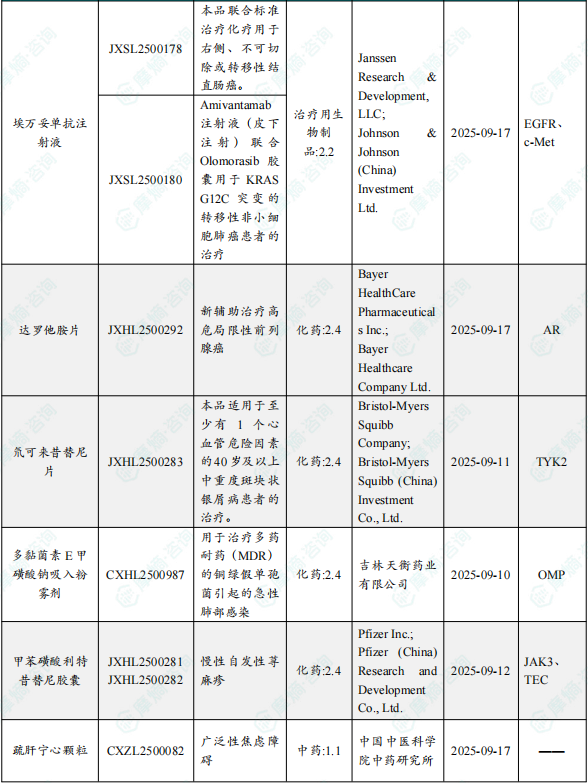
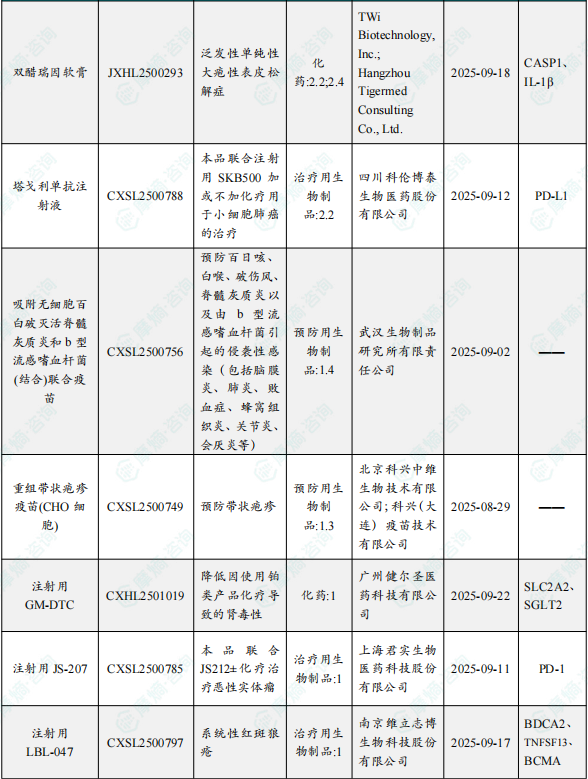
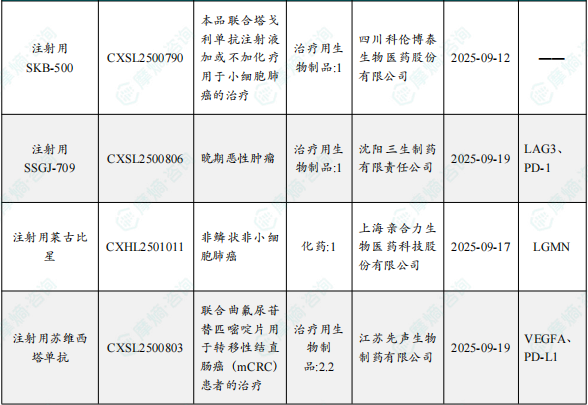
备注:(1)此处未包括补充申请之情形;(2)此处所列创新药/改良型新药,主要是指CDE受理批准的1类、2类、5.1类以及生物制品3.1类和3.2类。(3)更多获批临床信息及研发进展详情及相关靶点全局分析等,可通过摩熵中国药品审评数据库获取并下载EXCEL表格。
1.1.3 本周获批上市创新药信息速览
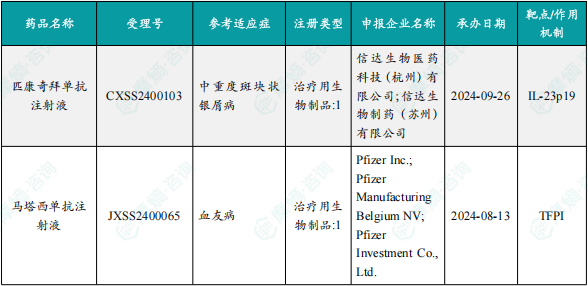
备注:(1)此处所列新药,主要是指国家药品监督管理局(NMPA)首次批准在中国上市的药品,包括新分子实体(以及包含有新分子实体的复方)、生物药、中药和疫苗。其中,新分子实体主要是化药注册分类下的1类(境内外均未上市的创新药)、5.1类(境外上市的原研药申请在国内上市);生物药主要为NMPA首次批准的国产及进口生物药;不包括生物类似物、新适应症、新剂型。(2)更多信息如获批临床品种相关靶点、研发企业、全球上市及研发进展及相关靶点全局分析等,可通过摩熵医药数据库获取并下载EXCEL表格。
同期事件:
1. 2025年第48周11.24-11.30国内仿制药/生物类似物申报/审批数据分析
2. 2025年第48周11.24-11.30国内医药大健康行业政策法规汇总
3. 2025年第48周11.24-11.30全球创新药研发概览
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.11.24-2025.11.30) },如需查看或下载完整版报告,可点击!
扩展阅读:
1. 2024年第48周11.25-12.01国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2024年第47周11.18-11.24国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
3. 2024年第44周10.28-11.03国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论