1.1.1 总体概况
根据摩熵数据统计,2024.11.18-2024.11.24期间共有67个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办(按受理号统计,不含补充申请)。其中,国产药品受理号53个,进口药品受理号14个。
本周共计35款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药19款,生物药15款,中药1款。其中值得注意的有:
(1)BGB-58067片
11月19日,CDE官网公示:百济神州的BGB-58067片获得临床试验默示许可,用于治疗实体瘤。公开资料显示,BGB-58067片是一款第二代MTA协同PRMT5抑制剂,可选择性杀伤MTAP缺失肿瘤细胞,同时避免影响正常血液细胞,在MTAP缺失细胞中极具活性和选择性,具有良好的血脑屏障穿透力和颅内药效,拥有理想的半衰期,可以实现每日给药。
(2)XZP-6924-TS1片
11月19日,CDE官网公示:轩竹生物的XZP-6924-TS1片获得临床试验默示许可,用于治疗晚期实体瘤患者。公开资料显示,XZP-6924-TS1片是一种有效的高选择性USP1抑制剂,具有提高疗效和克服PARP抑制剂耐药性的潜力。该产品的临床前研究结果还入选了2024年美国癌症研究协会(AACR)年会Late-Breaking Research(突破性研究)。
(3)PJ-016注射液
11月18日,CDE官网公示:派金生物的PJ-016注射液获得临床试验默示许可,用于治疗晚期实体瘤。公开资料显示,PJ-016注射液是一种长效聚乙二醇化精氨酸耗竭生物新药,基于天然来源精氨酸脱亚胺酶,经派金生物自主创新持续迭代的MAS-PEG(多位点饱和定向改造PEG)技术平台研发而成的共价二聚体大分子酶,可以通过耗竭外周血中的精氨酸抑制肿瘤细胞的生长,并诱导癌细胞的凋亡和焦亡,将“冷肿瘤”转变为“热肿瘤”;调动和促进免疫细胞浸润于瘤体内杀伤癌细胞,同时协同免疫调节剂抗体药物的抑瘤作用。
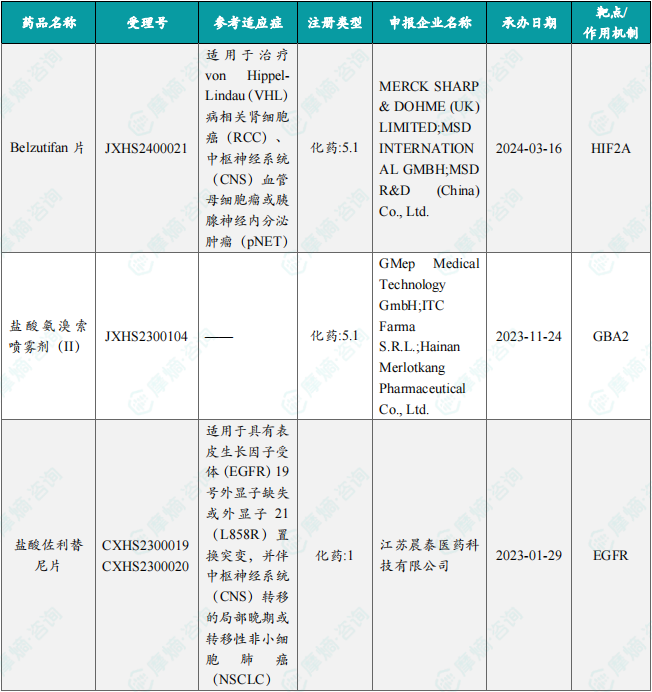
本周共3款新药获批上市,即Belzutifan片、盐酸佐利替尼片和盐酸氨溴索喷雾剂(II)。
11月21日,国家药监局发布药品批准证明文件送达信息:默沙东的Belzutifan片获批上市,适用于治疗von Hippel-Lindau(VHL)病相关肾细胞癌(RCC)、中枢神经系统(CNS)血管母细胞瘤或胰腺神经内分泌肿瘤(pNET)。公开资料显示,Belzutifan片是一款小分子缺氧诱导因子2α(HIF-2α)抑制剂,可以减少与细胞增殖、血管生成和肿瘤生长相关的HIF-2α靶基因的转录和表达,是全球首款也是目前唯一一款获批上市的HIF-2α抑制剂。
11月21日,国家药监局发布药品批准证明文件送达信息:晨泰医药的盐酸佐利替尼片获批上市,适用于具有表皮生长因子受体(EGFR)19号外显子缺失或外显子21(L858R)置换突变,并伴中枢神经系统(CNS)转移的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗,为患者提供新的治疗选择。
11月21日,国家药监局发布药品批准证明文件送达信息:GMep Medical Technology GmbH、ITC Farma S.R.L.和Hainan Merlotkang Pharmaceutical Co., Ltd.联合研发的的盐酸氨溴索喷雾剂(II)获批上市。
1.1.2 本周获批临床创新药/改良型新药信息速览(不含补充申请)
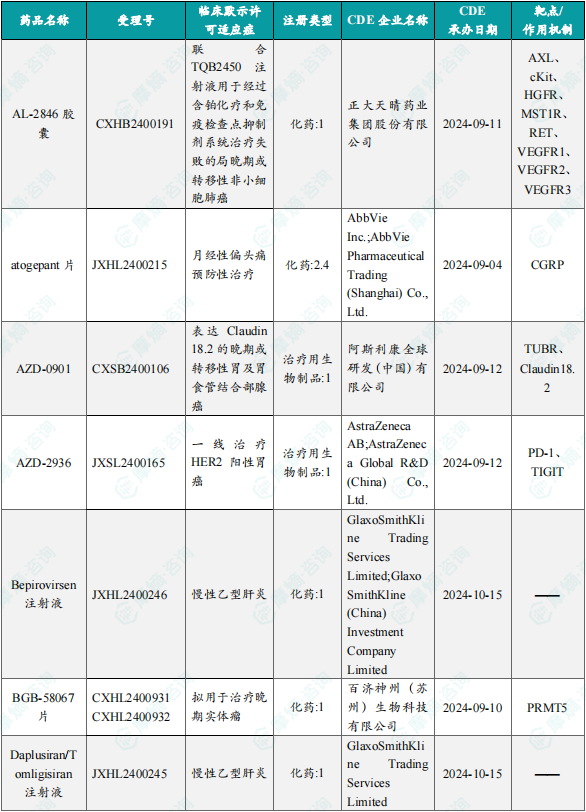
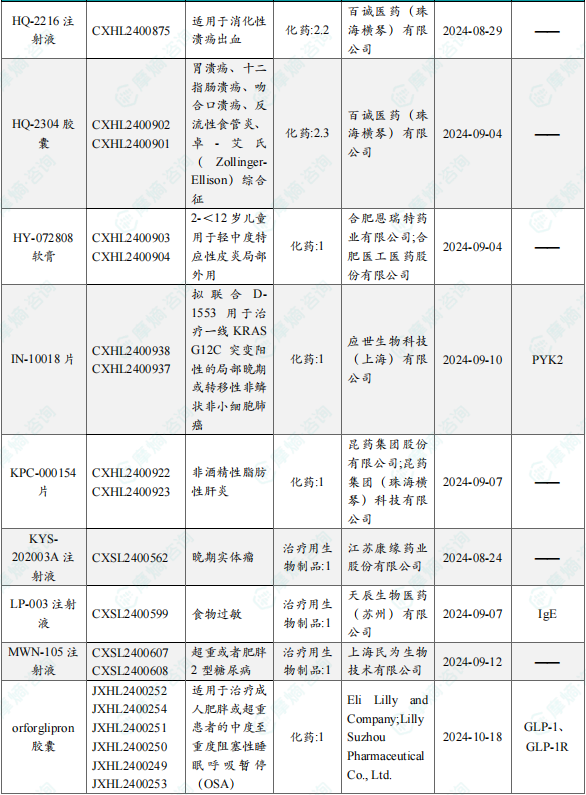
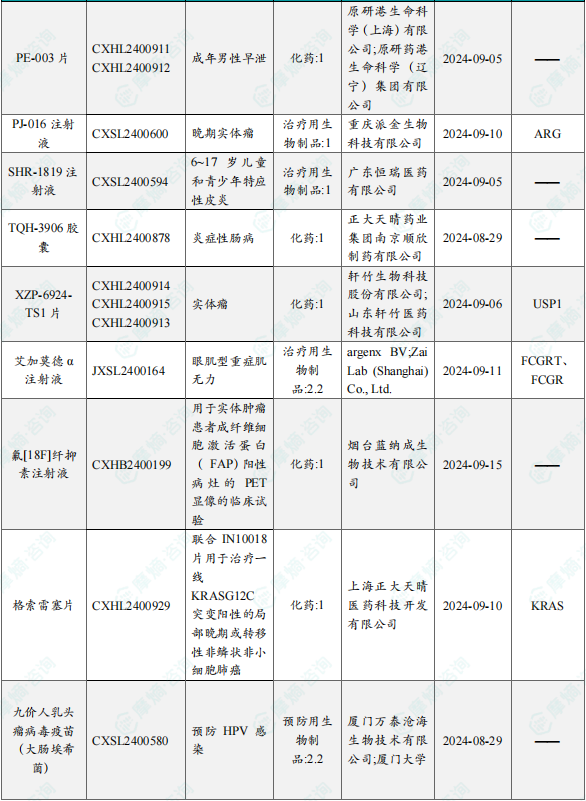
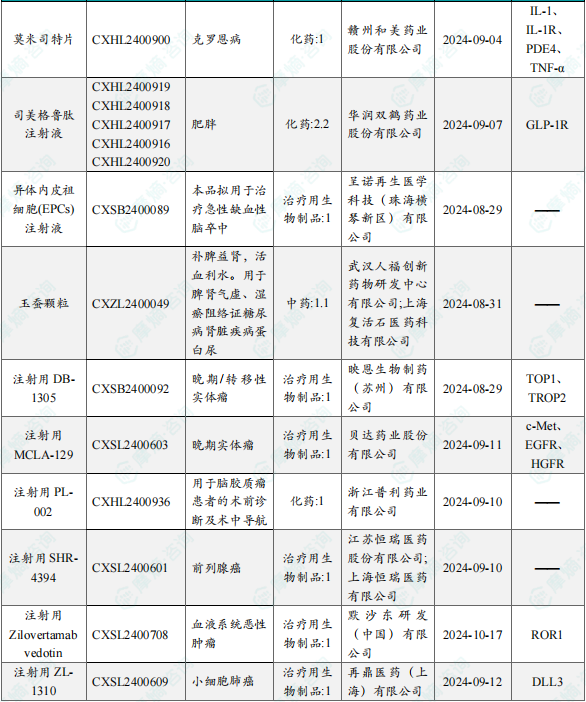
备注:(1)此处未包括补充申请之情形;(2)此处所列创新药/改良型新药,主要是指CDE受理批准的1类、2类、5.1类以及生物制品3.1类和3.2类。(3)更多获批临床信息及研发进展详情及相关靶点全局分析等,可通过摩熵中国药品审评数据库获取并下载EXCEL表格。
1.1.3 本周获批上市创新药信息速览
备注:(1)此处所列新药,主要是指国家药品监督管理局(NMPA)首次批准在中国上市的药品,包括新分子实体(以及包含有新分子实体的复方)、生物药、中药和疫苗。其中,新分子实体主要是化药注册分类下的1类(境内外均未上市的创新药)、5.1类(境外上市的原研药申请在国内上市);生物药主要为NMPA首次批准的国产及进口生物药;不包括生物类似物、新适应症、新剂型。(2)更多信息如获批临床品种相关靶点、研发企业、全球上市及研发进展及相关靶点全局分析等,可通过摩熵数据库获取并下载EXCEL表格。
同期事件:
1. 2024年第47周11.18-11.24国内仿制药/生物类似物申报/审批数据分析
2. 2024年第47周11.18-11.24国内医药大健康行业政策法规汇总
3. 2024年第47周11.18-11.24全球医药大健康行业投融资数据
4. 2024年第47周11.18-11.24全球创新药研发概览
以上内容均来自{摩熵咨询医药行业观察周报(2024.11.18-2024.11.24)},如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论