1.2.1 总体概况
根据摩熵医药数据库统计,2025.12.22-2025.12.28期间共有132项仿制药申报上市/申报临床获CDE承办,其中新注册分类上市申请受理号120项(包括化药3类,4类),新注册分类临床申请受理号7项(包括化药3类,4类),一致性评价申请5项。
本周6个品种通过一致性评价(按受理号计13项),本周101个品种视同通过一致性评价(按受理号计164项)。
本周4项生物类似物注册申报动态,包括:杭州博之锐生物制药有限公司的注射用曲妥珠单抗;宜昌东阳光长江药业股份有限公司的甘精胰岛素注射液;成都景泽生物制药有限公司的注射用重组人促卵泡激素以及齐鲁制药有限公司的QL-2109注射液。
1.2.2 本周通过/视同通过一致性评价全局分析
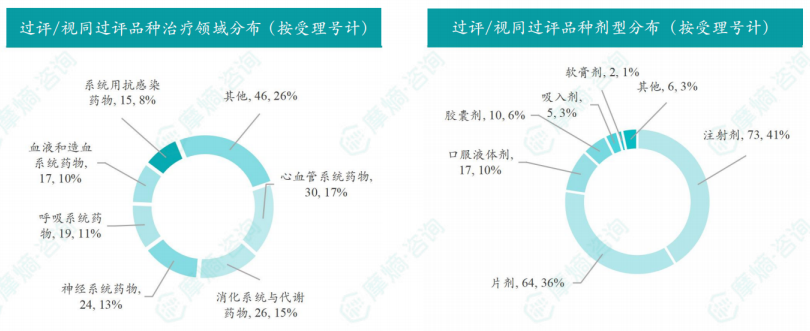
本周过评/视同过评品种主要为心血管系统药物;过评/视同过评产品剂型主要为注射剂;
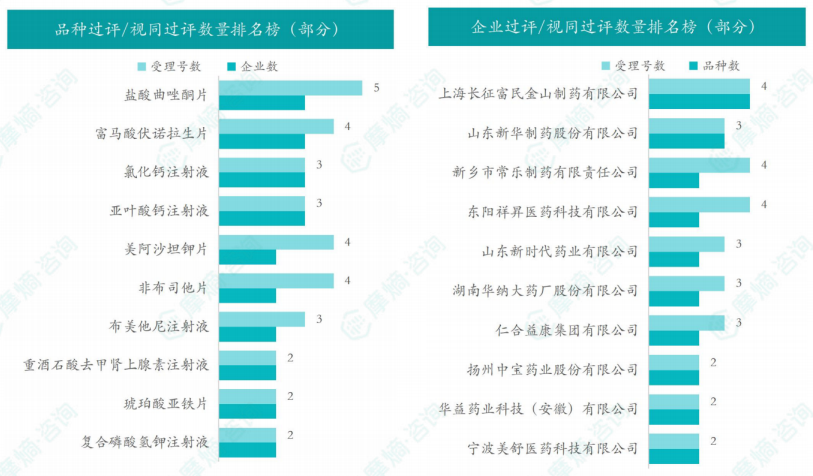
本周盐酸曲唑酮片过评/视同过评受理号最多,为5个,氯化钙注射液、富马酸伏诺拉生片、盐酸曲唑酮片、亚叶酸钙注射液过评/视同过评企业最多,为3家;
本周上海长征富民金山制药有限公司过评/视同过评品种数最多,为4种,本周过评/视同过评企业包括扬子江药业集团江苏制药股份有限公司、四川汇宇制药股份有限公司和山东新时代药业有限公司等121家。
1.2.3 本周首次过评/视同过评、过评/视同过评达7家品种盘点
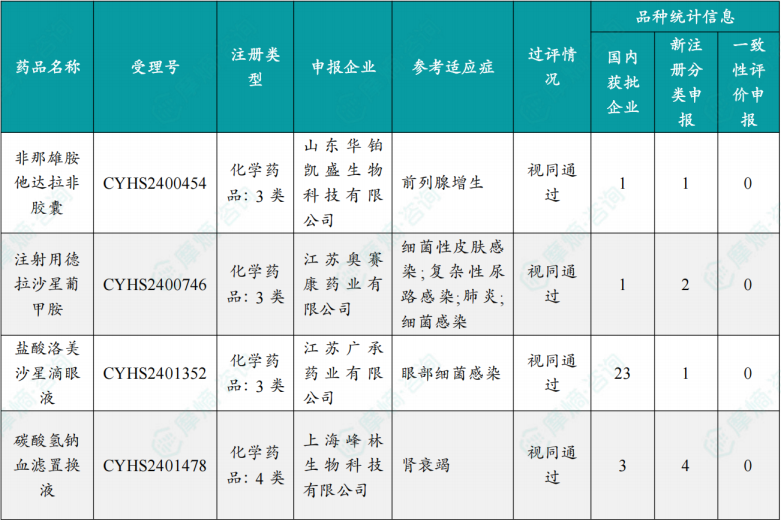
(1)本周首次过评/视同过评品种
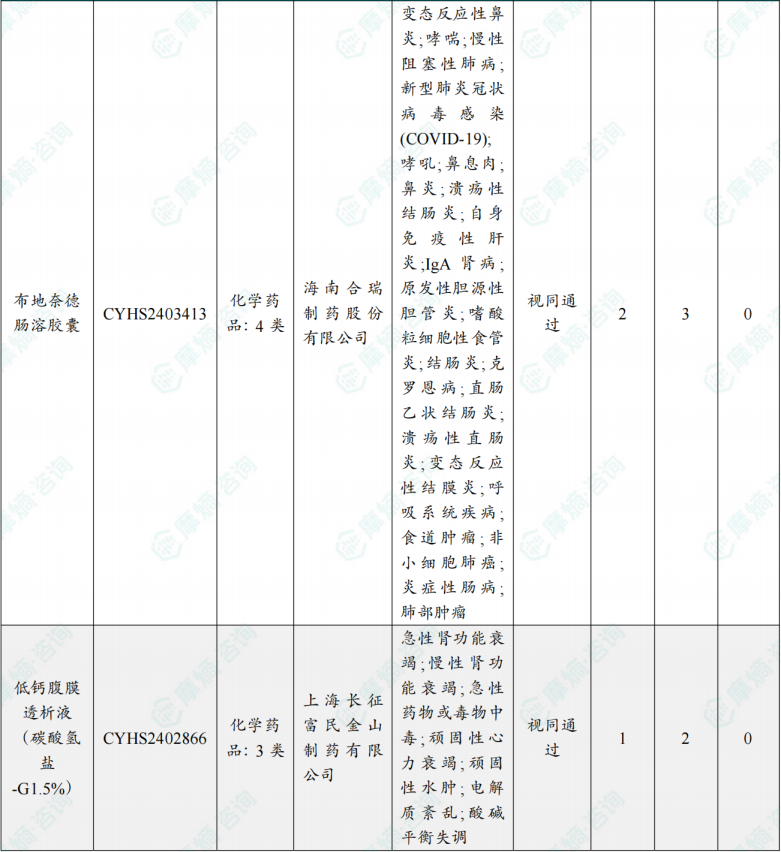
(2)本周过评/视同过评达7家企业品种
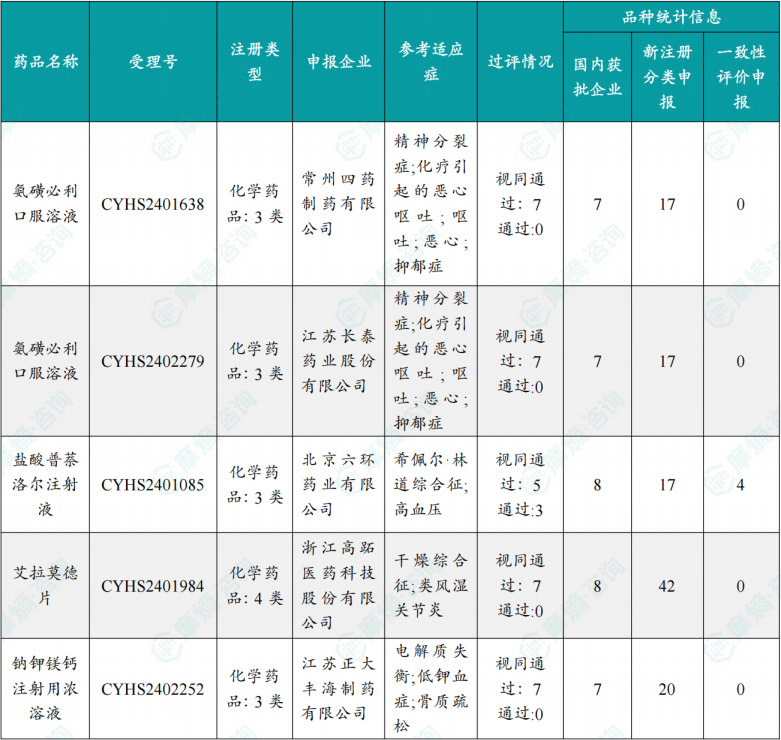
备注:本章节以摩熵医药数据库2025.12.22-2025.12.28更新数据为参考依据,可通过摩熵一致性评价数据库获取并下载本周过评/视同过评品种清单。
同期事件:
1. 2025年第52周12.22-12.28国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第52周12.22-12.28国内医药大健康行业政策法规汇总
3. 2025年第52周12.22-12.28全球创新药研发概览
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.12.22-2025.12.28) },如需查看或下载完整版报告,可点击!
扩展阅读:
1. 2024年第43周10.21-10.27国内仿制药/生物类似物申报/审批数据分析
2. 2024年第39-40周09.23-10.06国内仿制药/生物类似物申报/审批数据分析
3. 2024年第35周08.26-09.01国内仿制药/生物类似物申报/审批数据分析
查数据,找摩熵!想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!
























































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论