
在医药研发的浩瀚星空中,有些药物的诞生是灵光一闪,而有些则是几代科学家“死磕”几十年的结果。匹托利生(Pitolisant)属于后者。这不仅仅是一个关于化学分子的故事,它是欧洲科学界通力合作的典范——从法国卡昂大学的化学合成,到德国柏林自由大学的结构优化,再到英国伦敦大学学院的理论突破,后得到了来自欧洲经济共同体(European Economic Community,EEC)BIOMED项目和Bioprojet-Paris的资助。
这段旅程始于一个曾被神经学界忽视的角落:组胺。长久以来,人们只知道组胺会让皮肤发痒、鼻子过敏,却很少有人相信,它竟然是掌控人类清醒与睡眠的关键开关。
一、被遗忘的“觉醒者”与H3受体的发现
1. 组胺的“平反”
在那时,神经学界的主流观点并不认为组胺是一种神经递质。然而,以Jean-Charles Schwartz教授为首的法国团队在巴黎国家健康与医学研究院坚持了近40年的研究,终于证实:大脑中确实存在“组胺能神经元” 。
人脑中的组胺能系统
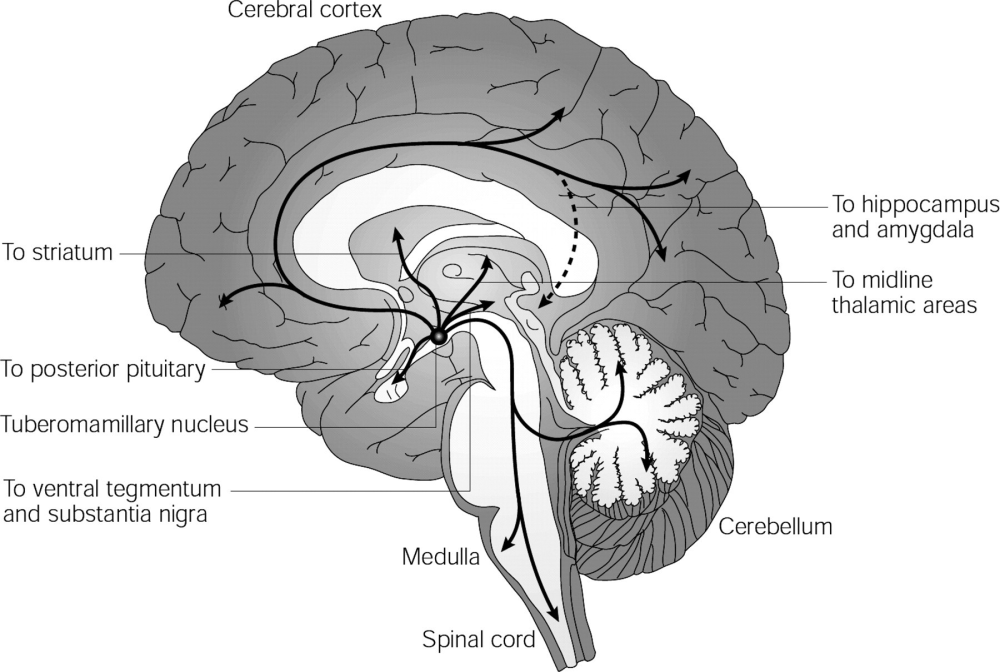
这不仅是解剖学上的发现,更是功能上的突破。科学家们发现,这些神经元构成的通路,是维持人体“觉醒”状态的核心动力系统 。这一发现解释了一个常见的药理现象:为什么我们吃感冒药(抗组胺药)会犯困?因为这些药物阻断了H1受体,导致大脑镇静。
2. H3受体:大脑的“刹车踏板”
既然阻断H1受体会让人昏睡,那么反过来,如何让人清醒?科学家们在20世纪80年代初发现了一个特殊的受体——H3受体。
与主要负责传递信号的H1、H2受体不同,H3受体位于中枢神经系统组胺能神经元的突触前,其功能主要是作为自受体调节组胺的释放。通俗地说,它是组胺释放的“刹车踏板”。当突触间隙的组胺太多时,H3受体被激活,就会命令神经元:“够了,停止释放组胺。”H3受体还参与调节以L-组氨酸为原料的组胺的合成。当组胺激活H3受体后,会导致组胺神经递质释放浓度的降低。因此,阻断H3受体可促进组胺能传递的增加并促进维持人体的觉醒状态。
研发的底层逻辑由此诞生:如果我们能设计一种药物,死死地挡住H3受体(拮抗剂),不让它踩刹车,那么大脑就会持续释放组胺,从而让人保持高度清醒 。
二、从硫丙咪胺的失败说起
1. 完美的活性,致命的毒性
1987年,科学界合成了第一个强效H3受体拮抗剂——硫丙咪胺(Thioperamide) 。在体外实验中,它的表现堪称完美。然而,在长期的动物毒理实验中,硫丙咪胺 显示出了严重的肝毒性。大鼠的肝脏出现了明显的损伤。
Thioperamide结构式
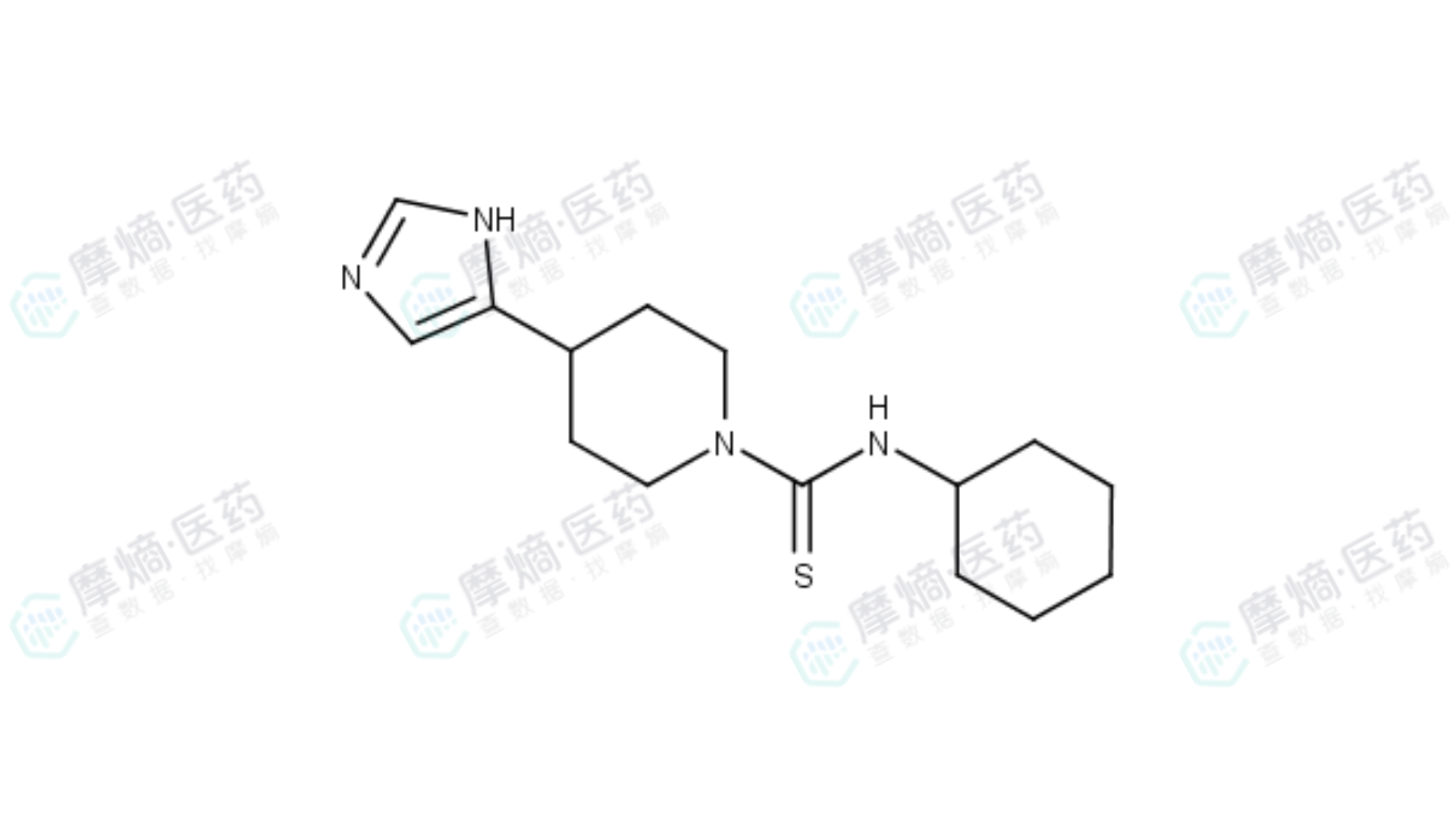
问题出在它的化学结构上。硫丙咪胺 包含一个咪唑环和一个硫脲基团。
- 硫脲基团:这是导致毒性的罪魁祸首。硫脲结构虽然能提供强大的分子间作用力,帮助药物紧紧抓住受体,但它在体内代谢时会产生反应性极强的中间体,攻击肝脏蛋白,导致细胞坏死。
- 咪唑环:咪唑环极性强,容易与体内的细胞色素P450酶(CYP450)结合,不仅影响药物代谢稳定性,还可能导致药物相互作用。更糟糕的是,强极性的咪唑环使得药物难以穿透血脑屏障,而治疗嗜睡症的药物必须进入大脑才能起效。
- 穿透性差:这两个基团都是强极性的,像吸水的海绵,导致药物很难穿过血脑屏障进入大脑。
2. 绝望中的寻找
为了解决这个问题,药物化学家们开始了长达十多年的“试错”之旅。他们试图用其他的环来替换咪唑环,或者修饰硫脲基团。
- 用苯氧基、氨基杂环替换脲类?有活性,但不够。
- 用其他杂环直接替换咪唑环?活性大幅下降,甚至完全失效。
数据是残酷的:只要拿掉那个惹麻烦的咪唑环(4(5)-咪唑结构),药物对H3受体的亲和力就会呈指数级下跌。
三、思维的跃迁——回归经典药理学
在陷入僵局时,伦敦大学学院的团队决定从理论源头寻找突破口。他们回到了20世纪60年代艾瑞斯(Ariëns)和西蒙尼斯(Simonis)提出的经典概念。
这个理论的核心思想极其迷人:它认为激动剂(如组胺)和拮抗剂(阻断药)在受体上的结合位点并不需要完全重合,但必须有一个“公共区域”。
- 激动剂结合在受体的“触发区”,像钥匙一样转动锁芯。
- 拮抗剂则可以结合在触发区旁边的“辅助结合区”。如果拮抗剂的体积足够大,或者结合得足够牢固,它就可以像一个盖子一样,遮挡住触发区,或者通过改变受体的整体形状,让天然的钥匙(组胺)无法插入。
基于这一理论,加内林提出了一种“逐步转化策略”:
① 起点:从天然组胺的结构出发。
② 延伸:在组胺分子的氨基端连接一条长长的碳链,并在末端加上一个巨大的疏水基团(如苯环)。这个苯环旨在探索受体表面可能存在的辅助疏水结合口袋。
③ 替换:一旦这个疏水基团找到了结合位点并提供了足够的结合能,原本用于识别受体的咪唑环可能就不再是必需的了。此时,可以尝试切除或替换咪唑环,从而消除其带来的药代动力学缺陷。
这一理论在实验室中经历了数年的反复试错。在伦敦,来自塞浦路斯的博士生安东尼娅·皮里皮斯(Antonia Piripitsi)首先尝试在苯环对位引入不同的取代基,并引入醚键(氧原子)来调节侧链的柔性。随后,法国博士生法宾·勒奎因(Fabien Leurquin)接过了接力棒。他系统地合成了120多个新化合物,测试了27种不同的胺类结构。法宾的研究发现,当用哌啶环(Piperidine)替代咪唑环,并在连接链中引入氧原子(醚键)时,化合物的活性和稳定性达到了最佳平衡。
与此同时,在柏林,舒纳克教授的团队也在进行类似的探索。他们发现,将早期的一个名为FUB 181的先导化合物中的咪唑环直接替换为哌啶环,得到了一种编号为FUB 649的分子 。
这个分子后来被命名为 匹托利生(Pitolisant)。
Pitolisant结构式
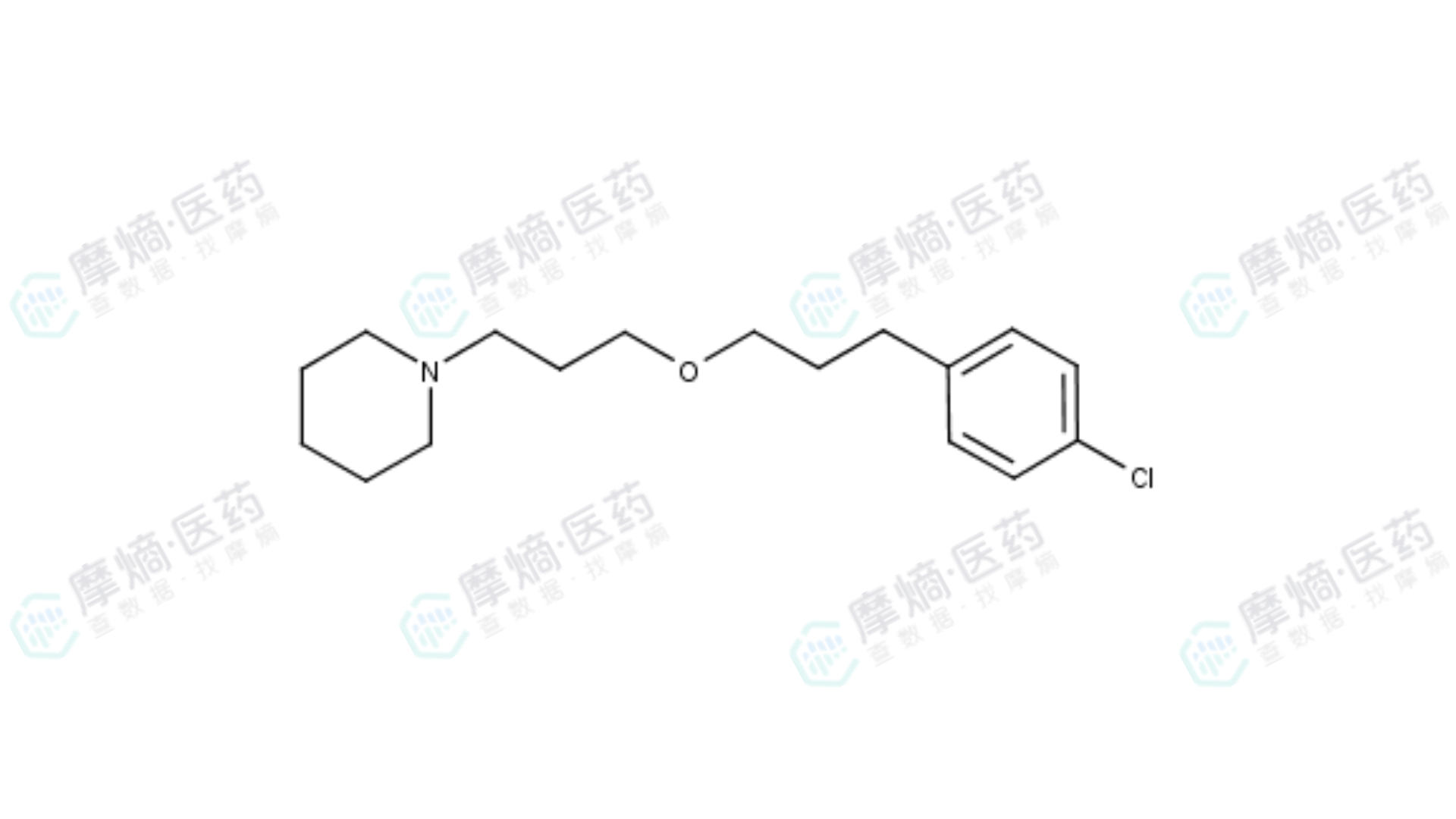
其化学名称为:1-{3-[3-(4-氯苯基)丙氧基]丙基}哌啶盐酸盐。
让我们用分子的眼光来审视这个杰作:
- 4-氯苯基:氯原子的引入增加了分子的脂溶性,使其能够像幽灵一样轻松穿透血脑屏障。同时,苯环与H3受体中的芳香族氨基酸残基(如苯丙氨酸 Phe198)形成强的π-π堆积作用,提供了主要的结合能。
- 丙氧基丙基链:这是一条柔性的连接臂,通过其中的氧原子与受体形成氢键,精准地将两端的功能基团拉开到最佳距离。
- 哌啶环:这是神来之笔。它替代了充满毒性风险的咪唑环。作为一个碱性中心,它在生理pH值下带正电,与H3受体深处的一个关键负电性氨基酸(谷氨酸 Glu206)形成牢固的离子键(盐桥),锁定了分子的位置。
通过这种精妙的“拼图游戏”,科学家们终于得到了一种既没有肝毒性,又能高效进入大脑,且对H3受体具有极高亲和力(Ki < 1 nmol/L)的完美分子。更令人惊喜的是,匹托利生对人类H3受体的亲和力甚至比对大鼠的还要高,这在药物研发中是非常罕见的幸运。
Pitolisant在组胺H3受体模型中的拓扑结构
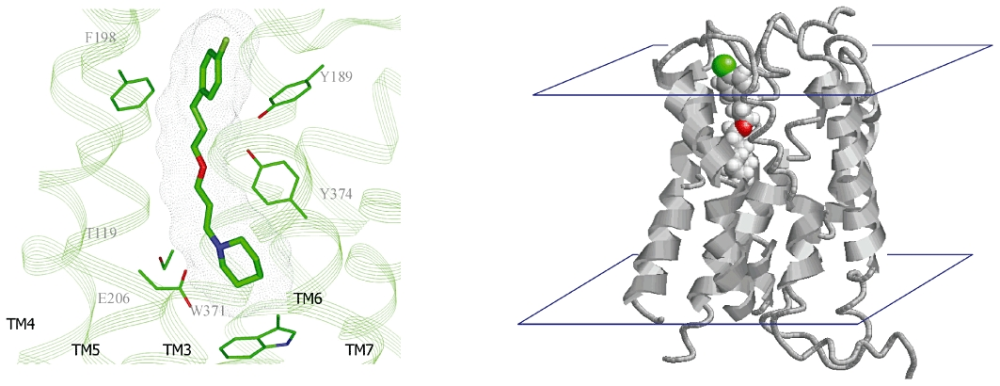
四、不仅是阻断——“反向激动剂”的威力
在 匹托利生 的研发过程中,施瓦兹教授团队还揭示了H3受体的一个惊人特性,这也解释了为什么匹托利生 的效果如此显著。
传统的药理学认为,受体就像一盏灯,要么开(激动剂作用),要么关(无配体)。拮抗剂的作用仅仅是防止别人去开灯。
然而,H3受体并不是一盏普通的灯,而是一盏具有“固有活性”的灯。这意味着,即使在没有组胺(手指)去按开关的情况下,H3受体也会偶尔“自发地”闪烁,持续产生微弱的生物电信号。对于H3受体这种抑制性受体来说,这种自发活性意味着它在持续不断地发出微弱的“刹车”信号,压制着大脑的觉醒系统。
如果我们仅仅使用普通的拮抗剂(中性拮抗剂),我们只能阻止组胺进一步踩刹车,却无法消除这股自发的刹车力。
匹托利生 不仅仅是一个拮抗剂,它是一个反向激动剂。
这就好比:
- 组胺(激动剂):用力踩下刹车,车停了(嗜睡)。
- 普通拮抗剂:在刹车踏板下塞了一块砖头,你踩不动刹车了。但刹车踏板本身因为弹簧老化,可能还压着一点刹车盘(固有活性)。
- 匹托利生(反向激动剂):不仅塞了砖头,还伸出一只手,用力把刹车踏板抬起来,彻底解除了所有的制动效果。
通过这种反向激动作用,匹托利生能将大脑内的组胺水平提升到前所未有的高度。它不仅解除了组胺对自身的抑制,还通过异源受体解除了对乙酰胆碱、多巴胺和去甲肾上腺素的抑制。这种全方位的神经递质释放,不仅促进了觉醒,还增强了注意力、认知功能和情绪调节能力。
五、对抗嗜睡症——从实验室到临床
1. 嗜睡症的真相
嗜睡症(发作性睡病)是一种残酷的疾病。患者并不是单纯的“爱睡觉”,他们的大脑丧失了调节睡眠-觉醒周期的能力。
- 白天过度嗜睡:随时随地可能昏睡过去。
- 猝倒:一激动(大笑或生气),肌肉突然失去张力,整个人瘫软倒地。
- 幻觉与睡眠瘫痪:也就是俗称的“鬼压床”。
研究发现,这背后的原因是食欲素(Orexin)的缺失。食欲素是维持清醒的总司令,当它“阵亡”后,就需要副官——组胺系统——来顶上。这正是匹托利生的用武之地:通过激活组胺神经元,补偿食欲素缺失带来的觉醒障碍。
2. 临床的胜利
为了验证疗效,Bioprojet启动了代号为“Harmony”的系列三期临床试验。这不仅是科学的验证,更是对无数患者承诺的兑现。
Harmony I 研究:正面交锋
这是一场双盲、随机、安慰剂对照的“巅峰对决”。匹托利生直接挑战了当时治疗嗜睡症的金标准药物——莫达非尼(Modafinil)。
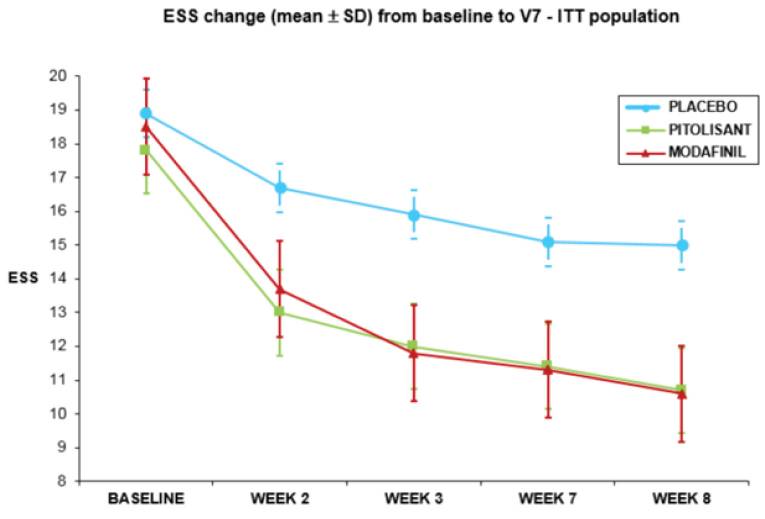
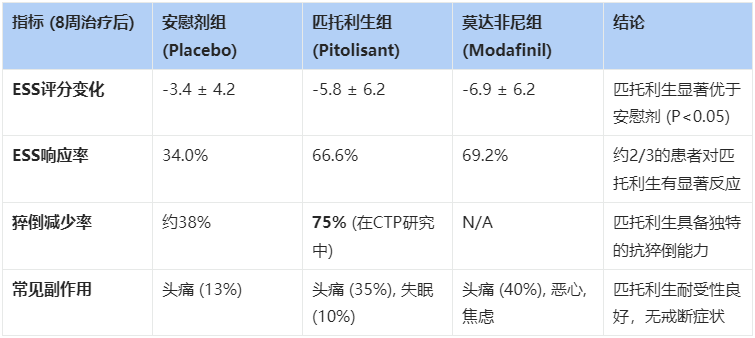
试验结果显示,在治疗8周后,匹托利生 组患者的爱普沃斯嗜睡量表(ESS)评分显著下降(分数越低代表越清醒)。
- 安慰剂组ESS评分仅下降了约3分(改善甚微)。
- 匹托利生 组ESS评分下降了约6分,使得许多患者的评分降到了10分以下(接近正常人水平)。 虽然在统计学上 匹托利生 被定义为“非劣效于”莫达非尼(即效果相当),但它的安全性优势显现无疑:没有莫达非尼常见的诱发焦虑和心血管风险,且没有成瘾性 。
HARMONY 1 试验中 ESS 的变化
Harmony CTP 研究:攻克猝倒
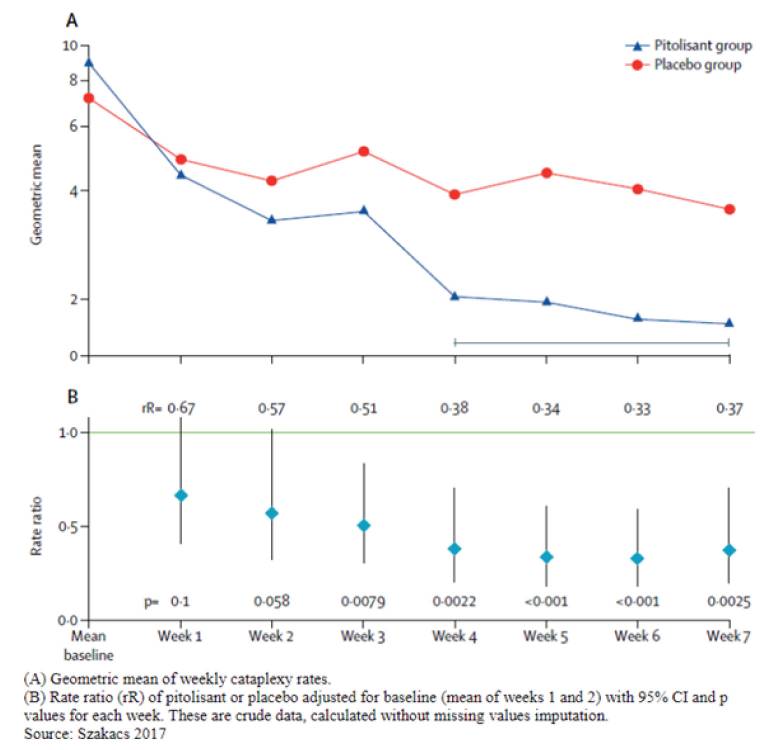
这是 匹托利生 的高光时刻。猝倒是嗜睡症最令人恐惧的症状,患者在情绪激动时会突然瘫痪。在Harmony CTP试验中,匹托利生展现了惊人的效果:
- 匹托利生 组患者的每周猝倒发作频率降低了75%。
- 安慰剂组仅降低了38%。 这一结果意味着,许多原本不敢大笑、不敢惊喜的患者,终于可以重新拥抱丰富多彩的情感生活,而不必担心在公共场合突然瘫倒 。
每周猝倒发生率——HARMONY CTP 试验
Harmony I 临床试验核心数据对比
由于嗜睡症属于罕见病,根据摩熵医药数据库显示,匹托利生早在2007年就获得了“孤儿药”资格,这为其快速审批铺平了道路。

最终,它获得了欧洲药品管理局(EMA)的批准,以商品名 Wakix 上市,成为全球首个获批用于治疗嗜睡症的H3受体反向激动剂。
结语
从最初的含硫脲剧毒化合物,到如今造福万千嗜睡症患者的良药,匹托利生的研发历程不仅是药物化学的教科书级案例,更是人类理性光辉的闪耀。它告诉我们,在看似无解的科学迷宫中,只要理论根基扎实,即使绕了一个大圈,最终也能找到通往光明的出口。
对于那些受困于无法自控的睡意、生活支离破碎的患者来说,匹托利生 不仅仅是一个化学分子式,它是清晨醒来时,那份久违的、清澈的、属于自己的——清醒。
扩展阅读:
1. 可逆性MAO-B抑制剂沙芬酰胺:从抗癫痫到抗帕金森,双重机制解锁多巴胺与谷氨酸调控密码
2. 曲氟尿苷-替匹嘧啶(TAS-102)研发复盘:从实验室到临床,解锁抗肿瘤新机制与多癌种潜力
3. 博纳吐单抗的设计与开发:BiTE技术先锋,作用机制揭秘、临床应用挑战及与CAR-T的较量
查数据,找摩熵!想要解锁更多药品信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!





















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论