
博纳吐单抗(Blinatumomab,商品名Blincyto)是现代肿瘤药物研发中最具传奇色彩的成果之一 。作为一种双特异性T细胞衔接器(Bispecific T-cell Engager, BiTE®),它的出现标志着急性淋巴细胞白血病(ALL)治疗进入了免疫疗法的新时代 。
与传统单克隆抗体(如利妥昔单抗)依赖自然杀伤细胞和巨噬细胞的ADCC机制不同,博纳吐单抗通过精巧的双臂设计,直接征用人体内最强大的杀手——细胞毒性T细胞(CTLs)。它能将T细胞强行拉向肿瘤细胞,打破了传统疗法的局限,为复发/难治性(R/R)B细胞恶性肿瘤患者带来了生存希望。

一、研发历程
博纳吐单抗的诞生历经数十年,克服了技术瓶颈与监管挑战,是一段从理论到现实的艰难旅程。
1. 早期双特异性抗体的困境
双特异性抗体(Bispecific Antibody, bsAb)的概念最早可追溯至20世纪60年代,但早期研发陷入了被称为“死亡之谷”的困境:
- 生产噩梦:在杂交杂交瘤系统中,两条不同的重链和两条不同的轻链随机组合,理论上可以产生10种不同的分子形式。在这10种组合中,只有一种是具有正确双特异性的目标抗体,其余9种都是无用的副产物。这导致了极低的产率和极高的纯化难度,使得大规模生产几乎成为不可能完成的任务。
- 免疫原性问题:早期的抗体多源自小鼠或大鼠。当这些异源蛋白进入人体后,免疫系统会迅速识别它们并产生人抗鼠抗体(HAMA)或人抗大鼠抗体(HARA)。这种免疫反应不仅会中和药物的疗效,还可能引发严重的过敏反应,甚至危及患者生命。
- 临床试验的溃败:20世纪90年代,多个针对CD19/CD3或MOv18/CD3的双特异性抗体临床试验相继失败。尽管它们在体外培养皿中表现出色,但在患者体内却引发了严重的细胞因子释放,且未能观察到持久的临床疗效。例如,第一代双特异性抗体在治疗卵巢癌和淋巴瘤的尝试中,因无法在肿瘤部位达到有效浓度且半衰期过短而告终。
这一连串的打击让制药界对双特异性抗体产生了深深的怀疑。许多大药企纷纷撤资,认为这一概念虽然在理论上完美,但在工程上无法实现。该领域一度陷入了长达十年的沉寂期。
2. Micromet的坚持与BiTE技术的诞生
正是在这片废墟之上,位于德国慕尼黑的初创生物技术公司 Micromet GmbH(后更名为Micromet, Inc.)开始了它的征程。Micromet成立于20世纪90年代中期,是从慕尼黑大学免疫学系分离出来的衍生公司。1998年,Micromet从学术机构获得了CD19/CD3双特异性抗体的授权,这就是后来被称为 MT103(即博纳吐单抗)的分子。
当时,Micromet的首席科学官帕特里克·鲍尔勒(Patrick Baeuerle)和他的团队面临着巨大的压力。投资人对双特异性抗体持极度保留态度,资金链时刻面临断裂的风险。然而,Baeuerle坚信T细胞衔接的潜力。他和Peter Kufer等人决定放弃传统的全长抗体结构,转而采用一种全新的、极简的设计——“双特异性T细胞衔接器”(BiTE)。
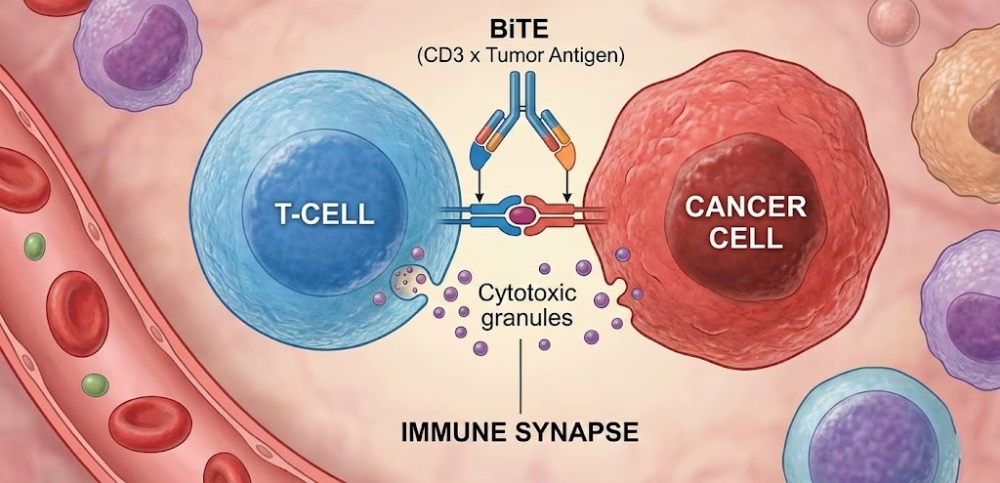
Micromet团队的关键创新在于:
(1)单多肽链结构:BiTE分子由一条单一的多肽链组成,这使得它可以由真核细胞高效表达,彻底解决了杂交杂交瘤面临的轻重链错配问题。
(2)去除Fc段:去除Fc段意味着它不会非特异性地结合Fc受体阳性的细胞(如巨噬细胞或NK细胞),从而减少了不必要的背景免疫激活。同时,小分子量使其具有更好的组织渗透性,能够更容易地穿透肿瘤微环境。
(3)极高的效能:早期体外研究发现,BiTE分子在皮摩尔甚至飞摩尔浓度下即可诱导T细胞杀伤肿瘤。这比普通抗体依赖细胞介导的细胞毒性(ADCC)效能高出数千倍。这种惊人的效能意味着临床所需的剂量极低,从而降低了生产成本。
3. 监管挑战与剂量策略的意外发现
2006年的TGN1412灾难(因T细胞过度激活导致志愿者多器官衰竭)导致监管环境极度收紧。监管机构要求博纳吐单抗采用极低的起始剂量(MABEL,0.5μg/(m2·d)。这种极为谨慎的剂量爬坡过程,反而帮助研究人员摸索出了通过阶梯给药来管理细胞因子释放综合征(CRS)的关键策略,并验证了其在微量下的惊人活性。
4. 商业化里程碑
2008年,《科学》(Science)杂志发表了博纳吐单抗治疗复发/难治性非霍奇金淋巴瘤(NHL)的I期临床数据。2012年,安进(Amgen)以约11.6亿美元收购Micromet,不仅提供了充足资金,也标志着BiTE技术获得主流认可 。2014年12月3日,FDA加速批准 Blincyto(博纳吐单抗)用于治疗费城染色体阴性(Ph-)的复发/难治性(R/R)前体B细胞急性淋巴细胞白血病(B-ALL),使其成为全球首个获批的BiTE药物,也是FDA批准的最快的药物之一。 继2014年FDA获批后,该药迅速在欧盟、日本等主要市场获得准入,根据摩熵医药数据库显示,该药于2020进入中国市场,其适应症为R/R ALL。
二、作用机制
博纳吐单抗不仅是药物,更是一种物理连接器。它不直接杀伤肿瘤,而是通过强行拉近T细胞与肿瘤细胞的距离,借刀杀人。
1. 免疫突触的重构与“强吻”
在自然状态下,T细胞受体(TCR)识别靶细胞上的抗原肽-MHC复合物(pMHC)是一个极其精密的过程,通常被比喻为一次高度特异性的“握手”。只有当握手力度(亲和力)合适且环境(共刺激信号)允许时,T细胞才会激活。而肿瘤细胞往往通过下调MHC分子来把手“藏起来”,或者通过表达PD-L1等检查点分子来传递抑制信号,从而逃避T细胞的识别(免疫逃逸)。
博纳吐单抗彻底改变了这一规则。
- 非MHC限制性:博纳吐单抗的一端结合T细胞表面的CD3ε亚基(TCR复合物的一部分),另一端结合B细胞表面的CD19抗原。这种结合完全绕过了MHC分子的呈递要求。无论肿瘤细胞是否表达MHC,只要有CD19,博纳吐单抗就能将其锁定。这对于那些通过下调MHC来逃避免疫监视的肿瘤尤为有效。
- 人工免疫突触:当博纳吐单抗将T细胞和肿瘤细胞拉近到约10-15纳米的距离时,它诱导形成了一个类似于天然免疫突触(Immunological Synapse, IS)的结构。
- 多点接触与稳定性:与天然TCR仅需少量接触即可激活不同,BiTE诱导的突触可能包含数千个结合位点,形成一个巨大的、异常稳定的接触面。这种强效的连接被形象地称为“魔术贴”(Velcro)效应或“致命的强吻”。在这个狭小的突触间隙中,高浓度的溶细胞颗粒被释放,确保了杀伤的精准性,同时减少了对周围正常组织的误伤。
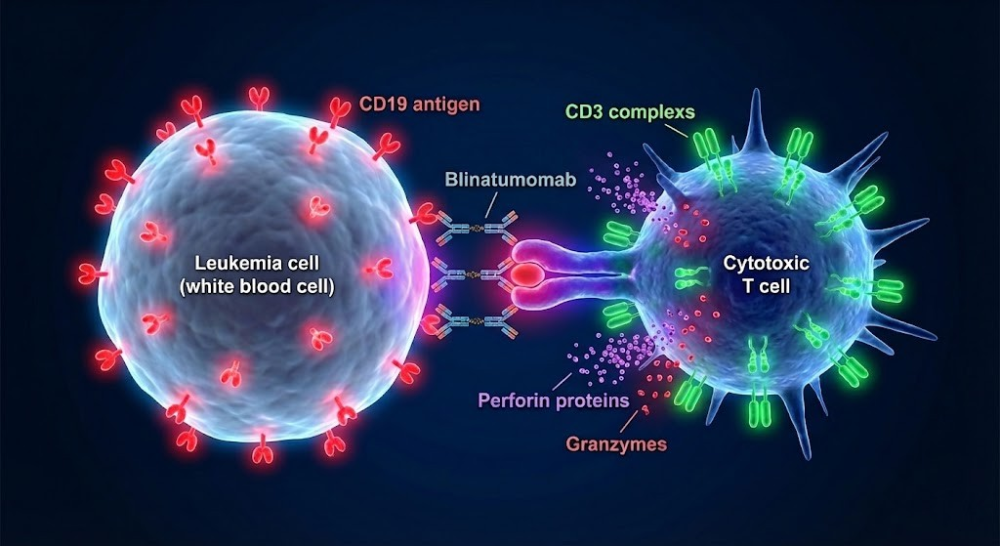
2. 连环杀手模式
被博纳吐单抗激活的T细胞并不是一次性消耗品。相反,它们展现出了“连环杀手”的特质。
(1)快速裂解:一旦突触形成,T细胞迅速极化,并将溶细胞颗粒(Lytic Granules)定向运输到突触部位。这些颗粒释放穿孔素(Perforin)和颗粒酶(Granzyme)。穿孔素在肿瘤细胞膜上打孔,颗粒酶随之进入胞内,激活半胱天冬酶(Caspase)级联反应,诱导肿瘤细胞凋亡。
(2)脱离与再结合:完成杀伤后,T细胞会与死亡的靶细胞分离,并迅速寻找下一个CD19阳性目标。显微镜下的观察显示,一个T细胞在BiTE的辅助下,可以连续跳跃、结合并杀伤多个肿瘤细胞,这一过程被称为“连环杀伤”。
(3)自我扩增:这种激活还会刺激T细胞自身的增殖。在临床治疗中,经常观察到患者体内的T细胞数量在治疗初期显著增加,这进一步放大了治疗效果。这种多克隆T细胞的扩增使得即便初始T细胞数量较少的患者也能获益。
3. 旁观者效应与细胞因子风暴
这种强效激活是一把双刃剑。激活的T细胞不仅释放毒素,还会大量分泌炎症细胞因子,如干扰素-γ(IFN-γ)、白介素-6(IL-6)、白介素-10(IL-10)和肿瘤坏死因子-α(TNF-α)。
- 细胞因子释放综合征(CRS):这些因子的急剧升高正是引发CRS的元凶,表现为高热、低血压、缺氧,严重时可导致毛细血管渗漏和多器官衰竭。IL-6被认为是CRS的核心驱动因子,这也是为什么IL-6受体拮抗剂托珠单抗(Tocilizumab)成为治疗CRS的标准药物。
- 神经毒性机制:2024-2025年的最新研究表明,神经毒性(ICANS)可能与全身炎症导致的血脑屏障(BBB)内皮细胞激活有关。博纳吐单抗诱导内皮细胞上调粘附分子(VCAM-1, ICAM-1),促使外周激活的T细胞粘附并迁移至中枢神经系统(CNS),引发局部的“微型风暴”。
三、临床应用与挑战
由于特殊的药物性质,博纳吐单抗的临床使用具有独特的方式和挑战。
1. 连续输注(cIV)的必要性
由于分子量极小(~55 kDa)且缺乏Fc段,博纳吐单抗在体内会被迅速清除,半衰期仅约2小时 。为维持有效浓度,患者必须接受连续静脉输注,通常一个周期为28天连续输注,随后休药14天。
2.“背包侠”的日常
患者需要随身携带便携式输液泵,这催生了独特的“背包文化” 。
- 生活限制:淋浴、睡眠都需要小心处理管路和泵,报警声常是夜间的困扰 。
- 心理获益:尽管有束缚,但相比高强度化疗的住院痛苦,背着背包能在家自由活动、上学,对患者(尤其是儿童)是一种巨大的解脱 。
给药方式有了重大改进:皮下注射,目前处于临床研究阶段。公布的皮下注射剂型(SC) 1b/2期临床数据显示了积极结果。其优势在于皮下制剂在维持高缓解率的同时,展现了与静脉输注相当甚至更好的安全性(如细胞因子释放综合征CRS发生率可控)。一旦获批,将极大提升患者的便利性和依从性,实现“去住院化”治疗。
根据摩熵医药-中国药品审评数据库的最新监测数据显示,2026年1月5日,CDE正式受理了安进公司递交的进口申请(受理号:JXSL2600001),这意味着该药离‘去住院化’治疗的目标又近了一步。”
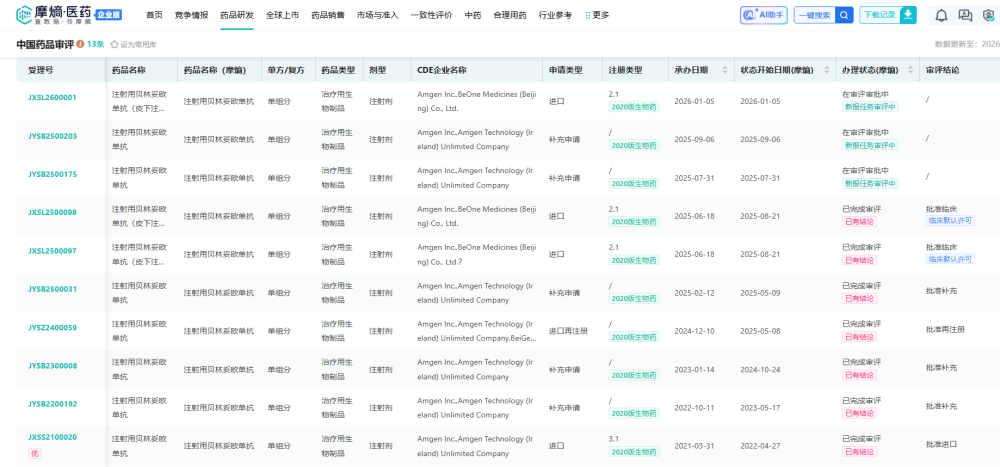
查数据,找摩熵!图源:摩熵医药-中国药品审评数据库
3. 副作用管理
- CRS管理:核心策略是阶梯式给药,即从极低剂量开始,待适应后再提升至目标剂量,必要时使用托珠单抗 。
- 神经毒性管理:症状包括失语、书写困难等,通常在停药和使用皮质类固醇后可逆。
四、博纳吐单抗 vs. CAR-T
在CD19靶向治疗领域,博纳吐单抗和CAR-T(如Tisagenlecleucel, Axicabtagene ciloleucel)常被放在一起比较。两者都利用T细胞杀伤,但策略截然不同:一个是“现货型”的蛋白药物,一个是“定制化”的活细胞药物。
全方位对比分析
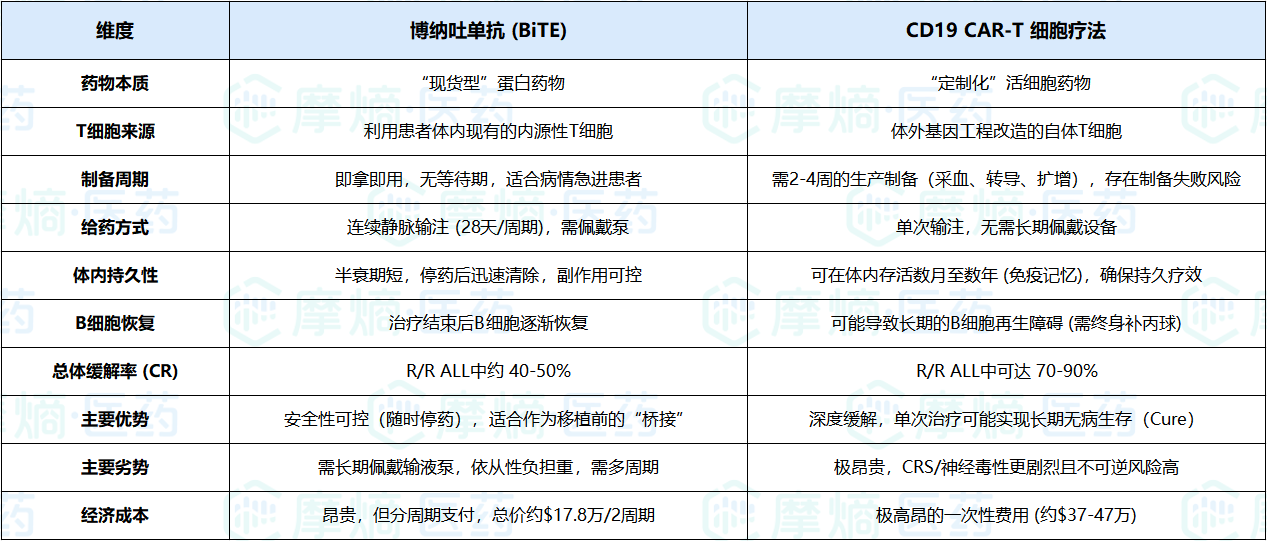
深入洞察:互补而非互斥
最新的临床趋势并非“二选一”,而是“序列战”或“组合拳”。
- 降肿瘤负荷:CAR-T治疗前,若患者肿瘤负荷过高,发生致死性CRS和神经毒性的风险极大。博纳吐单抗可用于先期降低肿瘤负荷,使后续CAR-T治疗更加安全。
- 桥接移植:对于许多高危ALL患者,博纳吐单抗能高效清除微小残留病变(MRD),使患者在最佳状态(MRD阴性)下接受异基因造血干细胞移植(allo-HSCT)。研究表明,MRD阴性是移植成功的关键预测因子。
- 序贯治疗的等效性:2024年的研究数据表明,二者在作为移植前桥接治疗时,2年总生存率(OS)和无进展生存率(PFS)无显著统计学差异(博纳吐单抗组OS 88.89% vs CAR-T组 73.89%),暗示对于等待移植的患者,博纳吐单抗可能是一个更温和、更经济且同样有效的选择。
- 耐药机制的重叠:两者都面临CD19抗原丢失(抗原逃逸)的挑战。有些白血病细胞会发生CD19基因突变或通过可变剪接产生不含表位的CD19异构体,甚至发生谱系转换变成髓系白血病,从而同时逃避这两种疗法的打击。
五、结语
从1998年获得授权,到2014年FDA获批,博纳吐单抗走了17年。
作为全球首个获批的BiTE分子,它证明了一件事:不需要复杂的细胞工程改造(像CAR-T那样),仅仅通过一个精巧的蛋白设计,就能让T细胞成为癌症的克星。
虽然现在的双抗研发都在拼命加回Fc段以延长半衰期,但博纳吐单抗在那个年代留下的工程学智慧,依然是今天免疫治疗最宝贵的遗产。
往期精彩:
1. 从专利基石到策略博弈:药物研发中小分子与大分子的专利密码
2. 新药研发密码:构效循环、利平斯基五规则与PROTACs新范式大揭秘
3. 药物研发“硬核攻略”:ADME过程、体外模型构建及体内PK参数全解析
查数据,找摩熵!想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论