
2月10日,美国FDA正式批准 默沙东 重磅PD-1抑制剂 帕博利珠单抗(Keytruda,俗称“K药”)的新适应症——联合化疗(可联合或不联合贝伐珠单抗),用于治疗铂耐药的上皮性卵巢癌、输卵管癌或原发性腹膜癌成年患者。
值得关注的是,这不仅标志着免疫治疗在铂耐药复发性卵巢癌领域实现重大突破,也是“K药”获批的首个卵巢癌适应症,为长期缺乏有效治疗手段的患者带来全新希望。

截图来源:FDA 官网
十年磨一剑,KEYNOTE-B96奠定获批基石
此次卵巢癌适应症的获批,核心依据是关键性III期临床试验KEYNOTE-B96的研究成果。该研究是全球首个在铂耐药复发性卵巢癌中探索免疫检查点抑制剂治疗方案的III期试验,共入组约643名患者,旨在系统评估 帕博利珠单抗 联合化疗(可联合或不联合贝伐珠单抗)的疗效与安全性。
试验数据亮点显著:在466例PD-L1表达阳性且综合阳性评分(CPS)≥1的肿瘤患者中,帕博利珠单抗 组的中位无进展生存期(PFS)达8.3个月,较安慰剂组的7.2个月显著延长(风险比HR=0.72;p=0.0014);中位总生存期(OS)更从安慰剂组的14.0个月提升至18.2个月(HR=0.76;p=0.0053)。
安全性方面,帕博利珠单抗 联合 紫杉醇(无论是否联用贝伐珠单抗)的整体表现与此前癌症试验中观察到的特征一致,未出现新的安全风险信号。
卵巢癌治疗痛点待解,“K药”破局铂耐药困局
卵巢癌作为全球女性第八大常见癌症、第八大癌症死亡原因,其治疗难点长期聚焦于铂耐药复发群体。一线铂类化疗虽能延缓疾病进展,但约25%患者在完成一线治疗后六个月内会出现耐药性(即原发性铂耐药性卵巢癌),此类患者预后极差,既往治疗选择极为有限,五年生存率不足30%。
默沙东实验室全球临床开发副总裁Gursel Aktan博士在新闻稿中强调:“作为首个有确凿数据证实可改善部分铂耐药复发性卵巢癌患者生存期的免疫疗法,基于Keytruda的这一方案,有望重塑此类患者的治疗模式,为临床实践提供全新路径。”
从“药王”到新增长极,K药加速拓展边界
帕博利珠单抗 是默沙东研发的明星抗PD-1单抗,自2014年首获FDA批准以来,已在全球斩获数十项适应症,覆盖黑色素瘤、头颈癌、非小细胞肺癌等至少16种癌症类型;在国内亦已获批20项适应症,成为肿瘤免疫治疗的核心药物之一。
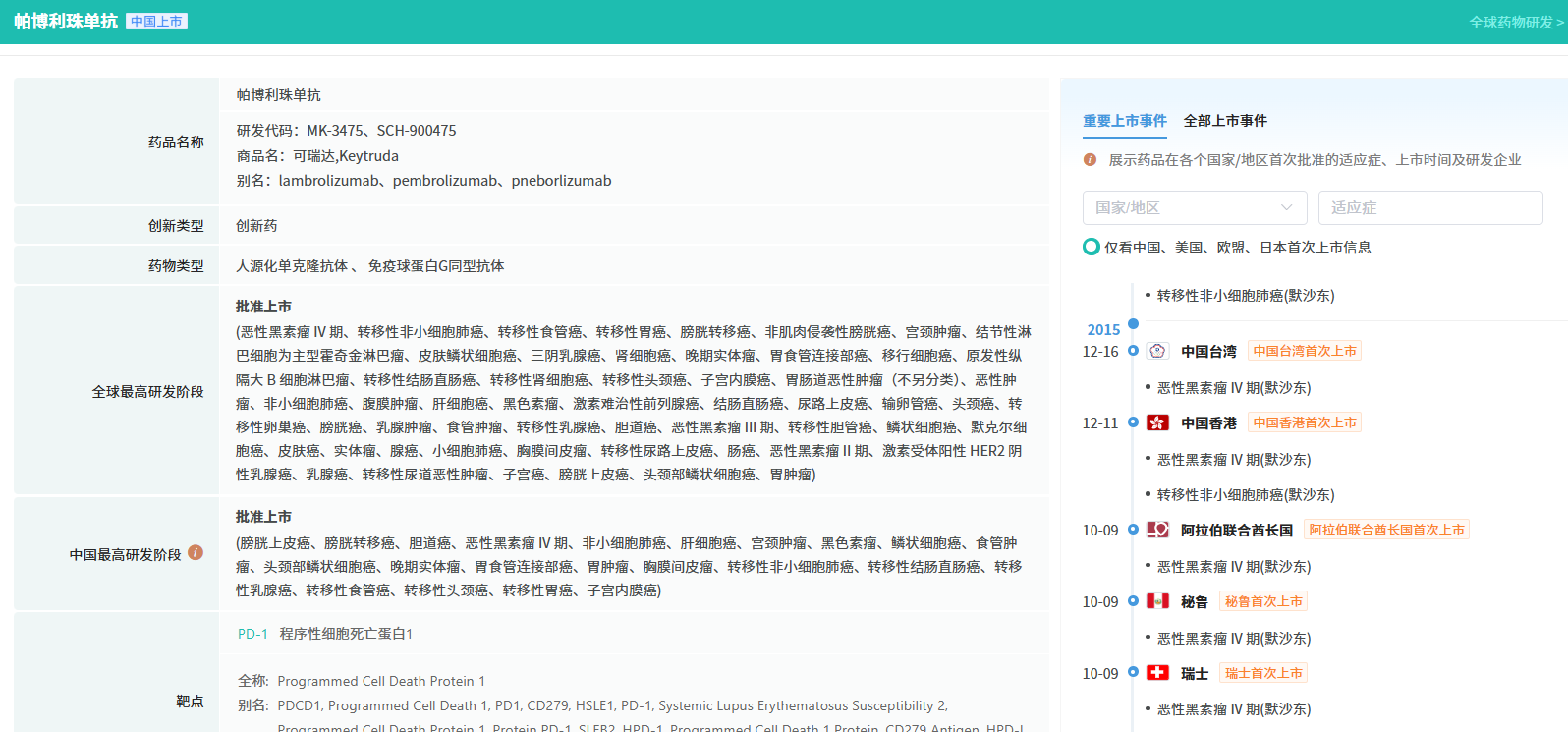
查数据,找摩熵!图源:摩熵医药数据库-全球药物研发数据库
凭借广泛的适应症布局与稳定的临床价值,K药 销售业绩连年攀升,2023年、2024年两度登顶“全球药王”,2025年全球销售额达316.8亿美元,虽增速放缓至7.46%,但仍保持稳健增长。























































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论