1.4.1 本周全球TOP10创新药研发进展
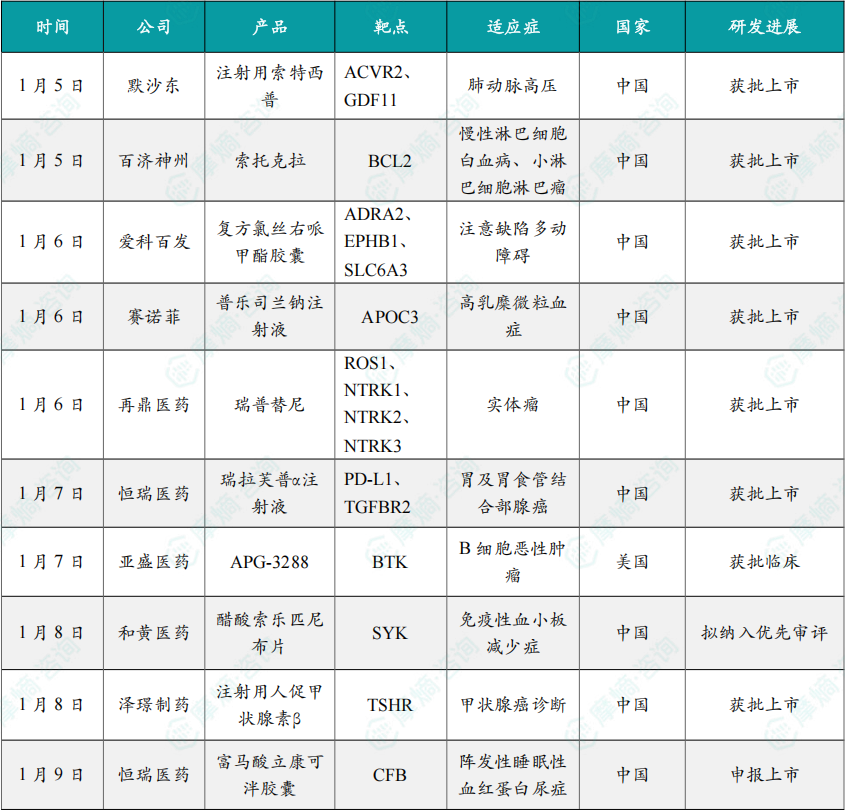
(1)默沙东肺动脉高压创新药物索特西普在华获批
1月5日,默沙东(MSD)宣布,激活素信号传导抑制剂(ASI)注射用索特西普 已获得中国国家药品监督管理局(NMPA)批准,适用于治疗WHO功能分级(FC)Ⅱ-Ⅲ级的肺动脉高压(PAH,WHO第1组)成年患者,以改善患者的运动能力和WHO功能分级。
ASI是针对PAH病因治疗的新型生物制剂,此次获批是基于3期临床试验STELLAR的研究数据。研究表明,PAH的肺血管发生病理性重构,血管负荷进行性加重,并最终导致右心室肥厚与结构改变。“激活素-骨形态发生蛋白”信号通路失衡,激活素A水平升高,是驱动PAH肺小动脉结构改变的关键。不同于扩血管对症治疗,索特西普 治疗肺动脉高压的机制为逆转肺血管重构的对因治疗,为PAH患者带来了新的治疗选择。
(2)百济神州BCL-2抑制剂索托克拉双适应症获批上市
1月5日,NMPA官网显示,百济神州BCL-2抑制剂 索托克拉 两项适应症中国获批上市,适用于治疗既往接受过治疗的慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)成人患者,以及治疗既往接受过抗CD20治疗和BTKi治疗的套细胞淋巴瘤(MCL)成人患者。
索托克拉 是百济神州开发的一款强效、高选择性BCL-2抑制剂,其设计旨在产生更深、更持久的靶点抑制。
根据百济神州介绍,与维奈克拉相比,索托克拉在临床前研究和肿瘤模型中均显示出更高的效力(大于10倍的差异)和靶点选择性,并有可能克服耐药性。
(3)爱科百发“多动症”新药在中国获批
1月6日,爱科百发宣布,中国国家药品监督管理局(NMPA)已批准 复方氯丝右哌甲酯胶囊 的新药上市申请,适用于6岁及6岁以上注意缺陷多动障碍(ADHD,俗称“多动症”)患者的治疗。
复方氯丝右哌甲酯胶囊 是一款具有创新机制的ADHD治疗药物,为包含 速释右哌甲酯(d-MPH)和 前药丝右哌甲酯(SDX)的复方制剂。它通过调节与ADHD相关的大脑神经递质,为患者提供一种兼具速效和长效作用的治疗选择。该药物于2021年3月在美国获批,在安全性及治疗机制方面具有明显优势。
在针对中国ADHD患者的关键性3期临床试验中,复方氯丝右哌甲酯胶囊 达到了预设的主要终点和关键次要终点。研究结果显示,与安慰剂相比,该药物在所有访视时点均能显著改善患者的ADHD核心症状,且差异具有统计学意义,疗效明确。
(4)赛诺菲降脂siRNA新药普乐司兰钠在中国获批
1月6日,赛诺菲(Sanofi)宣布创新药物 普乐司兰钠注射液 正式获得中国国家药品监督管理局(NMPA)批准,在饮食控制基础上,用于降低家族性乳糜微粒血症综合征(FCS)成人患者的甘油三酯水平。
FCS是一种高甘油三酯水平相关的遗传性疾病。作为作用于创新靶点APOC3(载脂蛋白C-III)mRNA的小干扰RNA(siRNA)药物,普乐司兰钠注射液在临床研究中能够将FCS患者空腹甘油三酯水平较基线降低80%、急性胰腺炎发生率较安慰剂降低80%,且仅需一年四次给药。
此外,FDA于2025年12月授予 普乐司兰钠注射液 针对严重高甘油三酯血症(sHTG)的突破性疗法认定,有望进一步拓展治疗管理范围,惠及更多患者。
(5)再鼎医药的瑞普替尼在中国获批,治疗NTRK阳性实体瘤
1月6日,再鼎医药宣布,中国国家药品监督管理局(NMPA)已批准 奥凯乐®(瑞普替尼)的补充新药上市申请(sNDA),用于治疗携带神经营养性酪氨酸受体激酶(NTRK)基因融合的成人实体瘤患者。该类患者为患有局部晚期转移性实体瘤或手术切除可能导致严重并发症的患者,且这些患者既往治疗失败或无满意替代治疗。这是该产品在中国获批的第二个适应症。
瑞普替尼 是靶向作用于ROS1和NTRK致癌因子的新一代酪氨酸激酶抑制剂。携带ROS1和NTRK基因融合阳性的实体瘤(包括NSCLC)患者在接受目前已获批准的靶向治疗后,通常会出现耐药突变,这些突变限制了药物与靶点的结合,最终导致肿瘤进展。瑞普替尼 是新一代ROS1和NTRK TKI,其独特设计可改善包括脑部病灶在内的获益持久性。
(6)恒瑞医药抗PD-L1/TGF-βRII双功能融合蛋白获批上市
1月7日,NMPA官网显示,恒瑞医药抗PD-L1/TGF-βRII双功能融合蛋白 瑞拉芙普α注射液(SHR-1701)获批上市,联合氟尿嘧啶类和铂类药物用于局部晚期不可切除、复发或转移性胃及胃食管结合部腺癌的一线治疗。
SHR-1701 是恒瑞医药自主研发并具有知识产权的抗PD-L1/TGF-βRII双功能融合蛋白,可以促进效应性T细胞的活化,同时还可有效改善肿瘤微环境中的免疫调节作用,最终有效促进免疫系统对于肿瘤细胞的杀伤。
此前,国内外尚无同类产品获批上市。2024年6月,SHR-1701 的III期研究(SHR-1701-III-307)达到了方案预设的主要研究终点。研究结果显示,SHR-1701 联合化疗组在主要研究终点上显著优于安慰剂联合化疗组,可显著延长胃癌或胃食管结合部腺癌患者的总生存期,且未发现新的安全性风险信号,安全性可接受。
(7)亚盛医药BTK降解剂在美国获批临床
1月7日,亚盛医药宣布,公司研发的新一代BTK靶向蛋白降解剂 APG-3288 的新药临床申请(IND)已获美国FDA许可,将开展其治疗复发/难治B细胞恶性肿瘤的临床研究。该研究是一项全球多中心、开放性的1期临床研究,旨在评估 APG-3288 治疗复发/难治性血液系统恶性肿瘤患者的安全性、耐受性、PK特征及初步疗效。
APG-3288 是亚盛医药基于蛋白降解靶向嵌合体(PROTAC)技术平台自主研发的首个新型高效和高选择性BTK降解剂。该分子通过促进三元复合物BTK-PROTAC-Cereblon E3泛素连接酶的形成随之经蛋白酶体降解BTK。
与传统BTK抑制剂不同,APG-3288 旨在通过降解而非抑制的方式发挥作用,可诱导野生型与多种对现有BTK抑制耐药的突变型BTK发生快速、强效、高选择性和持续性的降解,在源头阻断BCR–BTK信号通路,从而克服BTK抑制剂耐药,为BTK靶向治疗提供差异化的解决方案。
(8)和黄医药Syk抑制剂索乐匹尼布拟纳入优先审评
1月8日,CDE网站显示,和黄医药的 醋酸索乐匹尼布片 拟纳入优先审评,适应症为既往接受过一线标准治疗(糖皮质激素、免疫球蛋白)无效或复发的成人原发慢性免疫性血小板减少症(ITP)。
索乐匹尼布 是一种用于治疗血液恶性肿瘤和自身免疫性疾病的新型、高选择性的口服脾酪氨酸激酶(Syk)抑制剂。2024年6月《柳叶刀·血液病学(The Lancet Haematology)》发表的ESLIM-01研究结果表明,索乐匹尼布 有潜力成为既往接受过至少一种治疗的免疫性血小板减少症患者的治疗选择。研究结果显示,索乐匹尼布 在原发免疫性血小板减少症患者中展现出具有临床意义的快速且持久的持续血小板计数应答,具有可耐受的安全性特徵,并改善了患者的生活质量。
(9)泽璟制药人促甲状腺素β获批上市
1月8日,泽璟制药宣布收到国家药监局核准签发的《药品注册证书》,其自主研发的注射用人促甲状腺素β(曾用名:注射用重组人促甲状腺激素,商标:泽速宁®)的新药上市申请获得批准,用于分化型甲状腺癌患者在甲状腺全切或近全切除术后随访中的协同诊断,以进行血清甲状腺球蛋白(Tg)检测, 伴或不伴放射性碘(131I)全身显像(WBS)检查。该药物是我国首个获批用于分化型甲状腺癌术后精准评估的创新产品。
注射用人促甲状腺素β(rhTSH)是泽璟制药自主研发的生物大分子药物,属于治疗用生物制品。2025年6月,泽璟制药与德国默克达成合作协议,授权其作为 rhTSH 在中华人民共和国境内(为本协议之目的,不包括香港特别行政区、澳门 特别行政区和台湾地区)的独家市场推广服务商。
(10)恒瑞医药宣布补体因子B抑制剂小分子新药申报上市
1月9日,恒瑞医药宣布其子公司成都盛迪医药收到中国国家药品监督管理局(NMPA)下发的《受理通知书》,公司自主研发的1类新药 富马酸立康可泮胶囊 的药品上市许可申请获受理,适应症为:治疗既往未接受过补体抑制剂治疗的阵发性睡眠性血红蛋白尿症(PNH)成人患者。
阵发性睡眠性血红蛋白尿症(PNH)是一种后天获得性溶血性疾病,其特征为CD55(衰变加速因子,DAF)和CD59(反应性溶解膜抑制物,MIRL)缺乏导致补体介导的血管内溶血,主要临床表现为血管内溶血、潜在的造血功能衰竭及血栓形成倾向。
富马酸立康可泮胶囊(研发代号:HRS-5965)是以补体活化系统旁路途径中B因子为靶点的口服小分子抑制剂,补体B因子抑制剂可通过靶向因子B抑制AP能同时控制血管内溶血和血管外溶血,弥补了C5补体抑制剂治疗的不足,同时口服给药也提高了患者的用药依从性。
2025年11月,该产品的上市申请已经被NMPA纳入优先审评,用于PNH适应症。该产品用于IgA肾病患者的临床研究也正在进行中。
1.4.2 本周全球TOP10积极/失败临床结果
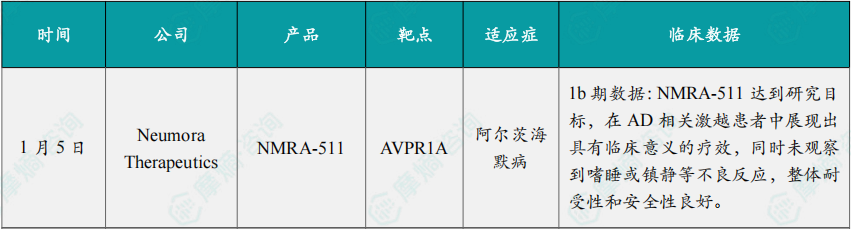

(1)Neumora Therapeutics公布NMRA-511 1b期临床积极结果
1月5日,Neumora Therapeutics宣布,其口服、可穿越血脑屏障的在研血管升压素1a受体(V1aR)拮抗剂 NMRA-511 在阿尔茨海默病相关激越(AD agitation)患者中开展的1b期信号探索性研究取得积极结果。
在本次试验中,NMRA-511 达到研究目标,在AD相关激越患者中展现出具有临床意义的疗效,同时未观察到嗜睡或镇静等不良反应,整体耐受性和安全性良好。基于这一结果,Neumora计划在今年启动 NMRA-511 的多项剂量递升研究,并开展2/3期剂量探索研究。
(2)QurAlis Corporation公司公布其在研疗法QRL-101 1期临床数据
1月6日,QurAlis Corporation公司公布了其在研疗法 QRL-101 用于治疗肌萎缩侧索硬化的1期机制验证(PoM)临床试验数据。QRL-101 是一种潜在“best-in-class”的选择性Kv7.2/7.3离子通道开放剂,用于治疗ALS患者由于神经元过度兴奋引起的疾病进展。
此次公布的结果显示,与安慰剂相比,QRL-101 治疗可降低运动神经元的过度兴奋性,且在药物暴露量较高的患者中观察到更显著的疗效。此外,在多项评估指标中均观察到一致且符合预期的变化方向,包括强度-持续时间常数(SDTC)、基强度(rheobase),以及运动神经兴奋性阈值追踪(mNETT)评估中所包含的其他九项指标中的八项。这些结果总体上与此前在健康志愿者中观察到的信号一致。研究还表明,QRL-101 的药代动力学(PK)特征、安全性和耐受性与其既往研究报告的结果一致。本研究中未报告任何严重不良事件,也无受试者因不良事件而中止治疗。
(3)Alumis公布envudeucitinib 3期临床积极结果,针对斑块型银屑病
1月6日,Alumis宣布,其下一代高选择性口服酪氨酸激酶2(TYK2)抑制剂 envudeucitinib 在两项针对中重度斑块型银屑病患者开展的3期临床试验ONWARD1和ONWARD2中取得积极顶线结果。基于本次数据进展,Alumis计划于2026年下半年向美国FDA提交新药申请(NDA)。
结果显示,envudeucitinib 在两项研究中均以高度统计学显著性达成所有主要及次要终点。在ONWARD1和ONWARD2中,该药在第16周实现了显著优于安慰剂的皮损清除效果(p<0.0001),并在共同主要终点银屑病面积与严重程度指数(PASI)改善至少75%(PASI 75)和静态医师整体评估(sPGA)0/1上取得优势。两项研究合计数据显示,平均74%的患者达到PASI 75,59%的患者达到sPGA 0/1,且疗效随时间进一步加深。同时,两项试验在共同主要终点上的安慰剂校正应答率表现一致。
(4)强生自身免疫单抗nipocalimab 2b期临床达主要终点
1月6日,强生(Johnson & Johnson)宣布,其针对系统性红斑狼疮(SLE)成人患者开展的2b期JASMINE研究取得积极顶线结果。JASMINE研究为一项为期52周、多中心、随机、双盲、安慰剂对照、平行分组的剂量探索性研究,共纳入228例活动性SLE成人患者。
结果显示,该研究成功达到主要终点,即在第24周时,接受治疗患者达到系统性红斑狼疮应答指数(SRI-4)复合应答的比例,较安慰剂具有统计学显著性差异。同时,研究还达成多项关键次要及探索性终点,其中包括显示 nipocalimab 具有潜在类固醇减量作用的指标。
此外,nipocalimab 在本项研究中的安全性和耐受性与此前2期研究一致,未观察到新的安全信号。根据新闻稿,这是首个在活动性SLE治疗中取得积极结果的新生儿Fc受体(FcRn)阻断剂研究。强生已启动相关3期临床项目。
(5)阿斯利康公布皮下注射剂anifrolumab 3期临床积极数据
1月6日,阿斯利康宣布其在治疗系统性红斑狼疮(SLE)领域的重大突破:III期TULIP-SC试验的阳性完整结果显示,皮下注射(SC)版本的 Saphnelo(anifrolumab)在降低患者疾病活动度方面表现出具有统计学意义和临床意义的改善。
这项研究数据表明,在接受治疗的第52周,56.2%的患者实现了基于英国群岛狼疮评估组量表(BICLA)的病情缓解,而安慰剂组的这一比例仅为37.1%。这一结果不仅与此前静脉输注(IV)剂型的试验结论高度一致,更证实了皮下注射版本在维持疗效的同时,具备与IV版本相当的安全性特征,这为全球受此疾病困扰的患者提供了更具便利性的自我管理治疗方案选择。
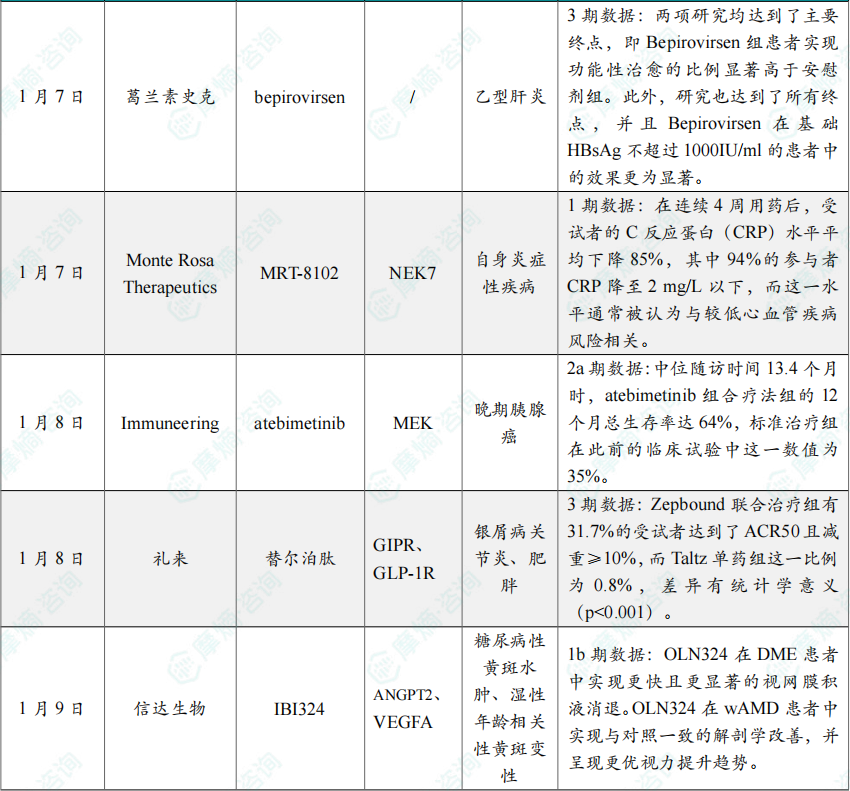
(6)GSK全球首创乙肝新药两项3期研究成功
1月7日,葛兰素史克(GSK)宣布 Bepirovirsen 治疗慢性乙肝的两项III期研究(B-Well 1和B-Well 2)取得了积极结果。该药物是慢性乙肝领域首款完成III期研究的小核酸药物。GSK认为,Bepirovirsen 有望成为首款实现慢性乙肝功能性治愈的药物,已计划今年一季度在全球范围内提交其上市申请。
Bepirovirsen 是GSK从Ionis引进的一种反义寡核苷酸(ASO)疗法,旨在通过抑制乙型肝炎病毒DNA的复制,进而抑制血液中乙型肝炎表面抗原(HBsAg)水平,并刺激免疫系统产生持久应答。
B-Well 1和B-Well 2研究是两项全球多中心、随机、双盲、安慰剂对照临床试验,评估了 Bepirovirsen 对比安慰剂在接受过核苷类似物治疗且基线HBsAg不超过3000IU/ml的慢性乙肝患者中实现功能性治愈的有效性、安全性、药代动力学特征及持久性。
结果显示,两项研究均达到了主要终点,即 Bepirovirsen 组患者实现功能性治愈的比例显著高于安慰剂组。此外,研究也达到了所有终点,并且 Bepirovirsen 在基础HBsAg不超过1000IU/ml的患者中的效果更为显著。
(7)Monte Rosa Therapeutics公布MRT-8102的1期临床中期结果
1月7日,Monte Rosa Therapeutics宣布,其正在开展的一项评估 MRT-8102 的1期临床研究取得了积极的中期结果。
MRT-8102 是一款靶向NEK7的分子胶降解剂,用于治疗由NLRP3炎症小体及IL-1、IL-6通路驱动的炎症相关疾病。研究数据显示,在心血管疾病(CVD)风险较高的人群中,MRT-8102 能够快速且持久地降低全身炎症水平。
分析显示,在连续4周用药后,受试者的C反应蛋白(CRP)水平平均下降85%,其中94%的参与者CRP降至2 mg/L以下,而这一水平通常被认为与较低心血管疾病风险相关。单次递增给药及多次递增给药试验结果显示,在5 mg至400 mg剂量范围内均可实现深度且持续的NEK7蛋白降解。同时,安全性表现良好,出现的不良事件多为轻中度,且未观察到感染风险增加的迹象。
(8)Immuneering公布在研MEK抑制剂atebimetinib组合疗法2a期临床积极结果
1月8日,Immuneering公司宣布,在一项正在进行的2a期临床试验中,在研MEK抑制剂 atebimetinib(IMM-1-104)与 改良吉西他滨/白蛋白紫杉醇(mGnP)联用,一线治疗晚期胰腺癌患者(N=34)获得积极的总生存期(OS)和安全性结果。中位随访时间13.4个月时,atebimetinib 组合疗法组的12个月总生存率达64%,标准治疗组在此前的临床试验中这一数值为35%。该公司计划启动 atebimetinib 组合疗法一线治疗胰腺癌的关键性3期临床试验。
最新数据显示,与已发表的外部标准治疗临床试验数据相比,atebimetinib 组合疗法组的总生存获益持续呈现出显著差异。接受 atebimetinib 联合mGnP一线治疗的胰腺癌患者(N=34),在中位随访13.4个月时,显示出显著的生存获益。截至2025年12月15日,中位总生存期尚未达到,12个月总生存率为64%。此前,在作为标准治疗基准的MPACT关键性试验中,吉西他滨/白蛋白紫杉醇组合的总生存结果显著低于上述结果。
(9)礼来替尔泊肽联合依奇珠单抗治疗银屑病关节炎3期研究成功
1月8日,礼来宣布 Zepbound(替尔泊肽)联合 Taltz(依奇珠单抗)治疗活动性银屑病关节炎(PsA)合并肥胖或超重受试者的IIIb期TOGETHER-PsA研究取得了积极结果。
该研究是首个评估GLP-1药物与PsA生物制剂联用的对照临床研究。Zepbound(替尔泊肽)是一款GIPR/GLP-1R激动剂,已获得FDA批准用于治疗阻塞性睡眠呼吸暂停和肥胖或超重。
Taltz(依奇珠单抗)是一款IL-17A单抗,已获得FDA批准用于治疗活动性银屑病关节炎、斑块状银屑病、活动性强直性脊柱炎和活动性非放射学中轴型脊柱关节炎。
TOGETHER-PsA研究是一项为期52周的随机、多中心、评估者盲法、开放标签IIIb期临床试验(n=271),评估了 Taltz 和 Zepbound 联合给药与单独使用Taltz在活动性银屑病关节炎合并肥胖或超重(BMI≥30kg/m²,或BMI≥27kg/m²但<30 kg/m²)并且至少伴有一项体重相关合并症的成人受试者中的疗效和安全性。研究的主要终点是第36周时既达到ACR50应答又实现减重≥10%的受者比例。
结果显示,第36周时,Zepbound 联合治疗组在主要终点及所有关键次要终点上均取得了优于 Taltz 单药组的数据。具体而言,Zepbound 联合治疗组有31.7%的受试者达到了ACR50且减重≥10%,而 Taltz 单药组这一比例为0.8%,差异有统计学意义(p<0.001)。在关键的次要终点中,Zepbound 联合治疗组达到ACR50的受试者比例相较 Taltz 单药组增加了64%(33.5% vs 20.4%,p<0.05),表明 Zepbound 治疗可以减轻肥胖或超重患者的PsA负担。
(10)信达生物合作伙伴Ollin宣布双抗新药临床1b期研究积极顶线数据
1月9日,信达生物宣布,公司合作伙伴Ollin Biosciences公布其随机、头对头1b期JADE临床研究的积极顶线结果。该研究在超过160例糖尿病性黄斑水肿(DME)或湿性(新生血管性)年龄相关性黄斑变性(wAMD)患者中,对比评估了新一代VEGF/Ang2双特异性抗体 IBI324(Ollin研发代号:OLN324)与一款已获批的Ang2/VEGFA双抗(以下称对照药)的疗效与安全性。
IBI324 由信达生物自研,目前正与Ollin合作进行开发(Ollin研发代号:OLN324)。
OLN324 在DME患者中实现更快且更显著的视网膜积液消退。研究结果显示,在DME患者中,OLN324 相较对照药实现了更快速且幅度更大的视网膜积液消退。基于光学相干断层扫描(OCT)测量,接受OLN324 4mg治疗的患者,其中心视网膜厚度(CST)下降幅度在第1周较对照药高约75%(分别为−79μm vs.−45μm),在第12周高约50%(−180μm vs.−121μm)。此外,在第12周时,近90%的OLN324 4mg组患者实现DME消除(定义为CST < 325μm),而对照药组为57%。
OLN324 在wAMD患者中实现与对照一致的解剖学改善,并呈现更优视力提升趋势。在wAMD患者中,各治疗组均获得了相当的解剖学改善,OCT显示CST在第1周即快速下降,并持续改善至第12周。所有治疗组患者均观察到快速且持续的最佳矫正视力(BCVA)提升,且在DME与wAMD两个适应症中,OLN324 在第12周的视力改善幅度在数值上均优于对照药。
同期事件:
1. 2026年第2周01.05-01.11国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2026年第2周01.05-01.11国内仿制药/生物类似物申报/审批数据分析
3. 2026年第2周01.05-01.11国内医药大健康行业政策法规汇总
以上内容均来自{ 摩熵咨询医药行业观察周报(2026.01.05-2026.01.11) },如需查看或下载完整版报告,可点击!
扩展阅读:
1. 2024年第36周09.02-09.08全球创新药研发概览
2. 2024年第29周07.15-07.21全球创新药研发概览
3. 2024年第18周04.22-5.05全球创新药研发概览
查数据,找摩熵!想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论