1.4.1 本周全球TOP10创新药研发进展
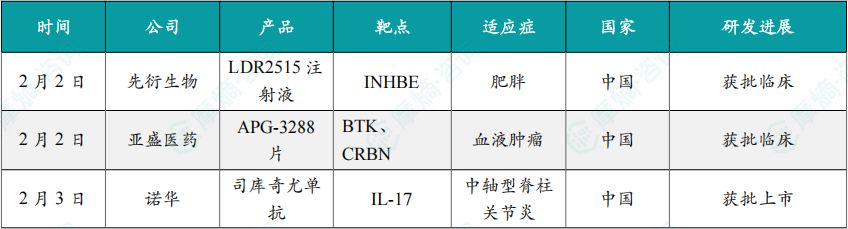
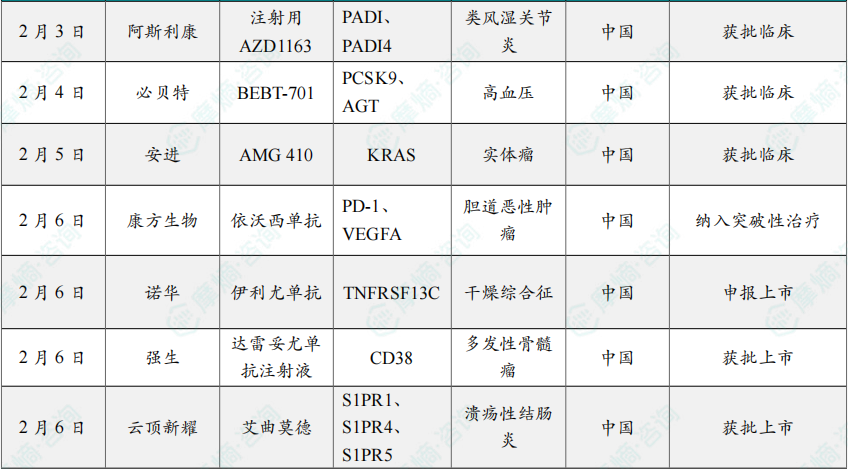
(1)先衍生物siRNA 1类新药获批临床,治疗肥胖
2月2日,中国国家药监局药品审评中心(CDE)官网公示,先衍生物申报的1类新药 LDR2515注射液 获批临床,拟用于成人肥胖或超重的体重管理。
公开资料显示,这是一款靶向INHBE基因的siRNA药物。INHBE基因主要在肝脏中表达,其编码的Activin E蛋白会促进脂质堆积。已有人基因组学研究表明,INHBE基因的功能丧失突变会改善腰臀比、减少腹部脂肪、改善代谢状况、降低心血管疾病和2型糖尿病的风险。
根据先衍生物此前公开资料介绍,临床前研究表明,LDR2515 安全性好,通过皮下注射能够高效且持续抑制肝脏INHBE表达,预计临床可实现每半年至每年一次给药,有望为高质量减重、代谢健康提供新的治疗方案。
(2)亚盛医药BTK降解剂1类新药获批临床
2月2日,中国国家药监局药品审评中心(CDE)官网公示,亚盛医药申报的1类新药 APG-3288片 获批临床,拟开发治疗复发/难治性血液系统恶性肿瘤。公开资料显示,这是亚盛医药研发的新一代BTK靶向蛋白降解疗法。该产品于今年8月已经在美国获批临床,拟开发治疗复发/难治B细胞恶性肿瘤。
APG-3288 是亚盛医药自主研发的首个新型高效和高选择性BTK降解剂。该分子通过促进三元复合物的形成,随之经蛋白酶体降解BTK。与传统BTK抑制剂不同,APG-3288 旨在通过降解而非抑制的方式发挥作用,可诱导野生型与多种对现有BTK抑制耐药的突变型BTK发生快速、强效、高选择性和持续性的降解,在源头阻断BCR–BTK信号通路,从而克服BTK抑制剂耐药,为BTK靶向治疗提供差异化的解决方案。
(3)诺华司库奇尤单抗新适应症在华获批
2月3日,诺华公司(Novartis)宣布,其创新生物制剂 司库奇尤单抗 新适应症获得中国国家药品监督管理局(NMPA)批准,适用于治疗对非甾体类抗炎药(NSAID)应答不佳的活动性放射学阴性中轴型脊柱关节炎(nr-axSpA)成人患者(其客观征象表现为C反应蛋白[CRP]升高和/或磁共振成像[MRI]证据)。
此次nr-axSpA适应症的获批,是继 司库奇尤单抗 成人和儿童中重度斑块状银屑病、强直性脊柱炎、银屑病关节炎和化脓性汗腺炎后,在中国获批的第六个适应症。
中轴型脊柱关节炎(axSpA)是一种慢性炎症性疾病。axSpA疾病谱包括强直性脊柱炎(AS)和nr-axSpA。nr-axSpA患者的疾病负担与AS患者相似,且与AS呈现相同的症状,包括腰背疼痛、疲劳、晨僵和活动受限等。作为一种进展性疾病,若未得到及时干预,可能出现不可逆的结构损伤和功能障碍。研究表明,白介素(IL)-17A是参与axSpA、银屑病、银屑病关节炎病理机制的关键细胞因子。
司库奇尤单抗 作为一款IL-17A抑制剂,可特异性中和多种来源的IL-17A,抑制其促炎作用,缓解nr-axSpA的症状,持续改善病情,为患者带来长期获益。
(4)阿斯利康双抗1类新药在中国获批临床,治疗类风湿关节炎
2月3日,阿斯利康(AstraZeneca)申报的1类新药 注射用AZD1163 获批临床,拟开发治疗类风湿关节炎。公开资料显示,这是一款PAD2/4双特异性抗体。
AZD1163 是一种新型双特异性抗体,可抑制细胞外肽基精氨酸脱亚胺酶(PAD)2和4的活性,这两种酶在类风湿关节炎(RA)患者中负责蛋白质瓜氨酸化。在易感个体中,瓜氨酸化蛋白会激活T细胞驱动的一系列事件,促进B细胞成熟与活化,进而产生致病性抗瓜氨酸化蛋白抗体(ACPA)。ACPA与更差的预后相关,常表现为更严重的关节损伤和快速进展的病程。在体外实验中,AZD1163能抑制RA患者血清和滑液中存在的蛋白质瓜氨酸化及升高的PAD活性。
(5)必贝特医药双靶siRNA新药获批临床,针对高血压
2月4日,必贝特医药宣布,公司自主研发的创新双靶点小核酸药物 BEBT-701 已获中国国家药品监督管理局(NMPA)批准临床,同意本品开展用于治疗轻中度高血压合并低密度脂蛋白胆固醇升高的1-2期临床试验。
高血压常与高LDL-C(低密度脂蛋白胆固醇)等并存,共同构成心脑血管疾病的关键风险因素。以siRNA为代表的小核酸药物凭借GalNAc介导的肝脏靶向性和持久作用特征可实现半年甚至一年给药一次,有效改善长期用药依从性、血药浓度波动大等问题,有望成为心血管代谢性慢病管理模式向低频化、精准化与长期稳定控制转变的新路径。
BEBT-701 是必贝特依托公司专有的GalNAc双寡核苷酸偶联(GDOC)技术平台开发的首个进入人体研究的在研新药,通过单一分子同时沉默肝细胞内的血管紧张素原(AGT)与前蛋白转化酶枯草溶菌素9(PCSK9)两个关键靶点,从机制上实现血压调控通路与血脂代谢通路的协同调控;以“一次给药、双通路联动”的方式,同时改善血压与血脂水平,旨在为高心血管风险人群提供长效、低给药频率、依从性更优的综合慢病管理方案。
(6)安进KRAS抑制剂1类新药在中国获批临床
2月5日,中国国家药监局药品审评中心(CDE)官网显示,安进(Amgen)申报的1类新药 AMG 410 获得临床试验默示许可,拟开发治疗携带KRAS改变的晚期或转移性实体瘤。
公开资料显示,AMG 410 是一款非共价、双功能KRAS抑制剂,正在国际范围内开展针对KRAS突变实体瘤的1期临床研究。
在2025年美国癌症研究协会(AACR)年会上,AMG 410 的分子结构公开亮相。根据AACR官网公开的信息,AMG 410 是一款非共价、双功能KRAS抑制剂,能够同时结合KRAS的非活性(GDP结合)与活性(GTP结合)构象,旨在突破当前已获批G12C靶向疗法的局限性。该分子靶向与KRAS G12C抑制剂相同的变构位点,但对包括G12D、G12V、G12C、G13D在内的多种KRAS突变体均展现出高度抑制活性。
AMG 410 对KRAS具有良好选择性,相较于HRAS和NRAS靶点显示出更高特异性,且在非KRAS驱动的细胞中未观察到明显毒性。在KRAS突变型的结直肠癌、胰腺癌和肺癌临床前模型中,该药物引发了显著的肿瘤缩小。
(7)康方生物依沃西被纳入突破性治疗品种,一线治疗胆道癌
2月6日,康方生物宣布其自主研发的双特异性抗体新药 依沃西(PD-1/VEGF双抗)联合疗法用于一线治疗晚期胆道恶性肿瘤(BTC)已被中国国家药监局药品审评中心(CDE)纳入突破性治疗品种。
根据新闻稿,这也是 依沃西 获得的第五项突破性治疗药物(BTD)认定。此前 依沃西 疗法获得了在肺癌领域的3项BTD认定和1项在三阴性乳腺癌的BTD认定。
康方生物新闻稿表示,依沃西 联合方案则有望成为晚期BTC一线治疗更优的治疗方案:在2024年美国临床肿瘤学会(ASCO)年会上发布的1b/2期临床研究数据显示,依沃西 联合方案治疗胆道癌客观缓解率(ORR)达63.6%,疾病控制率(DCR)为100%;中位无进展生存期(mPFS)达8.5个月,中位总生存期(mOS)达16.8个月,抗肿瘤活性显著,安全性良好,展现出相较于肿瘤免疫1.0疗法显著的迭代优势。
(8)诺华全球首创自免新药在华申报上市
2月6日,国家药品监督管理局药品审评中心官网公示,诺华1类新药 伊利尤单抗注射液(ianalumab)的上市申请已获受理。综合该药物的全球研发进展,业界普遍推测,本次申报的适应症极有可能为干燥综合征。若最终获批,这将成为全球首个针对干燥综合征的靶向治疗药物,标志着这一长期缺乏有效病因治疗的自身免疫性疾病,迎来了全新的治疗篇章。
此次上市申请的核心依据是NEPTUNUS-1和NEPTUNUS-2两项全球多中心关键III期临床试验。研究旨在评估每月一次皮下注射 伊利尤单抗 治疗活动性干燥综合征成人患者的疗效与安全性。
两项试验均成功达到了主要终点:在NEPTUNUS-1研究中,干燥综合征患者经 伊利尤单抗 治疗48周后,EULAR干燥综合征疾病活动度指数(ESSDAI)评分降低了6.4分,而安慰剂组降低5.1分。在NEPTUNUS-2研究中,干燥综合征患者经 伊利尤单抗 治疗48周后,ESSDAI评分降低了6.5分,而安慰剂组降低5.5分。
在安全性方面,伊利尤单抗 表现出良好的耐受性特征,其安全谱与作用机制预期相符。这些积极结果,牢固支撑了其成为干燥综合征领域首个靶向疗法的潜力。
(9)强生创新药达雷妥尤单抗四药联合方案在华获批
2月6日,强生宣布旗下创新治疗药物 兆珂速®——达雷妥尤单抗注射液(皮下注射)正式获得国家药品监督管理局批准拓展适应症,与 硼替佐米、来那度胺 和 地塞米松 联合用药治疗适合自体干细胞移植的新诊断多发性骨髓瘤成年患者。这意味着患者在新诊断阶段即有机会接受基于 达雷妥尤单抗皮下注射制剂 的四药联合方案,获得一项显著改善预后的全新治疗选择。
此次获批是基于III期PERSEUS研究结果。该研究在适合自体干细胞移植的新诊断多发性骨髓瘤患者中,对比评估了以下两种治疗方案:以 达雷妥尤单抗 皮下注射制剂为基础的四药联合方案(DVRd)用于诱导及巩固治疗、随后采用 达雷妥尤单抗皮下注射制剂 联合 来那度胺 进行维持治疗;采用 硼替佐米、来那度胺 及 地塞米松(VRd)进行诱导和巩固治疗、随后以 来那度胺 进行维持治疗。
中位随访47.5个月的研究数据显示,主要终点无进展生存期(PFS)获得显著改善。与VRd方案相比,DVRd方案将疾病进展或死亡风险降低了58%。DVRd方案的整体安全性与 达雷妥尤单抗皮下注射制剂 及VRd方案的已知安全性特征一致。
最常见的血液学不良反应(发生率≥20%)包括中性粒细胞减少症、血小板减少症和贫血。最常见的非血液学不良反应包括周围神经病变、疲乏、外周水肿、发热、上呼吸道感染、新型冠状病毒感染、便秘、腹泻、背痛、失眠、乏力和皮疹。
(10)云顶新耀的艾曲莫德在华获批上市,治疗溃疡性结肠炎
2月6日,云顶新耀宣布其引进的 艾曲莫德(etrasimod,曾用名:伊曲莫德,商品名:维适平)在华获批上市,用于治疗中重度活动性溃疡性结肠炎(UC)。
艾曲莫德 是Arena Pharmaceuticals开发的一款高选择性鞘氨醇-1-磷酸(S1P)受体调节剂,可与S1P受体1、4和5结合。
2017年12月,云顶新耀以2.24亿美元的总交易额引进 艾曲莫德 在大中华区和韩国的独家开发、生产和商业化权利。
2021年12月,辉瑞以总价67亿美元收购Arena Pharmaceuticals,获得 艾曲莫德 的剩余权益。
2023年10月,艾曲莫德片剂(2mg,每日1次,商品名:Velsipity)首次在美国获批上市,用于治疗成人中度至重度活动性UC。
1.4.2 本周全球TOP10积极/失败临床结果
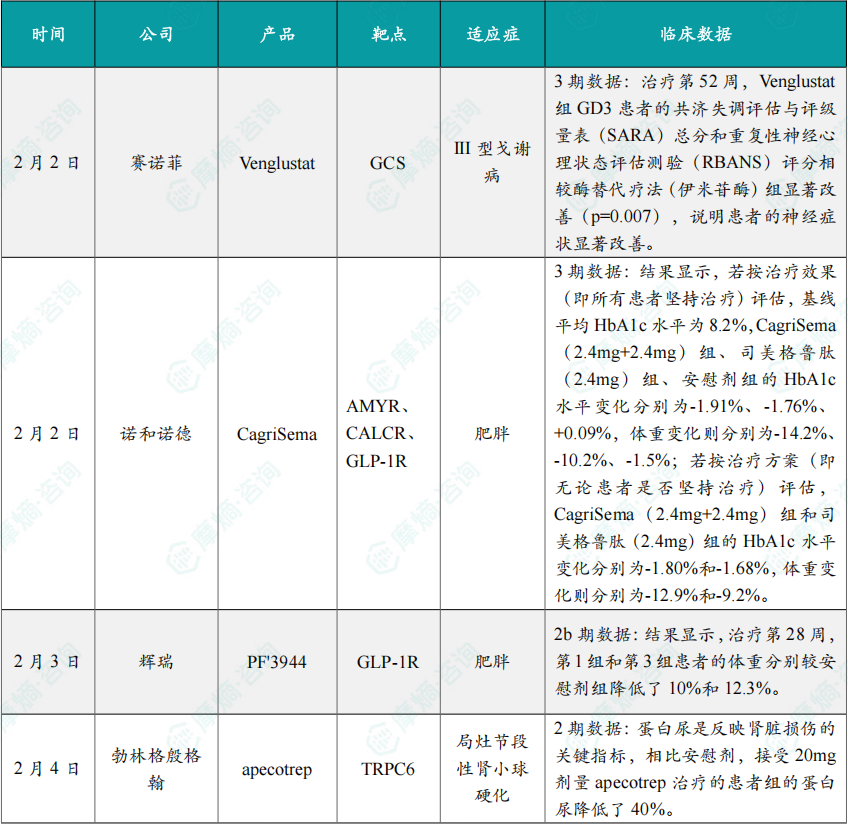
(1)赛诺菲全球首创新药一项3期研究成功,将申报上市
2月2日,赛诺菲公布了 Venglustat 的两项III期研究进展:针对III型戈谢病(GD3)的III期LEAP2MONO研究达到了主要终点,针对法布瑞氏症的III期PERIDOT研究未达到主要终点。基于这些进展,赛诺菲将率先推进 Venglustat 用于治疗GD3的申报上市工作。
Venglustat 是一种新型的口服葡萄糖神经酰胺合成酶抑制剂(GCSi),能够强效抑制N端甲基转移酶1(NTMT1),并且能够穿越血脑屏障,有潜力通过抑制异常鞘糖脂(GSLs)积累及其生理病理后果,延缓相关疾病的进展。
在LEAP2MONO研究中,治疗第52周,Venglustat 组GD3患者的共济失调评估与评级量表(SARA)总分和重复性神经心理状态评估测验(RBANS)评分相较酶替代疗法(伊米苷酶)组显著改善(p=0.007),说明患者的神经症状显著改善。
此外,在体现非神经系统结局的四个关键次要终点中,该研究达到了其中三个终点,即 Venglustat 组在脾脏容量、肝容量和血红蛋白水平方面显著改善。在该研究中,Venglustat 总体耐受性良好,与既往研究相比无新的安全性信号。Venglustat 组最常报告的不良事件包括头痛(14.3%)、恶心(14.3%)、脾脏肿大(14.3%)和腹泻(14.3%)。
(2)诺和诺德CagriSema头对头司美格鲁肽3期研究取得优效性结果
2月2日,诺和诺德宣布 CagriSema 头对头 司美格鲁肽 的III期REIMAGINE 2研究达到主要终点。CagriSema 为诺和诺德开发的一款复方药物,包含长效胰淀素(amylin)类似物 Cagrilintide 与GLP-1受体激动剂司美格鲁肽。
REIMAGINE 2研究纳入了2728例无论是否接受SGLT2抑制剂治疗但经二甲双胍治疗后血糖仍控制不佳的2型糖尿病患者,评估了① CagriSema(2.4mg+2.4mg)对比 司美格鲁肽(2.4mg)、Cagrilintide(2.4mg)和安慰剂以及 ② CagriSema(1.0mg+1.0mg)对比 司美格鲁肽(1.0mg)和安慰剂的疗效与安全性。
结果显示,若按治疗效果(即所有患者坚持治疗)评估,基线平均HbA1c水平为8.2%,CagriSema(2.4mg+2.4mg)组、司美格鲁肽(2.4mg)组、安慰剂组的HbA1c水平变化分别为-1.91%、-1.76%、+0.09%,体重变化则分别为-14.2%、-10.2%、-1.5%;若按治疗方案(即无论患者是否坚持治疗)评估,CagriSema(2.4mg+2.4mg)组和 司美格鲁肽(2.4mg)组的HbA1c水平变化分别为-1.80%和-1.68%,体重变化则分别为-12.9%和-9.2%。
(3)辉瑞公布超长效GLP-1减重IIb期研究数据
2月3日,辉瑞公布了旗下超长效GLP-1R激动剂 PF'3944(MET-097i)的减重IIb期VESPER-3研究结果。PF'3944 是Metsera(已被辉瑞收购)开发的一种同类首创的完全偏向、超长效GLP-1受体激动剂(GLP-1RA),具有每月注射1次的给药潜力。
该研究纳入了268例不伴2型糖尿病的肥胖或超重受试者,评估了 PF'3944 四种滴定方案对比安慰剂的减重效果和安全性。其中滴定方案包括:
① 0.4/0.8mg,每周1次(QW),3.2mg,每月1次(QM)
② 0.8mg,QW,3.2mg,QM
③ 0.4/0.8/1.2mg,QW,4.8mg,QM
④ 0.6/1.2mg,QW,4.8mg,QM。
结果显示,治疗第28周,第1组和第3组患者的体重分别较安慰剂组降低了10%和12.3%。这些数据表明,在改为每月1次用药后,患者的体重下降稳健且持续,第28周时仍未见平台期,预计到第64周之前体重仍会持续下降。在第28周期间,PF'3944 也保持了良好且有利的安全性特征,与GLP-1RA类药物的特征一致。
(4)勃林格殷格翰宣布肾病新药2期临床研究积极结果
2月4日,勃林格殷格翰(Boehringer Ingelheim)公布了一项为期12周的2期临床试验结果,该试验评估了 apecotrep(BI 764198)的疗效和安全性。
Apecotrep 是一款口服非免疫抑制性的TRPC6抑制剂,拟开发用于治疗原发性局灶节段性肾小球硬化(FSGS)。
蛋白尿是反映肾脏损伤的关键指标,相比安慰剂,接受20mg剂量 apecotrep 治疗的患者组的蛋白尿降低了40%。该研究成果已发表于《柳叶刀》,并在2025年美国肾脏病学会(ASN)肾脏周大会上报告。3期临床试验目前正在招募原发性FSGS的成人及青少年患者。
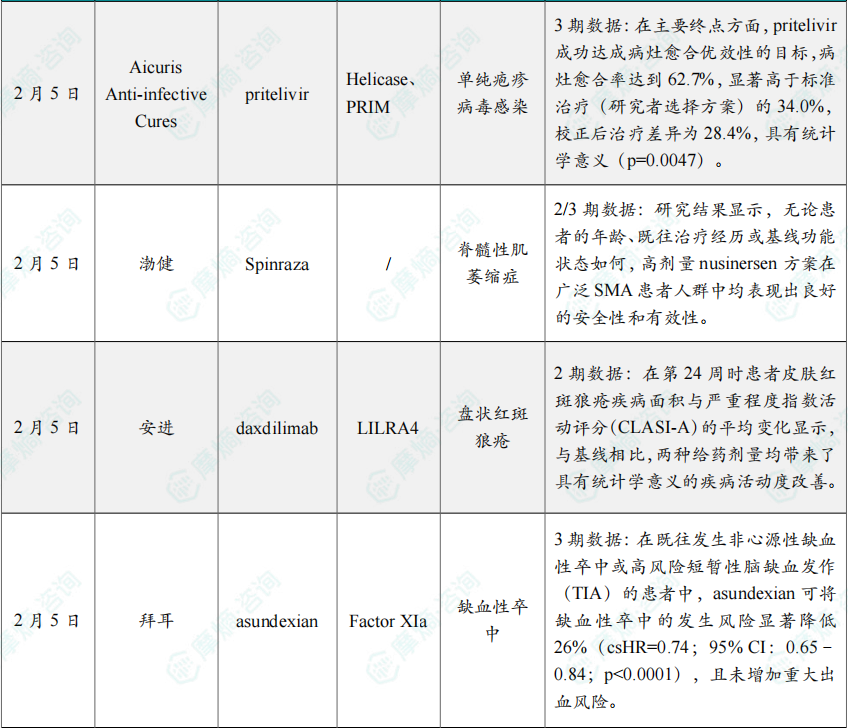
(5)Aicuris Anti-infective Cure抗病毒疗法3期试验达主要终点
2月5日,Aicuris Anti-infective Cures宣布,其关键性3期临床试验PRIOH-1取得积极结果。该研究评估了小分子抗病毒药物 pritelivir 在免疫功能低下、对治疗应答不佳的单纯疱疹病毒(HSV)感染患者中的疗效与安全性,患者可伴随或不伴随耐药性。研究结果显示,与研究者选择治疗方案(ICT)相比,pritelivir 在疗效方面表现出显著优势,同时具备良好的安全性和耐受性。
在主要终点方面,pritelivir 成功达成病灶愈合优效性的目标,病灶愈合率达到62.7%,显著高于标准治疗(研究者选择方案)的34.0%,校正后治疗差异为28.4%,具有统计学意义(p=0.0047)。同时,安全性分析显示,pritelivir 相关的治疗期间不良事件及因药物相关原因导致的停药情况均少于对照治疗,体现出有利的安全性和耐受性特征。
(6)渤健ASO疗法2/3期试验结果登Nature Medicine
2月5日,渤健(Biogen)宣布,在《自然》子刊Nature Medicine上发表2/3期DEVOTE研究结果。该研究评估了反义寡核苷酸(ASO)疗法 Spinraza(nusinersen)高剂量给药方案在脊髓性肌萎缩症(SMA)中的作用。
研究结果显示,无论患者的年龄、既往治疗经历或基线功能状态如何,高剂量 nusinersen 方案在广泛SMA患者人群中均表现出良好的安全性和有效性。目前,该疗法的高剂量给药方案已在欧盟和日本获批,同时正在接受美国FDA的审评,PDUFA日期为4月3日。
Nusinersen 是渤健开发的一款ASO药物,它通过与SMN2基因转录形成的mRNA相结合,改变RNA的剪接过程,从而增加正常SMN蛋白的表达量。因此,这一疗法可以在SMN1基因失活的SMA患者身上增加正常SMN蛋白的水平,从而维持运动神经元的生存。
(7)安进自身免疫单抗疗法2期临床积极结果公布
2月5日,安进(Amgen)宣布,其在研单抗 daxdilimab 在一项针对中重度原发性盘状红斑狼疮(DLE)成人患者的2期临床研究中获得积极结果。
分析显示,daxdilimab 达到主要终点:在第24周时患者皮肤红斑狼疮疾病面积与严重程度指数活动评分(CLASI-A)的平均变化显示,与基线相比,两种给药剂量均带来了具有统计学意义的疾病活动度改善。
此外,该研究还达成关键次要终点,在第24周时,两种剂量均在CLASI-A 50临床应答以及皮肤狼疮活动研究者总体评估(CLA-IGA)0/1方面显示出积极结果。安全性方面,daxdilimab 表现出可接受的安全性与耐受性。
Daxdilimab 是一款潜在“first-in-class”免疫球蛋白样转录物7(ILT7)靶向单抗,可选择性清除浆细胞样树突状细胞(pDC),安进通过收购Horizon Therapeutics获得该疗法。
(8)拜耳小分子asundexian治疗卒中3期研究结果积极
2月5日,拜耳(Bayer)公布了其全球关键性3期OCEANIC-STROKE研究结果,该研究评估了在抗血小板治疗基础上,其每日一次口服、在研因子XIa抑制剂 asundexian(50 mg)与安慰剂相比的疗效与安全性,该试验入组超过1.2万名受试者。
研究显示,在既往发生非心源性缺血性卒中或高风险短暂性脑缺血发作(TIA)的患者中,asundexian 可将缺血性卒中的发生风险显著降低26%(csHR=0.74;95% CI:0.65–0.84;p<0.0001),且未增加重大出血风险。该获益在不同年龄、性别、入组事件类型(卒中或高风险TIA)、卒中亚型,以及是否接受溶栓等急性治疗或采用单药/双联抗血小板二级预防策略等亚组中均保持一致。
此外,在与抗血小板治疗联合使用的情况下,asundexian 还达成了多个次要疗效复合终点,包括心血管死亡、心肌梗死或卒中的复合终点,以及全因死亡、心肌梗死或卒中的复合终点。安全性分析显示,其主要安全性终点——重大出血发生率与安慰剂相当(1.9% vs. 1.7%;HR=1.10;95% CI:0.85–1.44),预先设定的次要安全性终点中出血风险亦与安慰剂组相似,进一步支持了该方案在卒中后人群中的安全性特征。根据以上积极结果,拜耳将向监管单位递交 asundexian 的上市申请。
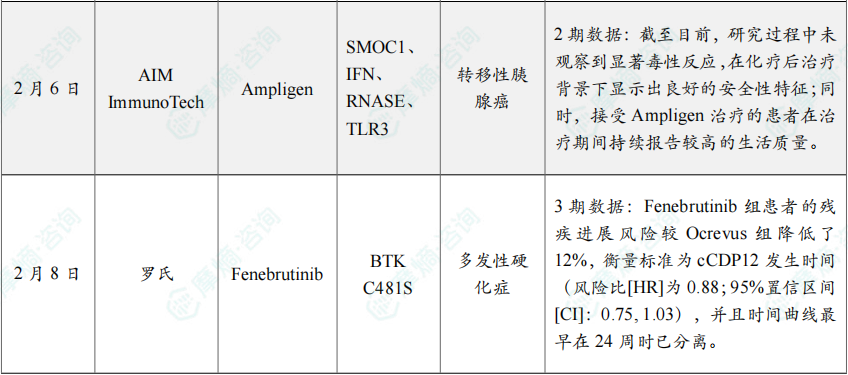
(9)AIM ImmunoTech公布胰腺癌药物Ampligen 2期积极数据
2月6日,AIM ImmunoTech在最新的年度更新中披露,其正在进行的2期临床研究DURIPANC取得积极数据。该研究评估了该公司旗下药物 Ampligen(rintatolimod)联合PD-L1抑制剂 Imfinzi(durvalumab),用于治疗在接受FOLFIRINOX标准治疗后病情稳定的转移性胰腺癌患者。
DURIPANC研究是在此前一项包含57例受试者的早期使用项目(EAP)基础上开展的2期随访研究。在该EAP中,Ampligen 作为单药用于晚期胰腺癌治疗,与标准治疗相比,将患者的中位总生存期平均延长8.6个月,延长至19.7个月,同时患者还报告生活质量有所改善。
DURIPANC研究为研究者发起的探索性、开放标签、单中心2期临床试验,计划最多入组25例受试者,目前已完成18例入组。该研究的次要及探索性终点包括总生存期(OS)和无进展生存期(PFS)的评估,并通过可获得的组织活检及外周免疫分析探索免疫学变化,同时评估患者生活质量。
截至目前,研究过程中未观察到显著毒性反应,在化疗后治疗背景下显示出良好的安全性特征;同时,接受 Ampligen 治疗的患者在治疗期间持续报告较高的生活质量。
(10)罗氏公布BTK抑制剂对比奥瑞利珠单抗III期研究数据
2月8日,罗氏公布了 Fenebrutinib 对比 Ocrevus(奥瑞利珠单抗)治疗原发性进行型多发性硬化症(PPMS)的III期FENtrepid研究的最新数据。该研究在2025年11月达到主要终点。
Fenebrutinib 是罗氏开发的一款具有中枢神经系统(CNS)渗透性的可逆且非共价BTK C481S抑制剂,对BTK的选择性是其他激酶的130倍。
Fenebrutinib 是B细胞和小胶质细胞活化的抑制剂,这种双重抑制可能能够减少多发性硬化症的活动和残疾进展,从而有可能解决多发性硬化症患者残疾进展这一未满足的关键医疗需求,并提供全面的多发性硬化症护理。
FENtrepid研究是一项多中心、随机、双盲、双模拟、平行组III期临床试验(n=985),评估了 Fenebrutinib(每日2次或每日1次)对比 Ocrevus(奥瑞利珠单抗)和安慰剂治PPMS成人患者的有效性和安全性。
结果显示,Fenebrutinib 组患者的残疾进展风险较 Ocrevus 组降低了12%,衡量标准为cCDP12发生时间(风险比[HR]为0.88;95%置信区间[CI]:0.75, 1.03),并且时间曲线最早在24周时已分离。在患者亚组及整个治疗期间,cCDP12指标均观察到一致的治疗效果。
此外,事后分析显示,Fenebrutinib 在EDSS和9HPT的综合终点上优于 Ocrevus,风险降低了22%(HR=0.78;95% CI:0.64, 0.95)。
同期事件:
1. 2026年第6周02.02-02.08国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2026年第6周02.02-02.08国内仿制药/生物类似物申报/审批数据分析
3. 2026年第6周02.02-02.08国内医药大健康行业政策法规汇总
以上内容均来自{ 摩熵咨询医药行业观察周报(2026.02.02-2026.02.08) },如需查看或下载完整版报告,可点击!
扩展阅读:
1. 2024年第24周06.10-06.16全球创新药研发概览
2. 2024年第23周06.03-06.09全球创新药研发概览
3. 2024年第21周05.20-05.26全球创新药研发概览
查数据,找摩熵!想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!
























































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论