1.4.1 本周全球TOP10创新药研发进展
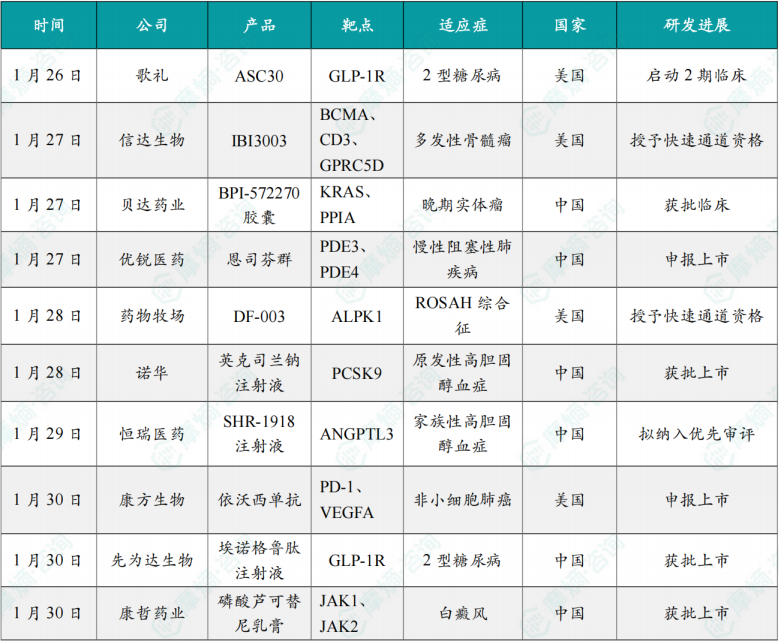
(1)歌礼小分子GLP-1R激动剂启动美国临床2期研究,治疗糖尿病
1月26日,歌礼宣布,其口服小分子GLP-1受体(GLP-1R)激动剂 ASC30 治疗2型糖尿病的美国13周2期研究(NCT07321678)已完成首批受试者给药。预计将于2026年第三季度获得该项2期研究的顶线数据。由歌礼自主研发的 ASC30 是一款正在临床研究中的、既可每日一次口服也可每月一次至每季度一次皮下注射的小分子GLP-1R完全偏向激动剂,拟开发用于肥胖症、糖尿病及其它代谢疾病的治疗。
ASC30 治疗糖尿病的美国2期研究是一项为期13周、随机、双盲、安慰剂对照及多中心的研究,旨在评估 ASC30片 在2型糖尿病受试者中的疗效、安全性和耐受性。该2期研究的主要终点是至13周时,治疗组与安慰剂组相比,糖化血红蛋白(HbA1c)相对基线的平均变化。次要终点包括:至13周时,治疗组与安慰剂组相比,空腹血糖相对基线的平均变化;至13周时,治疗组与安慰剂组相比,体重相对基线的平均变化;以及安全性和耐受性。
(2)信达生物三抗癌症新药获美国FDA快速通道资格
1月27日,信达生物宣布,其抗GPRC5D/BCMA/CD3三特异性抗体 IBI3003 获得美国FDA授予快速通道资格,拟定适应症为接受过含一种蛋白酶体抑制剂(Pl)、一种免疫调节药物(IMiD)及一种抗CD38单抗的至少四线治疗的复发或难治性多发性骨髓瘤(R/R MM)。
IBI3003 是一种靶向G蛋白偶联受体C5D(GPRC5D)、B细胞成熟抗原(BCMA)和CD3的新型三特异性抗体。目前,信达生物正同时在中国和澳大利亚开展该药1/2期临床研究(NCT06083207),探索 IBI3003 在R/R MM受试者中的安全性、耐受性和疗效。
2025年12月,IBI3003 获得美国FDA的IND批准,即将在美国开展1/2期临床研究。
(3)贝达药业泛RAS抑制剂癌症新药获批临床
1月27日,贝达药业宣布其全资子公司景曜生物申报的 BPI-572270胶囊 药物临床试验申请已获得中国国家药监局(NMPA)批准。本品拟用于晚期实体瘤(包括非小细胞肺癌、胰腺癌、结直肠癌等)患者的治疗。
BPI-572270 是由贝达药业自主研发的新分子实体化合物,是一种新型强效的泛RAS“非降解型分子胶”抑制剂。
据贝达药业新闻稿表示,BPI-572270 通过结合细胞中Cyclophilin A蛋白和激活状态的RAS突变蛋白(即RAS(ON)蛋白)形成“三元复合物”,抑制肿瘤细胞中RAS(ON)突变蛋白与下游信号蛋白结合,进而有效抑制RAS驱动信号通路的激活,达到抑制肿瘤生长的目的。
(4)优锐医药慢阻肺新药在中国申报上市
1月27日,优锐医药(Nuance Pharma)宣布,中国国家药品监督管理局(NMPA)已正式受理 恩司芬群(ensifentrine)用于维持治疗慢性阻塞性肺疾病(COPD)患者的新药上市申请(NDA),并启动审评。
恩司芬群 是一款磷酸二酯酶3和4双靶点抑制剂(PDE3和PDE4),凭借单个化合物同时实现支气管扩张以及抗炎作用,可通过普通雾化器直接递送到肺部。
2025年2月,恩司芬群 在中国澳门地区获批,并于2025年11月通过"港澳药械通"政策落地大湾区,可在指定医疗机构使用。
此外,恩司芬群 已于2024年11月在海南博鳌乐城先行先试区落地使用。
2021年,优锐医药与Verona Pharma签署协议,Verona Pharma授予优锐医药在大中华区临床开发及商业化 恩司芬群 的独家权利。
2025年10月,默沙东(MSD)宣布已完成对Verona Pharma的收购。
(5)药物牧场ALPK1抑制剂获FDA快速通道资格
1月28日,药物牧场宣布,美国FDA已授予其在研的ALPK1抑制剂 DF-003 快速通道资格,用于治疗ROSAH综合征。ROSAH综合征是一种罕见的常染色体显性遗传自身炎症性疾病,目前尚无获批疗法。
药物牧场是一家处于临床阶段的创新药生物科技公司,正在全力推进用于治疗罕见病ROSAH综合征的 DF-003 和用于治疗慢乙肝的 DF-006 两种潜在“first-in-class”新药的研发工作。
DF-003 是一种结构新颖的口服小分子抑制剂,已经证明能够强效且选择性地抑制ALPK1和导致ROSAH疾病的突变体ALPK1[T237M]。
临床前研究表明,DF-003 可穿过血-视网膜屏障和血-脑屏障,并在ROSAH综合征小鼠模型中显著抑制炎症细胞因子和疾病相关表型。这些发现支持将 DF-003 推进到临床开发阶段。
(6)诺华siRNA疗法英克司兰钠注射液获批新适应症
1月28日,诺华宣布其全球首创小干扰RNA降胆固醇药物 乐可为®(英克司兰钠注射液)获中国国家药品监督管理局(NMPA)批准,作为饮食的辅助疗法,单药用于成人原发性高胆固醇血症(非家族性)或混合型血脂异常的患者,以降低低密度脂蛋白胆固醇(LDL-C)。这意味着 英克司兰 在此前已获批的与他汀类药物、或者与他汀类药物及其他降脂疗法联合用药适应症的基础上,进一步覆盖了更多有需要的血脂异常患者。
作为全球首款也是目前唯一获批的一款靶向PCSK9的小干扰RNA降胆固醇药物,英克司兰 一年两针的给药方式,有望提升治疗依从性及LDL-C的长期达标率,助力实现血脂的长期规范化管理。
(7)恒瑞医药降脂新药拟纳入优先审评
1月29日,CDE网站显示,恒瑞医药旗下子公司盛迪医药的降脂新药 SHR-1918注射液 拟纳入优先审评,用于治疗成人和12岁及以上的未成年人纯合子型家族性高胆固醇血症(HoFH)患者。
SHR-1918 是恒瑞医药旗下子公司盛迪医药自主研发的一款ANGPTL3单抗,通过抑制ANGPTL3的活性来降低血清中的甘油三酯(TG)水平和低密度脂蛋白胆固醇(LDL-C)水平。LDL-C和TG是动脉粥样硬化性心血管疾病发生发展的重要风险因素。ANGPTL3在调节脂质代谢中扮演着重要角色,能够通过抑制脂蛋白酶和内皮脂肪酶,减少TG和LDL-C的清除。
鉴于 SHR-1918 对罕见血脂异常疾病的治疗潜力,该药物已在2024年9月被CDE授予针对HoFH的突破性疗法资格。
(8)康方生物依沃西单抗在美国申报上市,治疗肺癌
1月30 日,康方生物宣布,其PD-1/VEGF双抗 依沃西 的合作伙伴Summit Therapeutics宣布,美国FDA已受理 依沃西 联合化疗治疗第三代EGFR-TKI治疗进展的EGFR突变的非鳞状非小细胞肺癌(NSCLC)的生物制品许可申请(BLA)。
根据新闻稿,这是 依沃西 在国际范围内申请上市的首个适应症。FDA给出的PDUFA日期为2026年11月14日。依沃西 此次BLA提交是基于依沃西全球多中心3期临床HARMONi研究总体数据。针对EGFR-TKI耐药的nsq-NSCLC,依沃西 HARMONi研究在无进展生存期(PFS)和总生存期(OS)均取得了具有明确的获益结果。而与国际多中心3期HARMONi研究相对应的在中国开展的3期HARMONi-A研究,已达到PFS和OS双阳性结果,验证了 依沃西 作为肿瘤免疫+抗血管生成机制双抗的突破性临床价值。
(9)先为达生物埃诺格鲁肽获批上市,治疗2型糖尿病
1月30日,先为达生物的 埃诺格鲁肽注射液 获得国家药品监督管理局(NMPA)批准,用于成人2型糖尿病患者的血糖控制,并成为全球首个获批上市的cAMP偏向型GLP-1受体激动剂。GLP-1 受体激动剂作为成人2型糖尿病的核心治疗药物之一,凭借分子设计的持续迭代,进而研发出以埃诺格鲁肽为代表的 “偏向型 GLP-1RA”,标志着糖尿病精准治疗的全新方向,已得到《中国糖尿病防治指南(2024版)》的权威认可。
埃诺格鲁肽注射液 是全球首个获批上市的cAMP偏向型GLP-1受体激动剂,与非偏向型的GLP-1受体激动剂不同,埃诺格鲁肽 偏向性激活cAMP信号通路,同时最小化β-arrestin的募集,这种信号偏向限制了受体的脱敏和下调,使受体更多的留存在细胞表面,并维持治疗性信号传导,偏向型的独特机制是其提升临床疗效与改善代谢获益的关键因素之一。
(10)康哲药业芦可替尼乳膏获批上市,用于治疗白癜风
1月30日,康哲药业宣布其引进的 磷酸芦可替尼乳膏 获得国家药监局批准上市,用于治疗12岁及以上儿童和成人患者伴面部受累的非节段型白癜风。
芦可替尼乳膏 为Incyte的JAK1/JAK2选择性抑制剂 芦可替尼 的创新乳膏制剂,已获得美国FDA批准用于12岁及以上非节段型白癜风患者的局部治疗。
2022年12月,康哲药业附属公司康哲美丽与Incyte就用于治疗自身免疫性炎症皮肤病的 芦可替尼乳膏制剂 订立合作和许可协议,获得该药在中国(包括香港、澳门和台湾)及东南亚十一国的开发、注册及商业化产品的独家许可权利,以及在区域内生产产品的非独家许可权利。
1.4.2 本周全球TOP10积极/失败临床结果
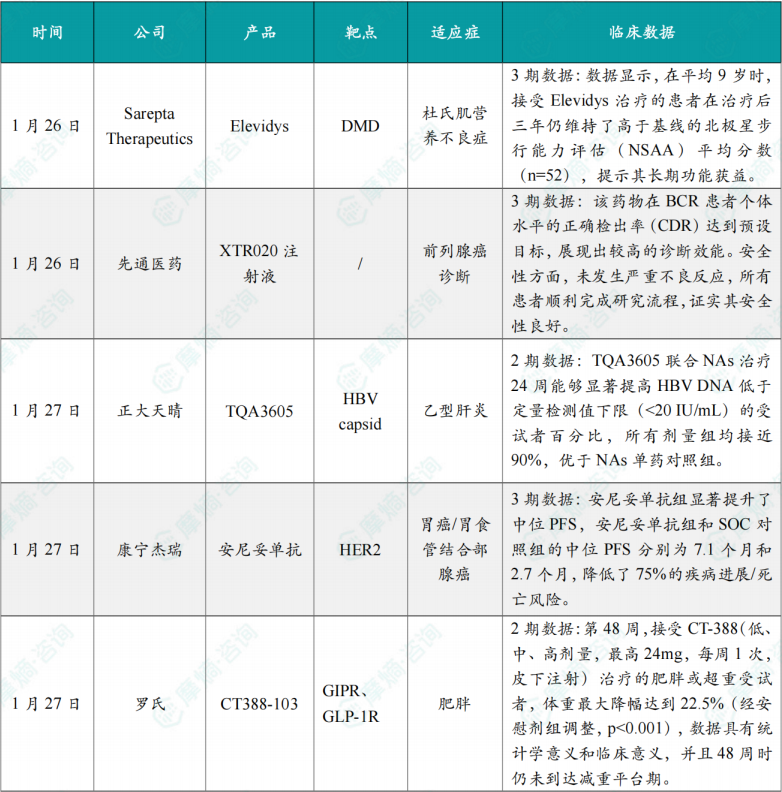
(1)Sarepta Therapeutics公布DMD基因疗法三年随访积极结果
1月26日,Sarepta Therapeutics宣布,其基因疗法 Elevidys(delandistrogene moxeparvovec)在3期临床研究EMBARK(SRP-9001-301)中获得积极的三年随访主要功能性结果。
该研究为全球随机、安慰剂对照试验,旨在评估 Elevidys 在可行走的杜氏肌营养不良症(DMD)患者中的疗效与安全性。入组患者在接受治疗时年龄为4至7岁,在最新一次评估时平均年龄已超过9岁。数据显示,在平均9岁时,接受Elevidys治疗的患者在治疗后三年仍维持了高于基线的北极星步行能力评估(NSAA)平均分数(n=52),提示其长期功能获益。
此外,与倾向评分加权的外部对照组相比,Elevidys 在起立时间(TTR)和10米步行/跑步(10MWR)指标上显示出下降速率减少70%或以上的效果。研究还指出,治疗效果随时间推移呈增强趋势,与外部对照组相比,功能改善在第2年至第3年间进一步显著扩大,显示出持续且逐步加深的临床影响。在安全性方面,三年随访未观察到新的治疗相关安全信号,整体表现与此前在可行走患者中所见的可控安全性特征一致。
(2)先通医药创新核药XTR020中国3期临床试验达到主要研究终点
1月26日,先通医药宣布,公司用于诊断前列腺癌的创新放射性药物 XTR020注射液(中文通用名氟[18F]妥司特注射液,英文通用名18F-Flotufolastat)中国III期临床试验成功达到主要研究终点。公司将于近期完成资料整理并向国家药品监督管理局(NMPA)提交新药上市申请(NDA)。
本研究是一项在国内进行的单臂、多中心III期临床试验,共纳入121例受试者,旨在评估 XTR020注射液 PET成像在既往治疗后前列腺癌生化复发(BCR)的受试者中的诊断效能和安全性。结果显示,该药物在BCR患者个体水平的正确检出率(CDR)达到预设目标,展现出较高的诊断效能。安全性方面,未发生严重不良反应,所有患者顺利完成研究流程,证实其安全性良好。
(3)正大天晴慢性乙肝1类新药2期临床达主要终点
1月27日,正大天晴宣布,其针对慢性乙型肝炎病毒(HBV)感染的口服1类新药——核心蛋白变构调节剂 TQA3605 在2期临床研究中达到主要研究终点。TQA3605 所有剂量组联合核苷(酸)类药物(NAs)治疗24周后,HBV DNA低于定量检测值下限(20 IU/mL)的受试者均接近90%,显示出其在低病毒血症人群中进一步抑制病毒复制的能力。
本次达到主要研究终点的是一项随机、双盲、安慰剂对照、多中心2期研究,旨在评价 TQA3605 联合 NAs 在经治的低病毒血症的慢性HBV感染受试者中的有效性和安全性。本研究最终入组122例已接受 NAs 治疗至少12个月的慢性HBV感染者,在维持既往 NAs 治疗的基础上,随机分配加用安慰剂或 TQA3605 ,采用每日一次口服的给药方式。
研究结果显示,TQA3605 联合 NAs 治疗24周能够显著提高HBV DNA低于定量检测值下限(<20 IU/mL)的受试者百分比,所有剂量组均接近90%,优于NAs单药对照组。安全性方面,加用 TQA3605 的试验组总体不良反应发生率与 NAs 单药对照组相当,且大部分治疗期间出现的不良事件(TEAE)为1-2级。
(4)康宁杰瑞HER2双抗治疗胃癌3期临床结果发布
1月27日,康宁杰瑞宣布,其自主研发、与石药集团全资附属公司上海津曼特生物科技有限公司合作开发的 安尼妥单抗(KN026)针对HER2阳性胃癌/胃食管结合部腺癌患者的3期临床研究结果,近日成功发表于肿瘤学领域期刊《肿瘤学年鉴》(Annals of Oncology,IF:65.4)。
安尼妥单抗注射液 是康宁杰瑞采用Fc异二聚体平台技术(CRIB)开发的HER2双特异性抗体,可同时结合HER2的两个非重叠表位,阻断HER2信号。通过抗体诱导的受体聚集,增强ADCC和CDC效应,同时下调细胞表面HER2受体。
研究结果显示(截至2025年4月3日):
无进展生存期显著提升:安尼妥单抗 组显著提升了中位PFS,安尼妥单抗 组和SOC对照组的中位PFS分别为7.1个月和2.7个月,降低了75%的疾病进展/死亡风险。
生存获益具有临床意义:安尼妥单抗 组在二线HER2阳性胃癌患者中总生存期首次接近20个月。两组中位OS分别为19.6个月和11.5个月,降低了71%的死亡风险。
在安全性上,安尼妥单抗 组表现出良好的耐受性,安尼妥单抗组和SOC对照组的治疗期间不良事件(TEAE)发生率相同(97%),在 安尼妥单抗 组中位治疗周期明显高于对照组的前提下(6.5个周期 vs 3.0个周期),3级及以上TEAE的发生率仅略高于对照组(61% vs 52%),且两组严重不良事件(SAE)和心脏毒性的发生率相当,安尼妥单抗 组也未发生导致死亡的与药物相关的不良事件(TRAE)。
(5)罗氏GLP-1R/GIPR激动剂减重2期研究取得积极结果
1月27日,罗氏宣布 CT-388(RO7795068)的减重II期CT388-103研究取得了积极结果。
CT-388 是Carmot Therapeutics开发的一款多肽GLP-1R/GIPR激动剂。2023年12月,罗氏出手31亿美元收购Carmot Therapeutics,获得了该公司旗下的多款肠促胰岛素药物。
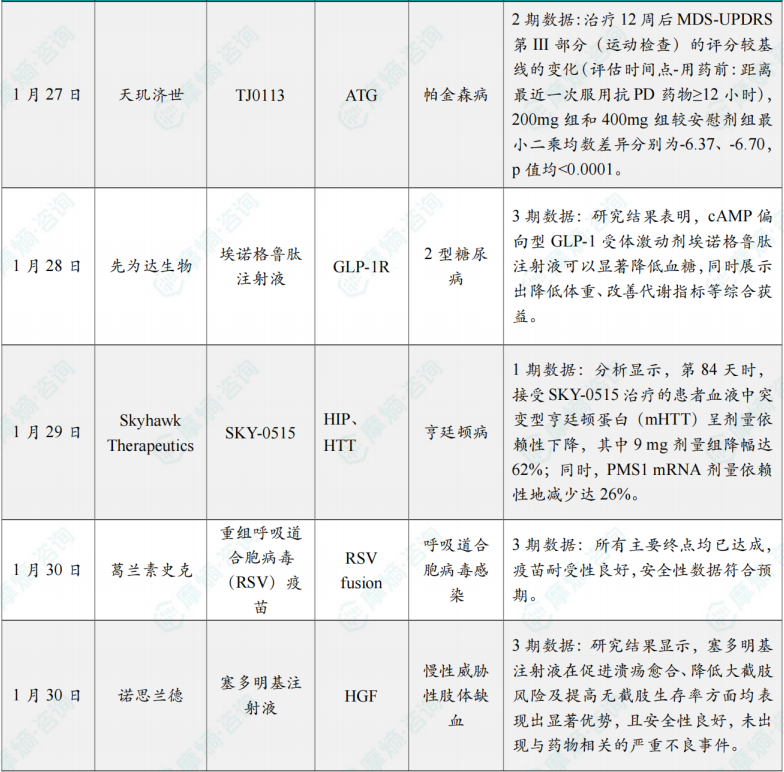
研究结果显示,CT-388 呈现出明显的剂量-反应关系。从治疗效果角度(所有受试者坚持治疗)评估时,第48周,接受 CT-388(低、中、高剂量,最高24mg,每周1次,皮下注射)治疗的肥胖或超重受试者,体重最大降幅达到22.5%(经安慰剂组调整,p<0.001),数据具有统计学意义和临床意义,并且48周时仍未到达减重平台期。安全性方面,CT-388 的耐受性良好,大多数胃肠道相关不良事件为轻度至中度,且符合肠促胰岛素类药物特征。此外,因不良事件导致的治疗中止率较低( CT-388 组为5.9%,安慰剂组为1.3%)。
(6)天玑济世TJ0113帕金森病2期临床达主要终点
1月27日,杭州天玑济世生物科技有限公司宣布其核心产品 TJ0113 在治疗早期帕金森病(PD)的Ⅱ期临床研究显示:主要及次要终点均显示出统计学意义的疗效差异(p值均<0.0001) ,展现出良好的安全性和耐受性,突破神经退行性疾病治疗困局,开辟线粒体自噬治疗帕金森病的新赛道,为中国创新药再添重磅成果。
该研究为一项随机、双盲、安慰剂对照Ⅱ期临床试验,旨在评估 TJ0113 治疗早期帕金森病患者的有效性和安全性(CTR20243324,NCT06596005)。
主要疗效指标:治疗12周后MDS-UPDRS 第III部分(运动检查)的评分较基线的变化(评估时间点-用药前:距离最近一次服用抗PD药物≥12小时),200mg组和400mg组较安慰剂组最小二乘均数差异分别为-6.37、-6.70,p值均<0.0001。
次要疗效指标:治疗12周后MDS-UPDRS 第III部分(运动检查)的评分较基线的变化(评估时间点-用药后:距离最近一次服用抗PD药物±2小时),200mg组和400mg组较安慰剂组最小二乘均数差异分别为-5.26、-5.85,p值均<0.0001。
在安全性方面,TJ0113胶囊 200mg、400mg剂量下,总体TEAE发生率与安慰剂组基本相近(50.0% vs 58.3% vs 49.0%),大多数AE的严重程度为1级或2级,未发生与药物相关的严重不良事件,且所有患者停药后均未发生撤药反应,整体安全性和耐受性良好。
(7)先为达生物GLP-1受体激动剂3期临床结果发表于《自然-通讯》
1月28日,先为达生物宣布其研发的 埃诺格鲁肽注射液,其单药治疗2型糖尿病的3期临床研究(EECOH-1)成果,成功登上国际知名期刊《自然-通讯》(Nature Communications)。该研究在饮食运动干预后血糖控制不佳的成人2型糖尿病患者中进行,研究结果表明,cAMP偏向型GLP-1受体激动剂 埃诺格鲁肽注射液 可以显著降低血糖,同时展示出降低体重、改善代谢指标等综合获益。
埃诺格鲁肽注射液(ecnoglutide injection,曾用名:伊诺格鲁肽)是由先为达生物自主研发的cAMP偏向型GLP-1受体激动剂,依托创新的药物设计,其临床疗效及产能可扩展性得到显著提升。
埃诺格鲁肽 已成功完成三项3期临床试验,用于成人2型糖尿病患者血糖控制及成人超重/肥胖患者长期体重管理的两项适应症已在中国提交上市申请并获受理。埃诺格鲁肽注射液 在1期到3期临床试验中均展现出良好的安全性和显著的药效学和疗效特征,研究结果均已发表于代谢领域国际期刊,彰显出其在代谢性疾病治疗领域的潜力。
(8)Skyhawk Therapeutics公布在研药物SKY-0515 1期临床中期积极结果
1月29日,Skyhawk Therapeutics公司宣布,其在研药物 SKY-0515 用于治疗亨廷顿病的1期临床试验取得积极中期结果。
SKY-0515 是一款口服小分子RNA剪接调节剂,基于公司自研的RNA剪接平台SKYSTAR开发,旨在同时降低亨廷顿蛋白(HTT)与PMS1蛋白水平,其中PMS1被认为是体细胞CAG重复扩增及HD病理过程中的重要驱动因素之一。
分析显示,第84天时,接受 SKY-0515 治疗的患者血液中突变型亨廷顿蛋白(mHTT)呈剂量依赖性下降,其中9mg剂量组降幅达62%;同时,PMS1 mRNA剂量依赖性地减少达26%。
此外,SKY-0515 在中枢神经系统中分布良好,且总体安全性、耐受性良好。接受 SKY-0515 治疗的C部分患者队列在3、6和9个月时,复合统一亨廷顿病评定量表(cUHDRS)均较基线有所改善。至9个月时,汇总分析显示患者cUHDRS平均提升+0.64分,而根据Enroll-HD和TRACK-HD的倾向评分加权,同期未经治疗的症状性HD患者通常会恶化至−0.73分。
(9)葛兰素史克公布重组呼吸道合胞病毒(RSV)疫苗3期试验积极结果
1月30日,葛兰素史克宣布,其重组呼吸道合胞病毒(RSV)疫苗在中国针对60岁及以上成人进行的免疫原性和安全性评估的三期试验(NCT06551181)中取得了积极的主要结果。所有主要终点均已达成,疫苗耐受性良好,安全性数据符合预期。
这些结果将支持提交此疫苗在中国该人群中的上市申请。如果获得批准,预计GSK的 RSV疫苗 将成为中国国家药品监督管理局批准的首个用于60岁及以上的成人预防由RSV引发的下呼吸道疾病(LRTD)的疫苗。
(10)塞多明基注射液3期临床研究成果亮相国际顶级学术舞台
1月30日,北京协和医院血管外科狄潇教授代表研究团队在莱比锡血管介入治疗大会(LINC 2026)上正式发布了诺思兰德自主研发的基因治疗创新药“塞多明基注射液”用于治疗下肢慢性威胁性肢体缺血(CLTI)的Ⅲ期临床试验(HOPE CLTI-2研究)关键数据。这是中国原研基因药物首次在LINC这一国际顶尖学术平台上展示大规模临床研究成果。
该项目Ⅲ期临床试验在中国23家大型血管外科中心开展,采用多中心、随机、双盲、安慰剂对照,共纳入242例溃疡患者。研究结果显示,塞多明基注射液 在促进溃疡愈合、降低大截肢风险及提高无截肢生存率方面均表现出显著优势,且安全性良好,未出现与药物相关的严重不良事件。
该研究结果为CLTI患者提供了除手术和介入治疗之外的新型治疗选择,尤其为那些以往缺乏有效治疗手段的“no option”患者带来了新的希望。目前,该药物正处于新药注册审评的最后阶段。公司正稳步推进上市前各项准备工作。
同期事件:
1. 2026年第5周01.26-02.01国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2026年第5周01.26-02.01国内仿制药/生物类似物申报/审批数据分析
3. 2026年第5周01.26-02.01国内医药大健康行业政策法规汇总
以上内容均来自{ 摩熵咨询医药行业观察周报(2026.01.26-2026.02.01) },如需查看或下载完整版报告,可点击!
扩展阅读:
1. 2024年第30周07.22-07.28全球创新药研发概览
2. 2024年第25周06.17-06.23全球创新药研发概览
3. 2024年第16周04.08-04.14全球创新药研发概览
查数据,找摩熵!想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!





















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论