1.4.1 本周全球TOP10创新药研发进展
(1)科济药业提交通用型BCMA CAR-T产品两项IND申请
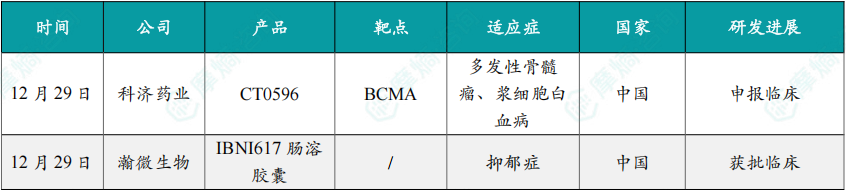
12月29日,科济药业宣布已向中国国家药品监督管理局(NMPA)提交通用型BCMA CAR-T产品 CT0596 的两项新药临床试验(IND)申请,以分别启动治疗复发/难治性多发性骨髓瘤(R/R MM)及原发性浆细胞白血病(pPCL)的1b/2期临床试验。
CT0596 是一款靶向BCMA的通用型CAR-T细胞疗法,基于科济药业自主研发的THANK-u Plus®平台开发,通过敲除NKG2A、TRAC及B2M基因,降低移植物抗宿主病(GvHD)及宿主免疫排斥风险,并辅以额外基因编辑,进一步阻断宿主NK细胞介导的排斥反应,从而提升产品的疗效和安全性。
CT0596 已在中国开展研究者发起的临床试验(IIT),探索其治疗R/R MM及pPCL的临床潜力。在2025年ASH年会发表的首次人体研究中,CT0596 展现出良好的安全性及令人鼓舞的疗效信号。
(2)瀚微生物抗抑郁症1类新药获批临床
12月29日,瀚微生物宣布,公司自主研发的创新型活菌药物 IBNI617肠溶胶囊 的临床试验申请已正式获得中国NMPA药品审评中心(CDE)批准,针对适应症为抑郁症。这是一款基于肠-脑轴的作用机制治疗抑郁症的活菌新药,此前已获美国FDA临床试验许可。
IBNI617肠溶胶囊 依托“活菌肠道定植和代谢产物调控”的独特微生态作用机制,通过释放可以干预神经系统情绪中枢的活性分子治疗抑郁症,直击现有部分抗抑郁药物起效慢、副作用大等临床痛点,提出新的治疗理念,旨在为广大抑郁症患者提供更安全、更具优势、更可持续的治疗新选择。
IBNI617 在前期非临床研究中具有良好的抗抑郁效果和较高的安全性,预期将为抑郁患者焦虑抑郁情绪、睡眠障碍等带来积极的影响。
(3)康宁杰瑞HER2双抗ADC皮下注射复方制剂2期临床试验申请获受理
12月29日,康宁杰瑞宣布,公司自主研发的HER2双特异性抗体偶联药物(ADC)与PD-L1免疫检查点抑制剂的高浓度皮下注射复方制剂 JSKN033 ,一项联合铂类化疗(联合或不联合贝伐珠单抗)用于一线治疗晚期宫颈癌的2期临床试验(研究编号:JSKN033-202)申请已获中国国家药品监督管理局(NMPA)药品审评中心(CDE)受理。
JSKN033 为由ADC(JSKN003)和PD-L1(恩沃利单抗)组成的高浓度皮下注射复方制剂。JSKN003 通过将 安尼妥单抗(KN026)Fc上糖基定点偶联获得DAR4的均一稳定的ADC,能够结合肿瘤细胞HER2的两个表位,通过增强细胞内吞释放拓扑异构酶Ⅰ抑制剂,发挥肿瘤杀伤作用。
恩沃利单抗 是由人源化PD-L1单域抗体和人IgG1 Fc片段组成的Fc融合蛋白,已于2021年11月在中国获批上市,为皮下注射PD-(L)1抑制剂。
(4)和黄医药1类新药申报上市并获纳入优先审评,治疗肝癌
12月29日,和黄医药宣布 凡瑞格拉替尼(fanregratinib,HMPL-453)用于既往接受过系统性治疗,且具有成纤维细胞生长因子受体(FGFR)2融合或重排的晚期、转移性或不可手术切除的肝内胆管癌(ICC)成人患者的新药上市申请已获中国国家药品监督管理局(NMPA)受理,并获纳入优先审评。
肝内胆管癌是一种起源于肝内胆管上皮的具有高度侵袭性的恶性肿瘤,占原发性肝癌的约8.2%至15.0%,是继肝细胞癌之后第二常见的肝癌类型。
凡瑞格拉替尼(HMPL-453)是一种新型、高选择性且强效的FGFR 1、2和3抑制剂。和黄医药目前拥有凡瑞格拉替尼在全球范围内的所有权利。
(5)智翔金泰BCMA/CD3双抗拟纳入优先审评
12月29日,CDE网站显示,智翔金泰的双抗药物 GR1803(纬利妥米单抗,velinotamig)拟纳入优先审评,用于治疗既往至少接受过三线治疗(包括一种蛋白酶体抑制剂、一种免疫调节剂和一种抗CD38单克隆抗体)的复发或难治性多发性骨髓瘤(R/R MM)成人患者。
GR1803 是智翔金泰自主研发的一款BCMA/CD3双抗药物,其结合BCMA的亲和力(10-10M)较结合CD3的亲和力(10-8M)高两个数量级。这种非对称的亲和力设计在保证此双特异性抗体分子募集并激活T细胞杀伤肿瘤细胞的同时,可以有效减少因CD3抗体导致的T细胞非特异性激活,从而降低 GR1803注射液 在体内的毒副作用。
(6)礼来重磅产品匹妥布替尼片新适应症在国内报上市
12月29日,CDE官网显示,礼来的 匹妥布替尼片 新适应症上市申请获受理。根据临床试验进展,推测适应症为:初治慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)。
2023年1月,匹妥布替尼率先在美国获批上市,目前已斩获多项适应症,分别为复发或难治性套细胞淋巴瘤(MCL)三线治疗、复发或难治性CLL/SLL二线和三线治疗。
匹妥布替尼是一款高选择性、非共价(可逆)BTK抑制剂,最初由Redx Pharma 研发,2017年7月被Loxo Oncology买入。2019年1月,礼来80亿美元收购Loxo Oncology,获得了该产品。2024年12月,信达生物引进了匹妥布替尼在中国大陆的进口、销售、推广和分销权益。
(7)迈威生物抗IL-11单抗开启病理性瘢痕2期临床研究
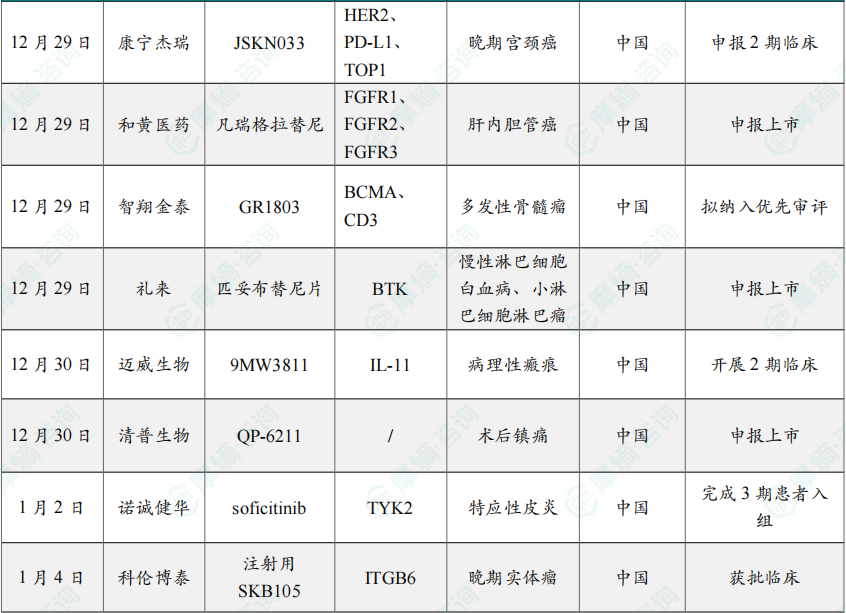
12月30日,迈威生物宣布其自主研发的抗IL-11单抗创新药(研发代号:9MW3811)针对病理性瘢痕的2期临床试验于近日完成首例患者给药。
该项2期临床试验(CTR20254857)旨在评价 9MW3811 在病理性瘢痕患者中的安全性、耐受性、药代动力学特征及初步有效性。此前,9MW3811 已完成澳洲及中国1期健康人试验,结果显示其安全性良好、半衰期超过一个月。
白介素-11(IL-11)是一种在慢性炎症和纤维化相关疾病中发挥关键作用的细胞因子,广泛参与多个器官的纤维化进程。临床前研究表明,9MW3811 在肺纤维化等多种模型中展现出显著疗效,并在瘢痕增生、子宫内膜异常出血等纤维化相关疾病中显示出潜在应用价值。
(8)清普生物长效镇痛新药申报上市
12月30日,清普生物宣布其自主研发的长效镇痛新药 QP-6211 的上市申请已获CDE正式受理,拟用于成人术后镇痛。
QP-6211 是清普生物非阿片类镇痛新药管线的第三款长效产品,基于清普自主知识产权的系列缓释注射剂平台开发,用于术后镇痛或各种顽固性疼痛。
相比全球已上市同靶点长效药物,QP-6211 具有更长的药效持续时间、更低的注射风险(如心脏和CNS毒性更低)、更强的痛觉神经选择性。
临床结果显示,在痔切除手术及单侧拇外翻矫形手术的受试者中,单次给予 QP-6211 可在术后早期提供有效镇痛,镇痛效果可持续达72小时,且其镇痛作用显著优于阳性对照组与安慰剂组,总体安全性良好、可控,适用于成人术后镇痛。
(9)诺诚健华TYK2抑制剂治疗特应性皮炎3期注册临床研究完成患者入组
1月2日,诺诚健华宣布,该公司自主研发的新型TYK2抑制剂 soficitinib(ICP-332)的临床研究获得重大进展,治疗中重度特应性皮炎(AD)的3期注册临床试验已完成患者入组。与此同时,soficitinib 治疗白癜风的2期临床试验也已经完成患者入组。这两项临床试验均为随机、双盲、安慰剂对照,soficitinib 治疗中重度特应性皮炎的3期注册临床试验共入组579例患者,治疗型白癜风的2期临床试验共入组162例患者。
Soficitinib 是诺诚健华自主研发的高效、高选择性的新型口服TYK2抑制剂,用于开发治疗多种T细胞相关的自身免疫性疾病,目前开发的适应症包括特应性皮炎、白癜风、结节性痒疹、荨麻疹、银屑病等。
(10)科伦博泰ITGB6靶向ADC癌症新药在中国获批临床
1月4日,中国国家药监局药品审评中心(CDE)官网最新公示,科伦博泰申报的1类新药 注射用SKB105 获批临床,拟开发治疗晚期实体瘤。公开资料显示,这是一款靶向整合素β6(ITGB6)的抗体偶联药物(ADC)。
2025年12月,科伦博泰与Crescent Biopharma达成合作,共同开发和商业化肿瘤治疗手段,其中就包括了这款 SKB105 。
SKB105 是一款靶向ITGB6的差异化ADC,其有效载荷为拓扑异构酶Ⅰ抑制剂。ITGB6在多种实体瘤中高表达,但在大多数正常组织中低表达或无表达,因此有降低系统毒性及脱靶风险的潜力。
临床前研究显示,SKB105 在疗效、安全性和药代动力学(PK)特征方面均表现出良好特性。一项 SKB105 针对实体瘤患者的1/2期临床试验预计于2026年第一季度启动。
1.4.2 本周全球TOP5积极/失败临床结果
(1)Ultragenyx和Mereo合作药物setrusumab两项3期试验失败
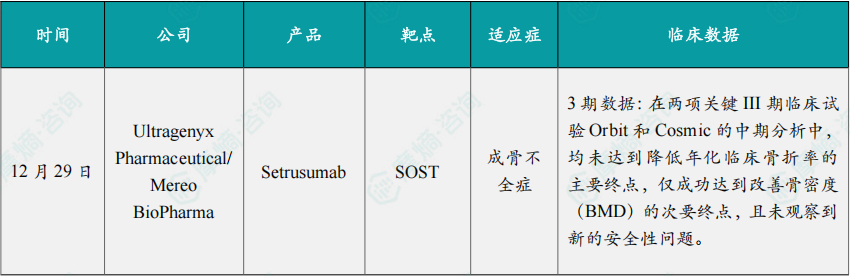
12月29日,Ultragenyx Pharmaceutical与Mereo BioPharma联合宣布,其合作开发的成骨不全症(OI)潜在疗法 Setrusumab(UX143),在两项关键III期临床试验Orbit和Cosmic的中期分析中,均未达到降低年化临床骨折率的主要终点,仅成功达到改善骨密度(BMD)的次要终点,且未观察到新的安全性问题。
Setrusumab 是一种全人源单克隆抗体,曾被视为治疗成骨不全症的潜在突破性疗法。其作用机制是通过Wnt/β-catenin通路抑制骨形成负调节因子硬化蛋白(sclerostin),从而促进患者新骨形成、提升骨矿物质密度与骨强度。
此前,该药已获得美国FDA授予的突破性疗法资格认定(BTD)、儿科罕见疾病资格认定(RPDD)和快速通道资格认定(FTD),II期临床数据曾显示骨折率降低高达67%,小鼠模型也证实了其使骨强度正常化的潜力。
(2)Immutep公司公布IMP761 1期临床积极进展
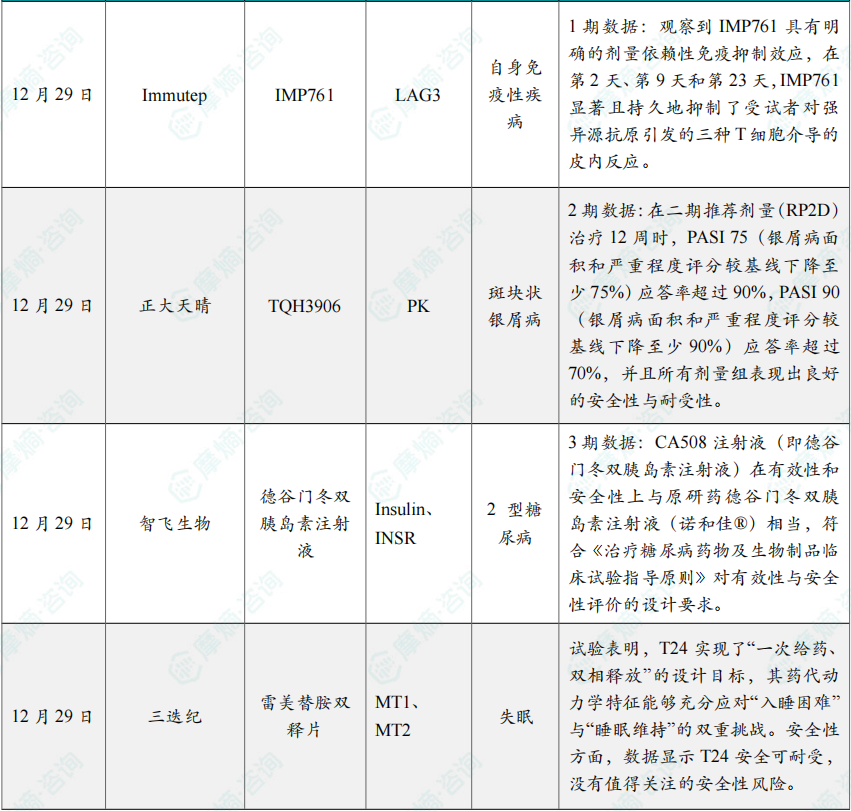
12月29日,Immutep公司宣布,其在健康受试者中开展的首个人体、安慰剂对照、双盲1期临床试验取得积极进展,该试验旨在评估 IMP761——一种潜在“first-in-class”的LAG-3激动型抗体,用于治疗自身免疫性疾病。IMP761 通过特异性沉默聚集在病灶部位的自身免疫记忆T细胞,有望从根源上干预多种自身免疫疾病,并恢复免疫系统平衡。
该研究的单次递增剂量部分已顺利完成2.5 mg/kg和7 mg/kg两个剂量组的给药。IMP761 展现出良好的安全性,未出现超出轻度的治疗相关不良反应。同时,观察到 IMP761 具有明确的剂量依赖性免疫抑制效应,在第2天、第9天和第23天,IMP761 显著且持久地抑制了受试者对强异源抗原引发的三种T细胞介导的皮内反应。T细胞活性的显著降低凸显了 IMP761 在治疗自身免疫疾病中的潜在疗效。
(3)中国生物制药TQH3906 2期临床达到研究主要终点,用于治疗斑块状银屑病
12月29日,中国生物制药(1177.HK)宣布,正大天晴自主研发的1类创新药 TQH3906(TYK2/JAK1 JH2变构抑制剂)用于中重度斑块状银屑病(PsO)的二期临床试验,达到主要研究终点。
研究结果显示,在二期推荐剂量(RP2D)治疗12周时,PASI 75(银屑病面积和严重程度评分较基线下降至少75%)应答率超过90%,PASI 90(银屑病面积和严重程度评分较基线下降至少90%)应答率超过70%,并且所有剂量组表现出良好的安全性与耐受性。
TQH3906 通过靶向TYK2/JAK1的假激酶域(JH2)发挥作用,相较于既往靶向活性激酶域(JH1)的JAK抑制剂,可以有效地维持对JAK2、JAK3与其他激酶的高度选择性,从而减少对非靶标蛋白的潜在抑制作用。这种高选择性可以提高治疗效果并降低副作用,展现出重要的治疗潜力。除斑块状银屑病外,TQH3906 将继续开展包括炎症性肠病、银屑病关节炎等多个自免、皮肤领域新适应症的探索研究。
(4)智飞生物的德谷门冬双胰岛素注射液获3期临床试验总结报告
12月29日,智飞生物控股子公司重庆宸安生物自主研发的 德谷门冬双胰岛素注射液 完成Ⅲ期临床试验并取得总结报告,标志着公司在代谢类疾病领域的研发工作取得关键突破。
作为新一代基础餐时双胰岛素制剂,德谷门冬双胰岛素是长效基础胰岛素(德谷胰岛素)与速效餐时胰岛素(门冬胰岛素)组成的复方制剂,兼顾基础血糖与餐后血糖双重控制,既能保证血糖控制效果,又能显著降低低血糖发生风险。
本次Ⅲ期临床试验由北京大学人民医院等40家国内研究中心联合开展,采用多中心、随机、开放、平行对照的试验设计,聚焦既往接受基础或预混胰岛素治疗后血糖控制不佳的2型糖尿病(T2DM)患者。
临床试验总结报告显示,重庆宸安生物研发的 CA508注射液(即德谷门冬双胰岛素注射液)在有效性和安全性上与原研药德谷门冬双胰岛素注射液(诺和佳®)相当,符合《治疗糖尿病药物及生物制品临床试验指导原则》对有效性与安全性评价的设计要求。
(5)三迭纪T24雷美替胺双释片完成首项临床试验
12月29日,南京三迭纪医药科技有限公司宣布,其采用3D打印技术开发的2.2类改良型新药 T24(雷美替胺双释片)已成功完成首项临床试验(CTR20254008)。
研究结果证明了制剂具有明确的双释特征,展现了拓展规格和作用时长的潜力,验证了三迭纪3D微结构调释平台(3D Microstructure for Modified Release, 3DμS®-MR)对复杂释药行为的精准控制能力,为后续开发更贴合生理节律的失眠疗法奠定了坚实的基础。
T24 此次临床试验结果充分验证了该药物的双相释放特征。对血药浓度数据的分析显示,其血浆药-时曲线呈现出如同预期的“双峰”特征:双释片在维持了初始的快速释放的同时,经过预设的间隔后,血浆药物浓度出现了第二个峰值。
对暴露量数据的进一步分析显示,T24 的初始快速释放的速度和程度与雷美替胺速释片接近,且T24的剂量和暴露量呈现明确的线性关系。
上述数据结果成功验证了3DμS®-MR平台对复杂释药行为的精准控制。试验表明,T24 实现了“一次给药、双相释放”的设计目标,其药代动力学特征能够充分应对“入睡困难”与“睡眠维持”的双重挑战。安全性方面,数据显示T24安全可耐受,没有值得关注的安全性风险。
同期事件:
1. 2026年第1周2025.12.29-2026.01.04国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2026年第1周2025.12.29-2026.01.04国内仿制药/生物类似物申报/审批数据分析
3. 2026年第1周2025.12.29-2026.01.04国内医药大健康行业政策法规汇总
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.12.29-2026.01.04) },如需查看或下载完整版报告,可点击!
扩展阅读:
1. 2025年第1周12.30-01.05全球创新药研发概览
2. 2024年第41周10.07-10.13全球创新药研发概览
3. 2024年第32周08.05-08.11全球创新药研发概览
查数据,找摩熵!想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论