1.4.1 本周全球TOP10创新药研发进展
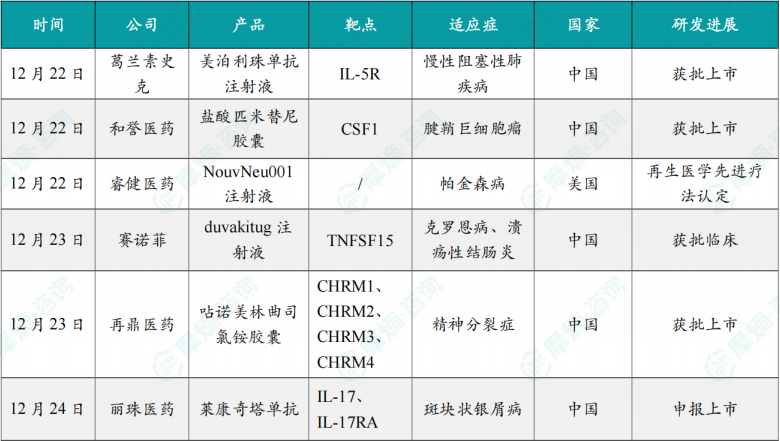
(1)GSK宣布美泊利珠单抗在中国获批治疗慢性阻塞性肺疾病
12月22日,葛兰素史克(GSK)中国宣布,中国国家药品监督管理局(NMPA)已批准 新可来®(美泊利珠单抗注射液)用于未充分控制的以血嗜酸性粒细胞升高为特征的慢性阻塞性肺疾病(COPD)成人患者的维持治疗。美泊利珠单抗注射液是每月给药一次,用于治疗血嗜酸性粒细胞计数(BEC)≥150细胞/μL的广泛COPD患者的生物制剂。
此次获批是基于3期临床试验MATINEE和METREX的积极数据。在这两项试验中,美泊利珠单抗与安慰剂加标准治疗相比,在广泛的嗜酸性粒细胞表型COPD患者中,显著降低了中重度急性加重的年发生率,具有临床意义和统计学意义。
美泊利珠单抗是一种单克隆抗体,能靶向结合白细胞介素-5 (IL-5) ,2型炎症中的一种关键信使蛋白(细胞因子)。该产品已被开发用于治疗一系列IL-5介导的与2型炎症相关的疾病。
(2)和誉医药宣布小分子新药在中国获批,治疗腱鞘巨细胞瘤
12月22日,和誉医药宣布,其自主研发的CSF-1R高选择性小分子抑制剂贝捷迈®(盐酸匹米替尼胶囊)获得中国国家药品监督管理局(NMPA)批准,适用于手术切除可能会导致功能受限或出现较严重并发症的症状性腱鞘巨细胞瘤(TGCT)成年患者。德国默克(Merck KGaA)拥有该产品在全球的商业化权益。
腱鞘巨细胞瘤是一种罕见的局部侵袭性肿瘤,主要累及关节、腱鞘及滑囊,可导致严重的局部病变和功能障碍。盐酸匹米替尼胶囊是一款由和誉医药研发的新型、可口服、高选择性且高效的小分子CSF-1R抑制剂。
该产品已被NMPA纳入突破性治疗品种,以及被美国FDA授予突破性疗法认定,并被欧洲药品管理局(EMA)授予优先药物(PRIME)认定。2023年12月,和誉医药与德国默克公司就该产品的商业化权利达成协议,德国默克公司会负责该产品在全球的商业化。
(3)睿健医药帕金森病细胞治疗药物获FDA再生医学先进疗法认定
12月22日,睿健医药宣布其自主研发的 NouvNeu001注射液(iPSC化学诱导通用型多巴胺能神经前体细胞)获得美国FDA授予的再生医学先进疗法(RMAT)认定。此前,该产品已经于今年8月获得FDA快速通道资格。
帕金森病为全球第二大神经退行性疾病,现有疗法的治疗定位多为对症或“并发症管理”,缺少“病程逆转类”治疗手段。NouvNeu001 的开发直接针对这一临床需求,旨在通过细胞替代疗法从根本上修复多巴胺能神经元损失,逆转帕金森病疾病的进展,为患者带来可能改变疾病进程的临床获益。
睿健医药创新的“AI+化学诱导”技术,能实现高纯度特定多巴胺能神经元亚型的定向分化,并在诱导过程中同步完成包括细胞生化在内的多种功能改造。移植后细胞通过填补病灶部位功能细胞的缺失,最终在患者体内修复帕金森病导致的环路缺失,并让患者重新获得多巴胺自体分泌功能,从而具有病程逆转潜力。
(4)赛诺菲1类新药在中国获批临床,针对炎症性肠病
12月23日,中国国家药监局药品审评中心(CDE)官网公示显示,赛诺菲(Sanofi)申报的1类新药 duvakitug注射液 获批临床,拟开发治疗中度至重度活动性克罗恩病(CD)、中度至重度活动性溃疡性结肠炎(UC)。公开资料显示,这是一款TL1A靶向单抗。
赛诺菲与梯瓦(Teva Pharmaceuticals)在2023年达成合作,共同开发并商业化 duvakitug ,用于治疗UC和CD。赛诺菲主导3期临床开发项目。
UC与CD是炎症性肠病(IBD)的两种主要类型。IBD以肠道慢性炎症为特征,患者长期遭受腹痛、腹泻、直肠出血、疲劳和体重下降等症状的困扰,长期炎症还可引发纤维化等并发症。
Duvakitug 是一款人源IgG1-λ2单抗,靶向TL1A,TL1A中文全称为肿瘤坏死因子(TNF)-样配体1A,在近年来受到行业广泛青睐。研究发现,TL1A在自身免疫性疾病中异常表达。从作用机制上来看,TL1A通过其DR3受体在肠道炎症级联和纤维化中起关键作用。因此,针对TL1A靶点的药物有望用于治疗溃疡性结肠炎、克罗恩病等多种自身免疫性疾病。
(5)再鼎医药宣布精神分裂症新药在中国获批
12月23日,再鼎医药宣布,中国国家药品监督管理局(NMPA)已批准 呫诺美林曲司氯铵胶囊(凯捷乐®)的新药上市申请,用于治疗成人精神分裂症。
呫诺美林曲司氯铵胶囊是具有全新作用机制的精神分裂症疗法,为精神分裂症治疗带来了根本性突破。不同于传统靶向多巴胺的抗精神病药物的机制,呫诺美林曲司氯铵胶囊通过选择性作用于大脑中的毒蕈碱型乙酰胆碱能M1和M4受体影响核心疾病通路。
与目前主要靶向多巴胺或5-羟色胺受体的抗精神病药物相比,呫诺美林可激活中枢神经系统中与这些疾病相关脑区的毒蕈碱受体。曲司氯铵不易穿过血脑屏障,其作用于外周,可减轻外周胆碱能激活所带来的不良反应。
(6)丽珠医药/鑫康合生物IL-17A/IL-17F单抗申报上市
12月24日,CDE网站显示,丽珠医药/鑫康合生物合作开发的 莱康奇塔单抗(LZM012/XKH004)申报上市,用于治疗斑块状银屑病。
莱康奇塔单抗是丽珠医药自鑫康合生物引进的一款IL-17A/IL-17F单抗,可同时靶向同源二聚体IL-17A-A和IL-17F-F,以及异源二聚体IL-17A-F。丽珠医药旗下控股子公司丽珠单抗已获得该产品在全球范围内的开发、注册、生产、销售和分许可的独占性权益。
今年7月,丽珠医药宣布 莱康奇塔单抗(320mg,每4周1次)对比司库奇尤单抗(300mg,每4周1次)治疗伴或不伴银屑病关节炎的中度至重度斑块状银屑患者的III期临床试验达到主要终点。
安全性方面,莱康奇塔单抗整体安全性良好,常见不良事件发生率与对照组各类不良事件发生率相当。
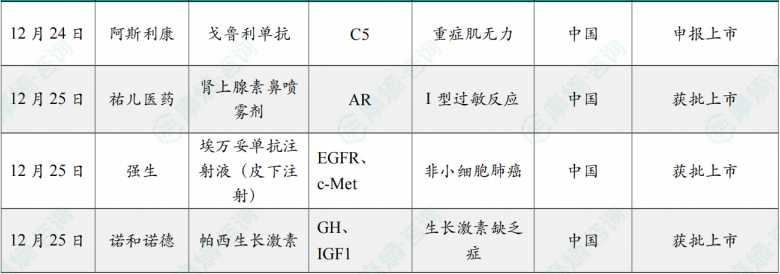
(7)阿斯利康自免双抗戈鲁利单抗在华申报上市
12月24日,CDE网站显示,阿斯利康的 戈鲁利单抗(gefurulimab)在华申报上市。根据临床试验进展,推测此次申报的适应症为全身型重症肌无力(gMG)。
戈鲁利单抗是一种迷你双抗(25kD),只包含了靶向C5的抗体重链可变区和与白蛋白(Albumin)特异性结合的抗体片段。较小的分子量可以带来更好的渗透性,并且与白蛋白的结合能够延长其半衰期。
今年7月,阿斯利康宣布戈鲁利单抗治疗抗乙酰胆碱受体(AChR)抗体阳性(Ab+)的gMG成人患者的III期研究达到了主要终点。结果显示,与相比,在第26周时,戈鲁利单抗组患者的重症肌无力日常生活活动能力量表(MG-ADL)总分较安慰剂组实现了具有统计学意义和临床意义的改善。此外,戈鲁利单抗耐受性良好,其安全性与C5抑制剂在既往研究中的表现一致,未发现新的安全性信号。
(8)首个肾上腺素鼻喷雾剂在华获批上市
12月25日,国家药品监督管理局(NMPA)官网显示,ARS Pharmaceuticals和祐儿医药合作开发的肾上腺素鼻喷雾剂(Neffy,中文商品名:优敏速)获批上市,适用于成人及体重≥30 kg儿童的I型过敏反应(包括严重过敏反应)的紧急治疗。
肾上腺素鼻喷雾剂(Neffy)是FDA批准的首个用于I型过敏反应(包括严重过敏反应)的非注射治疗产品, 采用创新的鼻喷给药方式,使用便捷,小巧易携带,能够在发生过敏反应的紧急情况下,第一时间由患者本人或他人完成给药。
早在2021年1月,祐儿医药与ARS已达成独家许可协议,双方将携手在大中华区域开发和商业化这款严重过敏反应急救药物 Neffy 。今年12月23日,远大医药与祐儿医药达成产品合作协议,获得该产品在中国大陆的独家商业化权益。
(9)强生的埃万妥单抗皮下注射剂型获批上市
12月25日,国家药监局(NMPA)官网显示,强生的 埃万妥单抗注射液(皮下注射)获批上市,用于联合兰泽替尼治疗EGFR突变型非小细胞肺癌(NSCLC)。
埃万妥单抗是一种靶向EGFR和c-MET的全人源双特异性抗体,具有免疫细胞定向活性,于2021年5月首次获批上市。
埃万妥单抗(皮下注射剂型)基于III期PALOMA-3研究的数据于今年4月在欧洲获批上市。研究结果显示,中位随访7.0个月时,在伴有EGFR外显子19缺失或外显子21 L858R置换突变的NSCLC患者(n=418)中,皮下制剂联合兰泽替尼组的客观缓解率(ORR)与静脉制剂联合兰泽替尼组相当(30.1% vs 32.5%,HR=0.92,P=0.001),达到非劣效性标准。在确认缓解的患者中,皮下制剂组的中位缓解持续时间(DOR)更长(11.2个月 vs 8.3个月)。
(10)诺和诺德长效生长激素帕西生长激素在华获批
12月25日,中国国家药品监督管理局(NMPA)批准了诺和诺德(Novo Nordisk)研发生产的长效生长激素(LAGH)注射液 诺泽优®(帕西生长激素)的上市申请,用于治疗因内源性生长激素分泌不足所致生长迟缓的2.5岁及以上儿童患者。
生长激素缺乏症是由于大脑垂体前叶分泌的生长激素不足导致的一种罕见内分泌代谢性疾病。帕西生长激素通过脂肪酸衍生化技术实现蛋白药物与体内白蛋白的非共价可逆性结合,兼顾药代动力学和药效动力学,通过延长药物在体内分布的时间,从而延长半衰期,使其实现每周一次给药,减少年注射次数至52次,大幅降低患者治疗负担。
该产品于2020年8月28日在美国批准用于治疗成人生长激素缺乏症(AGHD),并于2023年4月扩大了其适应症,成为获批用于儿童和成人生长激素缺乏症的生长激素周制剂。
1.4.2 本周全球TOP10积极/失败临床结果
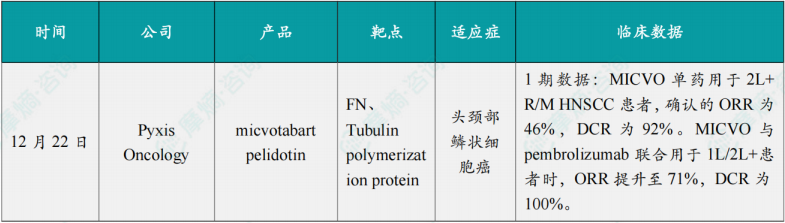
(1)Pyxis Oncology公布micvotabart pelidotin 1期临床积极数据
12月22日,Pyxis Oncology公司宣布,其ADC疗法 micvotabart pelidotin(MICVO,原名PYX-201)用于治疗复发/转移性头颈部鳞状细胞癌的1期临床试验取得了积极的初步数据。MICVO 以微管抑制剂(优化的auristatin)作为有效载荷,能靶向肿瘤细胞外基质(ECM)中的非细胞性结构成分——纤连蛋白B结构域(Extradomain-B Fibronectin,EDB+FN),通过直接杀伤癌细胞、降低细胞外基质密度、抑制血管生成及激活抗肿瘤免疫,实现多机制协同抗癌。该药已获美国FDA授予的快速通道资格,用于铂类和PD-(L)1抑制剂治疗后疾病进展的R/M HNSCC患者。
此次公布的结果显示,MICVO 单药用于2L+ R/M HNSCC患者,确认的ORR为46%,DCR为92%。MICVO 与 pembrolizumab 联合用于1L/2L+患者时,ORR提升至71%,DCR为100%。安全性方面,MICVO总体耐受良好,未观察到4级ADC有效载荷治疗相关不良事件,也没有观察到5级不良事件。
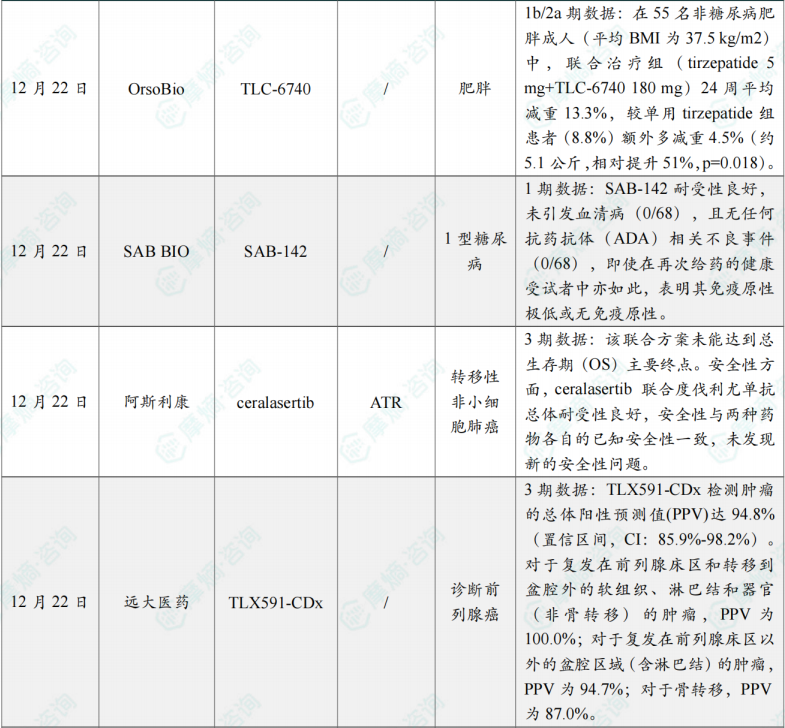
(2)OrsoBio公司公布TLC-6740 1b/2a期联合治疗试验数据
12月22日,OrsoBio公司宣布,其新型口服、肝脏靶向的线粒体质子载体 TLC-6740 在一项为期24周的1b/2a期临床试验中取得了积极的顶线数据。该研究评估了 TLC-6740 联合GLP-1/GIP受体双重激动剂 tirzepatide 治疗肥胖的效果。
TLC-6740 是一种新型口服药物,通过选择性作用于肝脏线粒体,增加能量消耗,旨在促进减重并改善代谢健康,包括改善胰岛素敏感性和脂质代谢。该药正在开发用于肥胖、糖尿病和代谢功能障碍相关脂肪性肝炎(MASH)等疾病。
此次公布的结果显示,在55名非糖尿病肥胖成人(平均BMI为37.5 kg/m2)中,联合治疗组(tirzepatide 5 mg+TLC-6740 180 mg)24周平均减重13.3%,较单用 tirzepatide 组患者(8.8%)额外多减重4.5%(约5.1公斤,相对提升51%,p=0.018)。此外,单药组在24周时体重下降趋于平台期,而联合组仍呈持续线性减重趋势。
此外,TLC-6740 联合 tirzepatide 的治疗显著改善了患者的胰岛素敏感性、肝脏健康和体成分,且未导致瘦体重流失。安全性方面,TLC-6740 联用 tirzepatide 的安全性和耐受性良好,胃肠道不良反应与 tirzepatide 单药治疗相当。
(3)SAB BIO公司公布SAB-142的1期临床试验积极结果
12月22日,SAB BIO公司公布了其在研人类抗胸腺细胞免疫球蛋白疗法 SAB-142 的积极1期临床试验结果。SAB-142 是一种人类多克隆免疫球蛋白,旨在治疗自身免疫性1型糖尿病。该药物可针对多种杀伤胰岛β细胞的免疫细胞,调节它们的活性,从而起到保护胰岛β细胞的作用。
此次公布的数据显示,SAB-142 耐受性良好,未引发血清病(0/68),且无任何抗药抗体(ADA)相关不良事件(0/68),即使在再次给药的健康受试者中亦如此,表明其免疫原性极低或无免疫原性。所有受试者均未发生药物相关严重不良事件(SAE),大多数不良反应为轻度、短暂的1级类流感症状及输注部位反应。药效学方面,作为与靶点结合的标志,SAB-142 诱导了短暂性淋巴细胞减少(100%受试者),但1–3天内即恢复至基线,恢复速度远快于其他免疫调节药物,支持其在门诊环境中的长期重复使用。
(4)阿斯利康口服ATR抑制剂3期未达到主要终点
12月22日,阿斯利康公布了 ceralasertib 联合 度伐利尤单抗 治疗局部晚期或转移性非小细胞肺癌(NSCLC)的III期LATIFY最新进展。结果显示,该联合方案未能达到总生存期(OS)主要终点。安全性方面,ceralasertib 联合 度伐利尤单抗 总体耐受性良好,安全性与两种药物各自的已知安全性一致,未发现新的安全性问题。这些数据将在即将召开的医学会议上公布。
LATIFY是一项随机、开放标签、多中心、全球性III期临床试验,旨在评估 ceralasertib 联合 度伐利尤单抗 治疗局部晚期或转移性NSCLC的疗效,这些患者没有可操作的基因组改变(AGA),且既往接受过抗PD-(L)1治疗和铂类化疗后病情进展。该研究主要终点是OS,次要终点包括无进展生存期、客观缓解率、缓解持续时间、缓解时间、疾病控制率和患者报告结局。
(5)远大医药创新RDC药物TLX591-CDx中国3期临床研究成功达到主要临床终点
12月22日,远大医药(0512.HK)宣布,其用于诊断前列腺癌的创新在研放射性核素偶联药物(RDC) TLX591-CDx (Illuccix®, gallium Ga 68 PSMA-11)在中国进行的III期临床试验,近日取得了积极的顶线结果,并成功达到了主要临床终点。
根据临床顶线结果显示,TLX591-CDx 检测肿瘤的总体阳性预测值(PPV)达94.8%(置信区间,CI:85.9%-98.2%)。对于复发在前列腺床区和转移到盆腔外的软组织、淋巴结和器官(非骨转移)的肿瘤,PPV为100.0%;对于复发在前列腺床区以外的盆腔区域(含淋巴结)的肿瘤,PPV为94.7%;对于骨转移,PPV为87.0%。同时,该试验根据受试者不同的前列腺特异性抗原(PSA)基线水平进行分组,TLX591-CDx 在所有的分组中均显示出了较高的PPV,即使在极低的PSA水平的受试者亚组中,PPV依然超过了90%(见下表),这提示了 TLX591-CDx 的PET成像检测对于疑似生化复发的前列腺癌患者的早期诊断有着非常积极的临床意义。
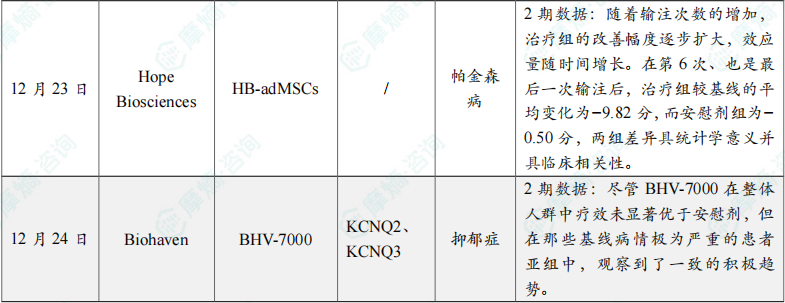
(6)Hope Biosciences公布帕金森病细胞疗法2期试验积极结果
12月23日,Hope Biosciences Research Foundation(HBRF)公布了一项2期临床试验的积极顶线结果,该研究评估了其所开发的同种异体脂肪来源间充质干细胞疗法(HB-adMSCs)在早期至中期帕金森病(PD)患者中的疗效。分析显示,该研究成功达到主要终点,与安慰剂组相比,治疗组在运动功能方面显示出具有统计学意义的改善。根据此积极结果,HBRF将推动该疗法进入3期试验。
在研究结束时,主要终点临床医生评估的运动功能量表(MDS-UPDRS PartⅢ)结果显示,治疗组呈现出持续增强且具有临床意义的治疗效果。随着输注次数的增加,治疗组的改善幅度逐步扩大,效应量随时间增长。在第6次、也是最后一次输注后,治疗组较基线的平均变化为−9.82分,而安慰剂组为−0.50分,两组差异具统计学意义并具临床相关性。安全性方面,该疗法表现出良好的安全性与耐受性。
(7)Biohaven新型钾通道调节剂BHV-7000重度抑郁症2期临床未达到主要终点
12月24日,Biohaven公布 BHV-7000 治疗重度抑郁二期临床最新数据,研究没有达到MADRS抑郁症状缓解的主要终点。该研究评估了6周内蒙哥马利-阿斯伯格抑郁量表(MADRS)评分的变化,结果显示BHV-7000与安慰剂相比无统计学显著差异。
该评估所采用的MADRS量表涵盖情绪低落、精神紧张、睡眠、食欲等10个项目,由经过培训的专业人员通过半结构化访谈进行评分,其结果结合了行为观察与患者陈述,可靠性较高。分数越高表示抑郁程度越严重。尽管 BHV-7000 在整体人群中疗效未显著优于安慰剂,但在那些基线病情极为严重的患者亚组中,观察到了一致的积极趋势。在这部分重症患者中,BHV-7000 不仅在其主要终点上呈现更大幅度的降低,在两项关键次要终点:临床总体印象-严重度量表(CGI-S:反映医生对患者整体病情的评估)和斯奈斯-汉密尔顿快感量表(SHAPS:衡量“快乐感受能力”的快感缺失量表)上,也呈现出数值上的显著改善。
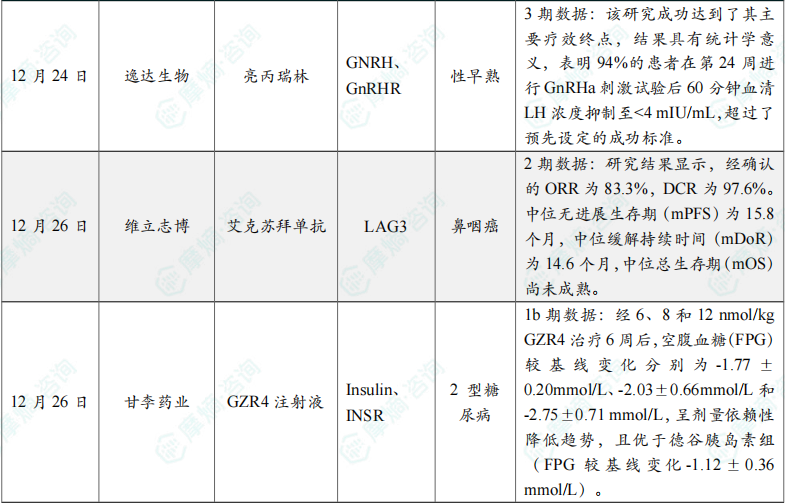
(8)逸达生物的亮丙瑞林临床3期研究成功
12月24日,逸达生物(Foresee Pharmaceuticals)宣布,其III期Casppian临床试验取得积极的顶线结果。新闻稿指出,该结果证实了单次注射 42mg 亮丙瑞林(研发代码:FP-001)即可有效且持续地抑制垂体-性腺轴长达六个月,有望提高中枢性性早熟(CPP)儿童的治疗便利性和依从性,增强了公司对其作为潜在同类最佳疗法的信心。
42mg FP-001 是一种在研的缓释型促性腺激素释放激素(GnRH)激动剂制剂,旨在单次肌内注射后持续抑制促性腺激素分泌长达6个月,为现有疗法提供了一种给药频率更低的替代方案。
结果显示,该研究成功达到了其主要疗效终点,结果具有统计学意义,表明94%的患者在第24周进行GnRHa刺激试验后60分钟血清LH浓度抑制至<4 mIU/mL,超过了预先设定的成功标准。
(9)维立志博的艾克苏拜单抗治疗鼻咽癌临床2期研究结果在《Clinical Cancer Research》发表
12月26日,维立志博发布公告,最新一期国际肿瘤学领域权威期刊《Clinical Cancer Research》在线发表了其自主研发的1类新药LAG-3抗体 艾克苏拜单抗(LBL-007)联合替雷利珠单抗和化疗在既往未经治疗的复发或转移性鼻咽癌(R/M NPC)患者中的Ⅱ期临床研究结果。
研究结果显示,经确认的ORR为83.3%,DCR为97.6%。中位无进展生存期(mPFS)为15.8个月,中位缓解持续时间(mDoR)为14.6个月,中位总生存期(mOS)尚未成熟。LBL-007 联合 替雷利珠单抗 加化疗相比 替雷利珠单抗 联合化疗(ORR 69.5%,mPFS 9.2个月,mDoR 8.5个月;NCT03924986),ORR、mPFS、mDoR均明显提高。
(10)甘李药业胰岛素周制剂GZR4 1b期研究成果发表
12月26日,甘李药业发布公告,其自主研发的1类创新药胰岛素周制剂 GZR4注射液 在中国完成的一项Ib期临床研究成果已正式发表于内分泌领域国际著名期刊《Diabetes Research and Clinical Practice》。GZR4注射液 是甘李药业自主研发的一款预期每周一次给药的创新型超长效胰岛素类似物周制剂。
研究结果表明,GZR4 在T2DM受试者中安全性和耐受性良好,其药代动力学与药效动力学特征支持其作为每周一次给药的基础胰岛素,具体结果如下:
在T2DM受试者中,GZR4 的安全性、耐受性良好。在所有治疗组中,均未发生严重不良事件,最常见的不良事件是低血糖,但均未发生严重低血糖。药代动力学结果显示,GZR4 的最大血药浓度(Cmax)呈剂量依赖性升高,GZR4 在1-2次注射后可达到稳态。药效学结果显示,经6、8和12 nmol/kg GZR4治疗6周后,空腹血糖(FPG)较基线变化分别为-1.77±0.20mmol/L、-2.03±0.66mmol/L和-2.75±0.71 mmol/L,呈剂量依赖性降低趋势,且优于德谷胰岛素组(FPG较基线变化-1.12±0.36 mmol/L)。
此外,经6周的治疗后,6 nmol/kg GZR4剂量组的糖化血红蛋白(HbA1c)降低了0.76±0.14%,而德谷胰岛素组的HbA1c仅降低0.13±0.21%。在 GZR4 组中,糖化白蛋白(GA)的较基线变化范围为-0.7±0.96%至- 1.6±0.88%,而在德谷胰岛素组中,GA的变化为0.3±0.78%。同时,从基线到第36天,GZR4 组的葡萄糖目标范围内时间(TIR)增加幅度为14.4±5.7%至16.2%±5.7%,而德谷胰岛素组的TIR增加为4.3%±5.5%。
同期事件:
1. 2025年第52周12.22-12.28国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第52周12.22-12.28国内仿制药/生物类似物申报/审批数据分析
3. 2025年第52周12.22-12.28国内医药大健康行业政策法规汇总
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.12.22-2025.12.28) },如需查看或下载完整版报告,可点击!
扩展阅读:
1. 2024年第42周10.14-10.20全球创新药研发概览
2. 2024年第37周09.09-09.15全球创新药研发概览
3. 2024年第33周08.12-08.18全球创新药研发概览
查数据,找摩熵!想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!
























































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论