1.4.1 本周全球TOP10创新药研发进展
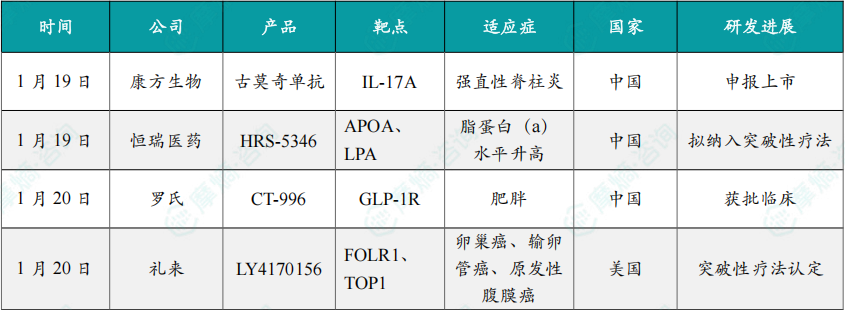
(1)康方生物宣布治疗强直性脊柱炎新药上市申请获受理
1月19日,康方生物宣布,其自主研发的新型人源化抗IL-17A单克隆抗体 古莫奇单抗(AK111)用于治疗活动性强直性脊柱炎(AS)的新药上市申请(sNDA),已获得中国国家药监局药品审评中心(CDE)受理。AS是 古莫奇单抗 第二项获得NDA受理的适应症,其用于治疗中重度银屑病的申请已于2025年1月获得CDE受理。强直性脊柱炎是一种慢性炎症性疾病,主要累及骶髂关节、脊柱及外周关节,可能导致脊柱畸形和功能丧失,严重影响患者生活。
古莫奇单抗 此项NDA申请基于其关键注册性3期临床研究AK111-303的优异结果。研究结果表明,古莫奇单抗 能够高效、快速缓解患者AS症状,同时显著改善患者的疾病活动度、躯体功能以及生活质量。在该研究中,古莫奇单抗 治疗活动性强直性脊柱炎患者,达到了全部预设的疗效终点:主要终点ASAS20应答率及各项亚组分析、关键次要终点ASAS40应答率,以及其他多个预先设定的次要终点,均显示出统计学显著性和临床意义的改善。
(2)恒瑞医药脂蛋白(a)抑制剂拟纳入突破性疗法
1月19日,CDE网站显示,恒瑞医药的 HRS-5346 拟纳入突破性疗法,用于治疗脂蛋白(a)水平的升高。HRS-5346 是恒瑞医药子公司拓界生物开发的一款脂蛋白(a)(LP(a))抑制剂。临床前数据显示,HRS-5346 可有效改善脂蛋白紊乱,安全性良好。
2025年3月,默沙东与恒瑞医药达成协议,以19.7亿美元的总交易额获得该药物在大中华区以外的全球范围内开发、生产和商业化独家权益。目前,HRS-5346 已在心血管事件高风险伴脂蛋白(a)升高的人群中完成一项II期研究,数据尚未公布。
(3)罗氏口服GLP-1受体激动剂1类新药在中国获批临床
1月20日,中国国家药监局药品审评中心(CDE)官网公示显示,罗氏(Roche)申报的1类新药 RO7795081 在中国获批临床,拟用于超重或肥胖患者的长期体重管理。公开资料显示,RO7795081(CT-996)为一款口服胰高血糖素样肽-1(GLP-1)受体激动剂。
罗氏此前与Carmot Therapeutics达成合并协议,斥资约31亿美元收购了Carmot公司,从而获得后者的三款GLP-1类在研疗法,CT-996 就是其中之一。
公开资料显示,与内源性GLP-1激素不同,CT-996 被专门设计为一种有偏向的GLP-1受体激动剂,可以激活cAMP信号,而几乎没有β-arrestin的募集。这些精准调节的信号特性有望导致强有力的血糖控制,从而实现显著的体重减轻和良好的耐受性。
(4)礼来FRα ADC获FDA突破性疗法认定
1月20日,礼来宣布FDA已授予 sofetabart mipitecan(LY4170156)突破性疗法资格,用于治疗既往接受过 贝伐珠单抗 治疗、且符合用药条件的患者在接受过 索米妥昔单抗 治疗后的成人铂耐药上皮性卵巢癌、输卵管癌或原发性腹膜癌患者。
FDA此次授予突破性疗法认定是基于 LY4170156 的Ia/b期研究的积极初步数据。研究结果显示,该药物在各剂量水平下均能产生疗效,且不受患者FRα表达水平的限制,即便是既往接受 索米妥昔单抗 治疗后疾病进展的患者,也能从中获益。初步数据还表明,该药物具有良好的耐受性,间质性肺病、周围神经病变、脱发等不良反应发生率较低,且未观察到显著的眼部毒性。
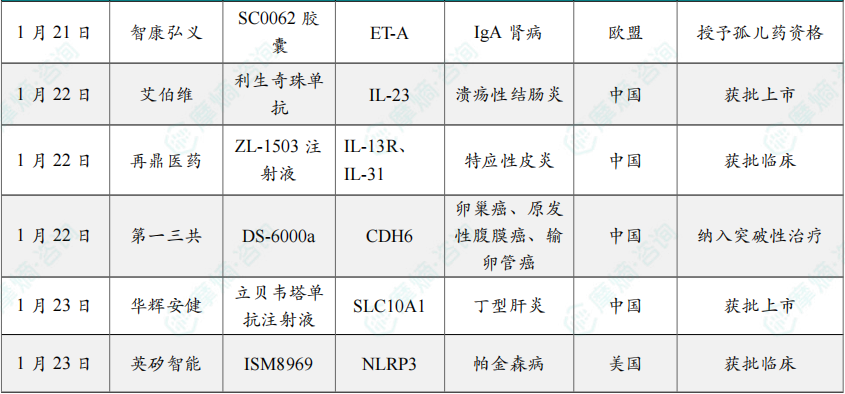
(5)智康弘义IgA肾病小分子新药在欧盟获孤儿药资格
1月21日,智康弘义宣布其核心管线之一的高选择性内皮素受体A(ETA)小分子拮抗剂 SC0062胶囊 ,继用于治疗IgA肾病、糖尿病肾病高蛋白尿适应症先后两次获中国国家药监局药品审评中心(CDE)纳入突破性治疗品种、以及治疗慢性肾病(CKD)高蛋白尿适应症全球3期临床试验(MRCT)获FDA和CDE批准开展后,在国际监管层面取得又一项重要里程碑——SC0062胶囊 用于治疗原发性IgA肾病适应症获欧盟委员会(EC)授予孤儿药资格。
SC0062 是一款拟开发治疗慢性肾脏病的ETA小分子拮抗剂,该产品针对慢性肾脏病进行了全新的分子设计,具有独特的ETA高选择性,目标在保证疗效的同时进一步提升药物安全性。临床前研究表明,SC0062 具有良好的活性,能够有效改善急性肾损伤和慢性肾脏病模型的病理评分。在已完成的临床1期研究中,SC0062 表现出良好的安全性和耐受性及药代动力学特征,同时未发现水钠潴留等副作用。
(6)艾伯维的利生奇珠单抗在华获批治疗溃疡性结肠炎
1月22日,艾伯维宣布 利生奇珠单抗(risankizumab,商品名:喜开悦)在华获批第二项适应症,用于治疗对传统治疗或生物制剂治疗应答不足、失应答或不耐受的中重度活动性溃疡性结肠炎(UC)成年患者。
利生奇珠单抗 是一种IL-23抑制剂,可通过与IL-23p19亚基结合来选择性阻断IL-23。IL-23是一种参与炎症过程的细胞因子,被认为与许多慢性免疫介导疾病有关。
2025年3月10日,利生奇珠单抗 在中国首次获批上市,用于治疗对传统治疗或生物制剂治疗应答不足、失应答或不耐受的中重度活动性克罗恩病成年患者。此次获批新适应症是基于INSPIRE和COMMAND两项III期临床试验的积极结果。
结果显示,在INSPIRE诱导治疗试验中,与安慰剂相比,利生奇珠单抗 治疗12周显著提高了临床缓解率(20.3% vs 6.2%;调整后组间差异14.0%[95% CI:10.0%–18.0%];P<0.001);在COMMAND维持治疗试验中,180mg和360mg两种维持剂量治疗52周的临床缓解率均显著优于安慰剂组(40.2% vs 37.6% vs 25.1%)。
(7)再鼎医药双抗1类新药在中国获批临床,治疗特应性皮炎
1月22日,中国国家药品监督管理局药品审评中心(CDE)官网公示,再鼎医药申报的1类新药 ZL-1503注射液 获批临床,拟开发治疗中重度特应性皮炎。
根据再鼎医药公开资料,这是该公司内部研发团队发现及开发的一款IL-13/IL-31R双特异性抗体,该产品有望用于治疗中重度特应性皮炎及其他2型辅助性T细胞(Th2)介导的疾病。
公开资料显示,现有IL-4/IL-13信号通路抑制剂虽然已显著改善特应性皮炎(AD)治疗格局,但是某些AD症状由IL-31介导,而抑制IL-4/IL-13只能部分缓解症状,这导致现有疗法对许多患者起效慢且临床疗效有限。ZL-1503 可同时靶向IL-13和IL-31通路,且具有延长的血清半衰期,这种双重靶向策略有望实现更快的起效速度和更优的疗效。
(8)第一三共宣布ADC癌症新药在中国纳入突破性治疗品种
1月22日,第一三共(Daiichi Sankyo)宣布,raludotatug deruxtecan (R-DXd,DS-6000a) 获中国国家药品监督管理局药品审评中心(CDE)纳入突破性治疗品种,用于治疗既往接受过 贝伐珠单抗 治疗且CDH6表达的铂耐药上皮性卵巢癌、原发性腹膜癌或输卵管癌成人患者。
R-DXd 为CDH6靶向抗体偶联药物(ADC),由第一三共研发,并由第一三共和默沙东(MSD)联合开发。
CDE基于REJOICE-Ovarian01 2期临床研究数据将 R-DXd 纳入突破性治疗品种。REJOICE-Ovarian01研究2期部分的研究结果表明,R-DXd 在复发性铂类耐药卵巢癌、原发性腹膜癌或输卵管癌患者中展现出具有临床意义的疗效结果。研究结果显示,无论患者所接受的药物剂量水平或肿瘤CDH6表达程度如何,均可观察到具有临床意义的肿瘤缓解。
(9)华辉安健丁型肝炎突破性疗法获批上市
1月23日,NMPA官网显示,国家药品监督管理局通过优先审评审批程序附条件批准华辉安健(北京)生物科技有限公司申报的 立贝韦塔单抗注射液(商品名:华优诺)上市,用于治疗伴有或不伴有代偿期肝硬化的慢性丁型肝炎病毒(HDV)感染成年患者。
立贝韦塔单抗 是华辉安健公司开发的全球首个靶向乙肝病毒表面大包膜蛋白前S1(PreS1)区的中和抗体。它通过特异性结合HBV/HDV表面的PreS1区域,阻断HBV、HDV和其受体NTCP的结合从而阻止病毒进入肝细胞,中和病毒的感染。2024年11月,该药还获得美国FDA授予突破性疗法认定。
(10)英矽智能口服新药在美国获批临床,针对帕金森病
1月23日,英矽智能宣布,其用于炎症及神经退行性疾病治疗的口服NLRP3抑制剂 ISM8969 临床试验新药(IND)申请获得美国FDA批准,用于帕金森病治疗。即将开展的这项1期临床研究旨在评估 ISM8969 在健康人群中的安全性、耐受性及药代动力学表现,并找到临床推荐最佳剂量以供后续的进一步研究。
ISM8969 是一款创新NLRP3抑制剂,具有理想的血脑屏障穿透特性,具有治疗帕金森病的潜力。通过抑制NLRP3,ISM8969 旨在调节这种病理性炎症反应,助力神经退行性疾病患者体内神经元存活和功能运转。
研究表明,ISM8969 不仅具有均衡的成药性特征,在炎症性疾病和慢性疾病小鼠模型中展现出抗炎疗效,还具备穿透血脑屏障直接到达中枢神经系统(CNS)的能力,这为其在帕金森病等中枢神经系统疾病治疗中确立了独特优势。
1.4.2 本周全球TOP10积极/失败临床结果
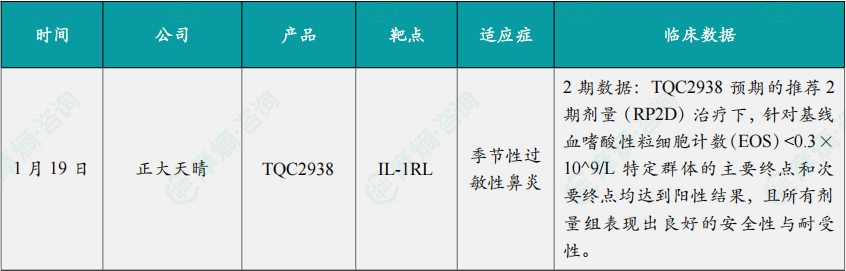
(1)正大天晴ST2单抗2期研究获积极进展,治疗季节性过敏性鼻炎
1月19日,正大天晴宣布其自主研发的 TQC2938(ST2单抗)已完成针对季节性过敏性鼻炎(SAR)的2期临床试验。研究结果显示,TQC2938 预期的推荐2期剂量(RP2D)治疗下,针对基线血嗜酸性粒细胞计数(EOS)<0.3×10^9/L特定群体的主要终点和次要终点均达到阳性结果,且所有剂量组表现出良好的安全性与耐受性。
研究表明,AR患者血清可溶性ST2(sST2)浓度升高,尤其是在伴有多系统过敏性鼻炎(MSAR)的患者中,sST2水平升高与症状评分量表记录的临床严重程度相关,且既往研究提示靶向IL-33/ST2可以同时抑制2型和非2型炎症。
TQC2938 是一款基于人ST2序列自主开发的人源化IgG2单克隆抗体,能“识别”并结合体内的ST2蛋白,阻止IL-33和ST2的结合,抑制NF-κB和MAPK信号通路的激活,进而阻断2型炎症和非2型炎症通路,改善过敏性鼻炎症状和生活质量。
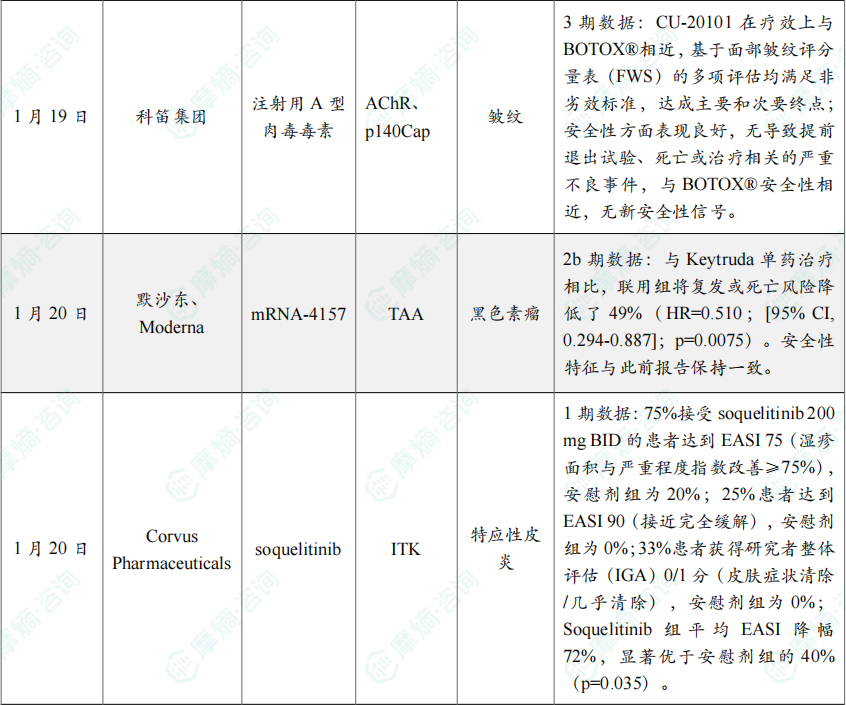
(2)科笛生物注射用A型肉毒毒素国内3期临床试验取得积极顶线结果
1月19日,科笛集团宣布其 CU-20101(注射用A型肉毒毒素)用于改善中度至重度眉间纹的国内III期临床试验取得积极顶线结果。
该试验分两阶段开展,第一阶段为随机、多中心、双盲、阳性药物对照试验,第二阶段为开放标签试验,以 保妥适®(BOTOX®)为参比制剂,于2025年11月完成所有受试者出组,2026年1月上旬完成数据库锁定。
结果显示,CU-20101 在疗效上与 BOTOX® 相近,基于面部皱纹评分量表(FWS)的多项评估均满足非劣效标准,达成主要和次要终点;安全性方面表现良好,无导致提前退出试验、死亡或治疗相关的严重不良事件,与 BOTOX® 安全性相近,无新安全性信号。此外,该产品生产不使用动物源性材料,可消除传染性海绵状脑病(TSE)感染及相关过敏风险,具备安全优势。
(3)默沙东与Moderna公布mRNA癌症疫苗联合疗法5年随访积极结果
1月20日,默沙东与Moderna联合公布了个体化mRNA癌症疫苗 mRNA-4157 联合抗PD-1单抗 Keytruda 用于完全切除术后的高危黑色素瘤(III/IV期)患者的IIb期KEYNOTE-942/mRNA-4157-P201研究的中位5年随访数据。研究的主要终点无复发生存期(RFS)显示出有临床意义的持续改善,与 Keytruda 单药治疗相比,联用组将复发或死亡风险降低了49%(HR=0.510;[95% CI, 0.294-0.887];p=0.0075)。安全性特征与此前报告保持一致。
mRNA-4157 在全球范围内属于领先行列,由编码34个新抗原的合成mRNA构成,其设计与生产基于患者肿瘤DNA序列的独特突变特征。给药后,会经历天然的细胞抗原加工与呈递过程,并产生特异性T细胞应答,训练并激活抗肿瘤免疫反应。
(4)Corvus公布ITK抑制剂治疗特应性皮炎1期临床积极数据
1月20日,Corvus Pharmaceuticals宣布,其选择性口服ITK抑制剂 soquelitinib 在针对中重度特应性皮炎(AD)的随机、双盲、安慰剂对照Ⅰ期试验第四队列中取得积极结果。75%接受 soquelitinib 200 mg BID的患者达到EASI 75(湿疹面积与严重程度指数改善≥75%),安慰剂组为20%;25%患者达到EASI 90(接近完全缓解),安慰剂组为0%;33%患者获得研究者整体评估(IGA)0/1分(皮肤症状清除/几乎清除),安慰剂组为0%;Soquelitinib 组平均EASI降幅72%,显著优于安慰剂组的40%(p=0.035)。
基于以上数据,Corvus将于2026年第一季度启动约200例患者的中重度AD Ⅱ期临床,设12周治疗期,评估200 mg QD、200 mg BID及400 mg QD三种剂量,主要终点为EASI 75与IGA 0/1的持久应答。
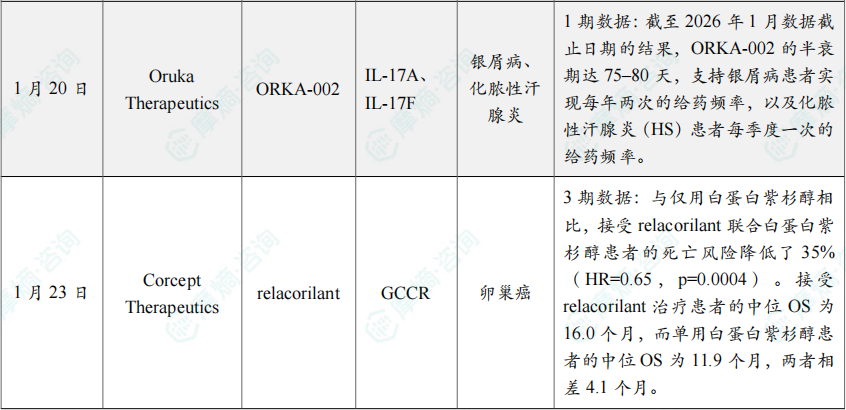
(5)Oruka Therapeutics公布ORKA-002 1期临床试验中期数据
1月20日,Oruka Therapeutics公司公布了其在研药物 ORKA-002 在1期临床试验中取得积极的中期数据。ORKA-002 旨在阻断在银屑病及其他炎症性疾病发病机制中起关键作用的细胞因子,是一种靶向IL-17-A和IL-17-F的双特异性抗体。
该1期研究是一项随机、双盲、安慰剂对照试验,在24名健康成人受试者中评估了 ORKA-002 的安全性和药代动力学特征。截至2026年1月数据截止日期的结果,ORKA-002 的半衰期达75–80天,支持银屑病患者实现每年两次的给药频率,以及化脓性汗腺炎(HS)患者每季度一次的给药频率。
药效学分析显示,在体外IL-17刺激实验中,所有剂量组均能强效抑制IL-17信号传导,效果持续至末次随访(最长24周),进一步支持两年一次给药的潜力。
安全性方面,ORKA-002 在所有剂量水平下均耐受良好,安全性与抗IL-17类药物一致。
(6)Corcept Therapeutics抗癌小分子药物关键3期结果公布
1月23日,Corcept Therapeutics宣布,其关键性3期临床试验ROSELLA达到总生存期(OS)这一主要终点。该试验评估了其选择性皮质醇调节剂 relacorilant 联合 白蛋白紫杉醇(nab-paclitaxel)用于治疗铂耐药卵巢癌患者的效果。
此前,美国FDA已受理 relacorilant 用于治疗铂耐药卵巢癌的上市申请,并设定PDUFA日期为2026年7月11日。此外,欧洲药品管理局(EMA)也正在审评该疗法用于治疗铂耐药卵巢癌的上市许可申请(MAA)。
ROSELLA在全球多个研究中心共入组381例铂耐药卵巢癌患者。患者按1:1比例随机分组,分别接受 relacorilant 联合 白蛋白紫杉醇 治疗,或接受 白蛋白紫杉醇 单药治疗。
分析显示,与仅用 白蛋白紫杉醇 相比,接受 relacorilant 联合 白蛋白紫杉醇 患者的死亡风险降低了35%(HR=0.65,p=0.0004)。接受 relacorilant 治疗患者的中位OS为16.0个月,而单用 白蛋白紫杉醇 患者的中位OS为11.9个月,两者相差4.1个月。Relacorilant 联合 白蛋白紫杉醇 治疗的耐受性良好,与其已知的安全性特征一致。值得注意的是,联合治疗组不良事件的类型、发生频率及严重程度与 白蛋白紫杉醇 单药治疗组相当。Relacorilant 在带来疗效获益的同时,并未增加患者的安全性负担。
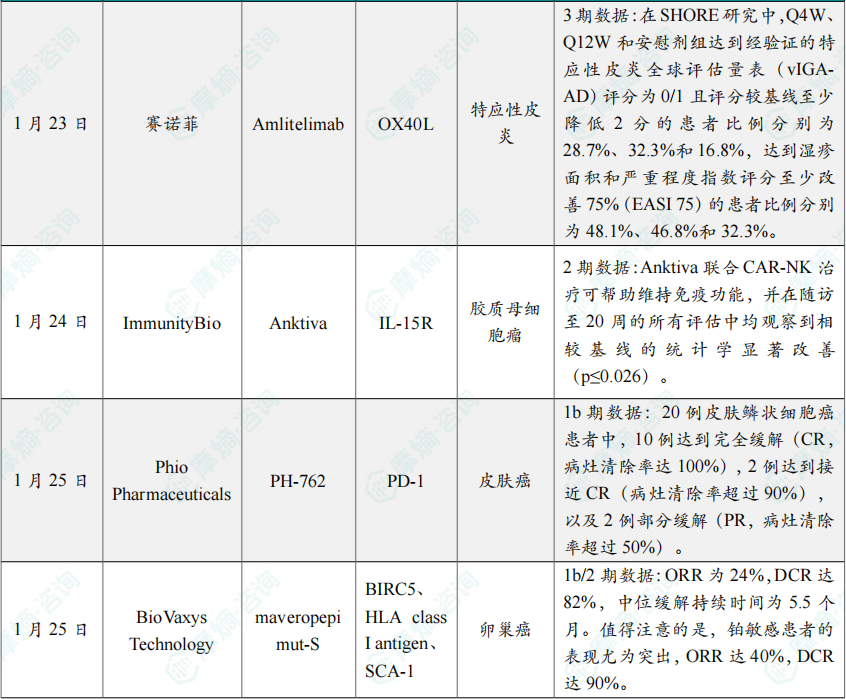
(7)赛诺菲全球首创OX40L单抗两项3期研究成功
1月23日,赛诺菲宣布Amlitelimab治疗特应性皮炎的两项III期研究(SHORE和COAST 2)达到主要终点。此前,该药物在2025年9月已有一项III期研究达到主要终点。
Amlitelimab 是赛诺菲开发的一款靶向OX40L(OX40配体)的全人源非T细胞耗竭性单克隆抗体,可阻断关键免疫调节因子OX40L与其受体OX40结合,并保持促炎性T细胞和调节性T细胞之间的平衡,进而起到治疗特应性皮炎、哮喘、化脓性汗腺炎等一系列免疫性疾病和炎症性疾病的作用。该药物是目前唯一一款III期阶段OX40L抗体。
结果显示,在SHORE研究中,Q4W、Q12W和安慰剂组达到经验证的特应性皮炎全球评估量表(vIGA-AD)评分为0/1且评分较基线至少降低2分的患者比例分别为28.7%、32.3%和16.8%,达到湿疹面积和严重程度指数评分至少改善75%(EASI 75)的患者比例分别为48.1%、46.8%和32.3%。Amlitelimab 组最常见的治疗期间不良事件(TEAE)是鼻咽炎(9.5%)、上呼吸道感染(7.9%)、特应性皮炎(2.7%)。
在COAST 2研究中,Q4W、Q12W和安慰剂组达到vIGA-AD 0/1且降低2分的患者比例分别为25.3%、25.7%和14.8%,达到EASI 75的患者比例分别为41.8%、40.5%和24.2%。Amlitelimab 组最常见的TEAE是鼻咽炎(5.9%)、上呼吸道感染(4.8%)、特应性皮炎(5.3%)。
(8)ImmunityBio公布Anktiva治疗胶质母细胞瘤2期积极结果
1月24日,ImmunityBio公布了QUILT-3.078临床2期研究的最新数据,该研究正在评估由IL-15超级激动剂 Anktiva(nogapendekin alfa inbakicept)与CAR-NK细胞疗法联合的无化疗免疫治疗方案,用于治疗二线复发或进展的胶质母细胞瘤(GBM)患者,同时也涵盖通过单例患者IND(spINDs)接受治疗的1线至3线患者。
截至2026年1月22日,研究已入组23例在接受标准治疗(包括手术、放疗及替莫唑胺化疗)后出现复发或进展的GBM患者,其中19例仍然存活。该研究的主要终点为总生存期(OS),截至数据更新时,中位总生存期尚未达到,提示该方案在延长生存方面展现出潜在益处。
在目前可评估的14例患者中,从疾病复发时间起已观察到的最长生存期达12个月,且随访仍持续进行。值得注意的是,这些患者入组时的平均绝对淋巴细胞计数(ALC)仅为0.9×10³/μL,确认存在严重淋巴细胞减少,但在一个治疗周期内ALC即显著升高至≥1.4×10³/μL(p<0.001,N=14)。研究显示,Anktiva 联合 CAR-NK 治疗可帮助维持免疫功能,并在随访至20周的所有评估中均观察到相较基线的统计学显著改善(p≤0.026)。安全性方面,该方案在迄今累计给药219次后表现出可控的安全性特征,在QUILT-3.078及spINDs入组的共41例患者中,仅报告3例与治疗相关的严重不良事件。
(9)Phio Pharmaceuticals公布PH-762治疗皮肤癌1b期临床试验积极结果
1月25日,Phio Pharmaceuticals公司公布了其siRNA疗法 PH-762 在治疗皮肤癌的1b期临床试验中的积极结果。PH-762 是利用该公司专有的INTASYL基因沉默技术开发的化合物,旨在沉默与各种类型皮肤癌有关编码PD-1的基因。
在该研究中,22名皮肤癌患者完成了治疗,并接受了病灶部位的切除手术。20例皮肤鳞状细胞癌患者中,10例达到完全缓解(CR,病灶清除率达100%),2例达到接近CR(病灶清除率超过90%),以及2例部分缓解(PR,病灶清除率超过50%)。1例转移性默克尔细胞癌患者也实现了PR。有6例cSCC患者和1例黑色素瘤患者的病灶清除率低于50%,但所有患者均未出现疾病进展。所有接受瘤内注射PH-762的患者均未发生剂量限制性毒性或临床相关的治疗伴发不良事件。
(10)BioVaxys Technology公布多肽疫苗maveropepimut-S联合疗法1b/2期临床试验数据
1月25日,BioVaxys Technology公司宣布其PESCO研究取得积极初步结果。该研究是一项由研究者发起、开放标签、非随机的1b/2期临床试验,旨在评估其DPX平台开发的多肽疫苗 maveropepimut-S 联合 pembrolizumab 及环磷酰胺在复发性上皮性卵巢癌患者中的安全性和疗效。MVP-S递送来自survivin家族的抗原肽、一种先天免疫激活剂和一种通用的CD4阳性T细胞辅助肽,旨在诱导特异性细胞毒性T细胞反应。由于 survivin 在卵巢癌等肿瘤中高表达而在正常组织中几乎不表达,使其成为理想的免疫治疗靶点。
该研究共纳入47例患者,所有患者接受至少两年随访。ORR为24%,DCR达82%,中位缓解持续时间为5.5个月。值得注意的是,铂敏感患者的表现尤为突出,ORR达40%,DCR达90%。即使在铂耐药患者中,ORR也达16%,DCR为54%,优于标准单药化疗约11.8%的历史ORR。一名铂敏感患者实现CR并持续3年,其检测到的免疫应答长达195周。MVP-S在62%的可评估患者中成功诱导survivin特异性免疫应答,且该应答与93%患者的疾病控制相关。
同期事件:
1. 2026年第4周01.19-01.25国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2026年第4周01.19-01.25国内仿制药/生物类似物申报/审批数据分析
3. 2026年第4周01.19-01.25国内医药大健康行业政策法规汇总
以上内容均来自{ 摩熵咨询医药行业观察周报(2026.01.19-2026.01.25) },如需查看或下载完整版报告,可点击!
扩展阅读:
1. 2024年第31周07.29-08.04全球创新药研发概览
2. 2024年第26周06.24-06.30全球创新药研发概览
3. 2024年第17周04.15-04.21全球创新药研发概览
查数据,找摩熵!想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论