
1月29日,石药集团(01093)发布公告,公司的 SYS6055注射液 已获得中华人民共和国国家药品监督管理局(NMPA)批准,可以在中国开展临床试验。该产品为国内首款获批临床的体内CAR-T产品,具有通过慢病毒载体在体内直接生成靶向CD19的CAR-T细胞的能力,能够特异性识别和清除靶细胞,进而达到治疗目的。

临床前研究表明,SYS6055注射液 在抑瘤效果和安全性方面表现良好,并在成本、可及性和即时性等方面具备潜在优势。本次获批的临床适应症为复发/难治侵袭性B细胞淋巴瘤,此外,该产品还具备用于治疗其他CD19阳性的B细胞恶性肿瘤和自身免疫病的潜力,显示出较高的临床开发价值。
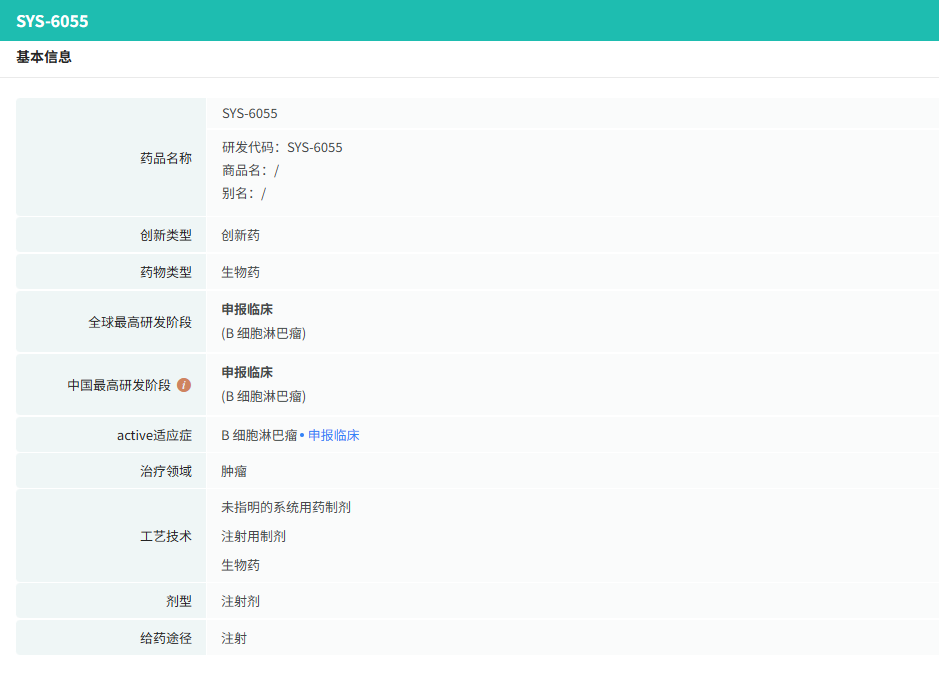
查数据,找摩熵!图源:摩熵医药数据库-全球药物研发数据库
2025年12月,公司一款用于晚期乳腺癌的紫杉烷类药物的 SYHX2011 获批上市,本次申请主要基于一项多中心、随机、双盲的关键Ⅲ期临床试验,入组人群为研究者根据中国临床肿瘤学会(CSCO)《乳腺癌诊疗指南(2022年版)》判断适合接受 注射用紫杉醇(白蛋白结合型)单药抗肿瘤治疗的乳腺癌患者。临床试验结果显示,该产品在晚期乳腺癌患者中较 注射用紫杉醇(白蛋白结合型)具有更显著的疗效获益:独立评审委员会(IRC)及研究者评估的客观缓解率组间比值分别为1.38(95%CI:1.040,1.842)和1.33(95%CI:1.020,1.745),均达到优效标准;疾病进展或死亡风险降低27%(无进展生存期(PFS)的风险比(HR)=0.73);死亡风险降低33%(总生存期(OS)的HR=0.67)。
在安全性方面,该产品的皮疹发生率风险降低62%,表明该产品在临床使用中安全性更高,有助于改善患者治疗期间的生活质量,并可能由此提升患者在治疗过程中的依从性;在临床应用方面,其配液时间显著缩短,解决了 注射用紫杉醇(白蛋白结合型)使用前配液操作复杂、复溶时间长的问题,从而大幅提高了临床使用的便利性。 凭借疗效、安全性及顺应性等方面的优势,该产品有望成为晚期乳腺癌治疗的新选择。同时,本集团也在推进该产品其他适应症的临床试验,以期为更多患者带来获益。
参考来源:
[1] 企业公告/官方披露
[2] 摩熵医药(原药融云)数据库
扩展阅读:
1. 石药集团战略转折深度剖析:AI赋能+出海提速,集采时代的跨国创新突围
2. 科弈药业CAR-T疗法IND获批,用于治疗多发性骨髓瘤
查数据,找摩熵!想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论