1.4.1 本周全球TOP10创新药研发进展
(1)美国FDA批准全球首款Menkes病疗法
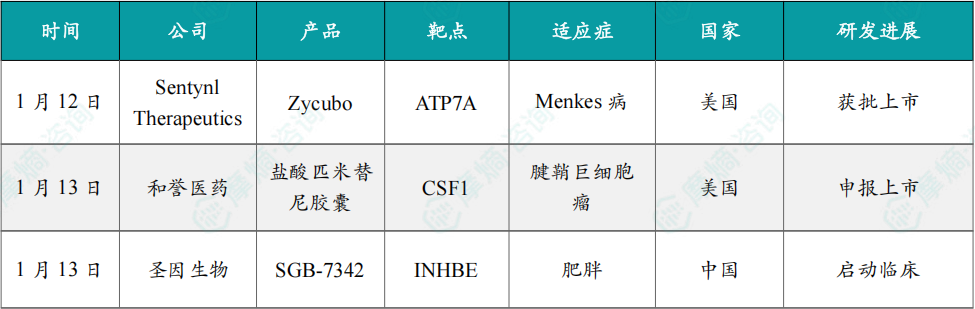
1月12日,美国FDA宣布,批准Sentynl Therapeutics公司开发的 Zycubo(组氨酸铜)注射液 上市。新闻稿指出,这是FDA批准的首个用于治疗Menkes病儿科患者的疗法。
Menkes病是一种由遗传缺陷引起的神经退行性疾病,该缺陷会损害儿童吸收铜元素的能力。患者的疾病特征包括癫痫发作、体重和身高增长不良、发育迟缓以及智力障碍,并可导致血管系统、膀胱、肠道、骨骼、肌肉和神经系统的异常。经典型Menkes病患者约占全部患者的90%,其症状通常在婴儿期出现,且大多数患者难以存活超过3岁。
Zycubo 是一种通过皮下注射给药的铜替代疗法。该药物可绕过肠道铜吸收遗传缺陷来递送铜元素,使机体能够更有效地利用这一矿物质。Zycubo 曾获得FDA授予的突破性疗法认定、快速通道资格、罕见儿科疾病认定和孤儿药资格,并获得欧洲药品管理局(EMA)授予的孤儿药资格。
(2)和誉医药小分子新药匹米替尼上市申请获美国FDA受理
1月13日,和誉医药宣布,其自主研发的新型、口服、高选择性且高效的小分子集落刺激因子1受体(CSF-1R)抑制剂 盐酸匹米替尼胶囊 用于腱鞘巨细胞瘤(TGCT)患者系统性治疗的新药申请(NDA)已获美国FDA正式受理。
盐酸匹米替尼胶囊 由和誉医药自主研发,并授权德国默克(Merck KGaA)公司负责其在全球的商业化。2025年12月,该产品获中国国家药品监督管理局(NMPA)批准上市,用于手术切除可能会导致功能受限或出现较严重并发症的症状性TGCT成年患者。目前,该产品在其他市场的上市申请正由相关监管机构审评中。
(3)圣因生物siRNA新药启动中国1期临床研究,治疗超重和肥胖
1月13日,圣因生物宣布,其自主研发的小干扰RNA(siRNA)候选药物 SGB-7342 在治疗肥胖症的中国1期临床研究中,于吉林大学第一医院完成首例受试者给药。
该项随机、双盲、安慰剂对照、单次给药剂量递增的1期临床研究,旨在评价 SGB-7342 在超重和肥胖患者中的安全性、耐受性、药代动力学及药效学特征。
SGB-7342 是一款靶向抑制素βE亚基(INHBE)用于治疗肥胖症的siRNA候选药物,采用圣因生物专有的GalNAc偶联递送技术和化学修饰技术进行开发。该平台技术已在公司多款在研siRNA药物的1期临床试验中展现出临床应用潜力。
(4)石药集团高血压新药SYH2072片在美国获批临床
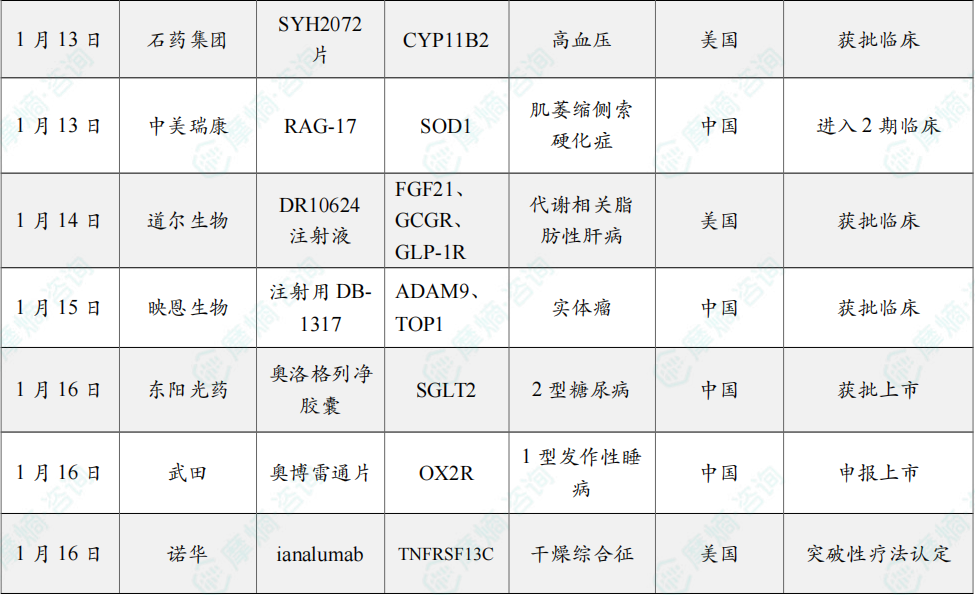
1月13日,石药集团宣布,其开发的化药1类新药强效醛固酮合成酶抑制剂(SYH2072片)已获得美国FDA批准,可在美国开展临床试验,临床适应症为未控制高血压和难治性高血压。该产品亦已于2025年12月在中国获批临床,拟定适应症为未控制高血压、原发性醛固酮增多症。
SYH2072片 是一种高选择性强效醛固酮合成酶抑制剂(ASI),可有效降低血浆醛固酮水平,且不影响皮质醇水平。
临床前研究显示,该产品可选择性抑制醛固酮合成酶的活性,在动物疾病模型中显著降低血浆醛固酮水平,并剂量依赖性地降低高血压模型的血压,同时不影响皮质醇水平,该产品具有良好的药代动力学(PK)特性和安全性。
(5)中美瑞康siRNA新药进入2期临床阶段,治疗“渐冻症”
1月13日,中美瑞康宣布,其自主研发的靶向SOD1突变型肌萎缩侧索硬化症(ALS,俗称“渐冻症”)的创新siRNA疗法 RAG-17,已于浙江大学医学院附属第二医院完成2期临床试验首例患者给药。
此项多中心2期临床试验是一项多次给药、剂量递增(MAD)的随机、双盲、安慰剂对照研究,旨在评估携带SOD1基因突变的ALS受试者接受鞘内注射 RAG-17 重复给药的安全性/耐受性、PK、PD和初步疗效。
中美瑞康新闻稿表示,这一里程碑标志着该项研究正式进入2期阶段。此次启动2期MAD阶段是基于已顺利完成的1期单次剂量递增(SAD)研究的积极结果。SAD研究数据显示出 RAG-17 单次给药后较好的安全性和持久的生物标志物调节作用,包括脑脊液(CSF)SOD1蛋白的显著降低以及血浆神经丝轻链(NfL)水平的改善。这些结果有力地验证了该公司SCAD™递送平台在人体中实现中枢神经系统(CNS)靶向递送的能力。
(6)道尔生物三靶点激动剂在美国获批临床,针对代谢相关脂肪性肝病
1月14日,华东医药宣布控股子公司道尔生物收到美国FDA通知,由道尔生物申报的 DR10624注射液 药品临床试验申请已获得美国FDA批准,可在美国开展临床试验,适应症为代谢相关脂肪性肝病(MASLD)。
DR10624 是道尔生物自主研发的靶向成纤维细胞生长因子21受体(FGF21R)、胰高血糖素受体(GCGR)和胰高血糖素样肽-1受体(GLP-1R)的长效三特异性激动剂。该产品由N端靶向GLP-1R/GCGR的嵌合肽段与工程化改造的IgG1 Fc融合,并在Fc的C末端融合重组的FGF21突变体。
DR10624注射液 目前已成功完成重度高甘油三酯血症(SHTG)的2期临床研究并获得揭盲后的阳性顶线结果。2026年1月,DR10624 被中国国家药品监督管理局药品审评中心(CDE)纳入突破性治疗品种,拟定适应症为重度高甘油三酯血症。
(7)映恩生物ADAM9靶向ADC癌症新药在中国获批临床
1月15日,中国国家药监局药品审评中心(CDE)官网显示,映恩生物申报的1类新药 注射用DB-1317 获批临床,拟开发治疗晚期/转移性恶性实体瘤。
根据映恩生物公开资料,这是一款ADAM9靶向抗体偶联药物(ADC)。该产品的全球1a/1b期临床研究此前已在澳大利亚开展,并获得美国FDA的新药临床试验(IND)批准。
DB-1317 是映恩生物依托自主研发的ADC技术平台DITAC开发的新一代ADC产品,载荷为拓扑异构酶I抑制剂。其靶点ADAM9在胃癌、结直肠癌和胰腺癌等多种消化道肿瘤中高表达,而在正常组织中低表达。
临床前数据显示,DB-1317 在胃癌和结直肠癌等多种消化道肿瘤模型中表现出显著的抗肿瘤活性,显示出广阔的临床转化潜力。
(8)东阳光药宣布1类降糖创新药在中国获批
1月16日,东阳光药宣布,其自主研发的1类创新药 奥洛格列净胶囊 获中国国家药品监督管理局(NMPA)批准上市,可单药或联合二甲双胍用于改善成人2型糖尿病(T2DM)患者的血糖控制。
钠-葡萄糖共转运蛋白2抑制剂(SGLT-2i)是一类近年受到高度重视的新型口服降糖药物,主要通过抑制肾脏葡萄糖的重吸收,降低肾糖阈,促进尿糖排出,降低血糖水平。
奥洛格列净 是一款SGLT1适度抑制的SGLT2抑制剂创新药,可通过强效抑制肾脏SGLT2受体促进尿糖排泄,并凭借其适度的肠道SGLT1受体减少葡萄糖或半乳糖吸收,有效降低餐后血糖剧烈波动,实现对空腹及餐后血糖的“全程、双通道”的协同控制,契合2型糖尿病“全面控糖”的临床治疗理念。
(9)武田1类新药奥博雷通片在中国申报上市
1月16日,中国国家药监局药品审评中心(CDE)官网最新公示显示,武田(Takeda)申报的1类新药 奥博雷通片 上市申请获得受理。
公开资料显示,这是武田研发的口服选择性食欲素2型受体(OX2R)激动剂 oveporexton(研发代号:TAK-861)。该产品此前已经被CDE纳入突破性治疗品种,针对1型发作性睡病(NT1)适应症。其针对NT1适应症的两项3期关键性研究已经达到所有主要和次要终点。在刚刚结束的2026年JPM大会上,武田披露该产品预计于2026年下半年获监管机构批准上市。
据武田公开资料介绍,该公司拥有多元化食欲素产品管线。食欲素是睡眠与觉醒模式的关键调节因子,同时还参与调节注意力、情绪、代谢和呼吸等重要功能。Oveporexton 是武田食欲素产品线中主要的在研OX2R激动剂,拟用于1型发作性睡病的治疗,针对该适应症已被美国FDA与中国CDE授予突破性治疗。
(10)诺华单抗ianalumab获FDA突破性疗法认定,用于治疗干燥综合征
1月16日,诺华(Novartis)宣布,其在研药物 ianalumab 已获得美国FDA授予突破性疗法认定,用于治疗干燥综合征。
Ianalumab 是一款全人源单克隆抗体,可通过阻断BAFF受体(BAFF-R)同时实现B细胞清除,并抑制其激活与存活。诺华计划自2026年初起在全球范围内递交 ianalumab 的上市申请。根据新闻稿,若顺利获批,该药物有望成为首款针对干燥综合征的靶向治疗方案。
此次突破性疗法认定主要基于 ianalumab 在两项全球多中心3期关键性临床试验NEPTUNUS-1和NEPTUNUS-2中的积极结果。研究评估了 ianalumab 在干燥综合征患者中的疗效与安全性,结果显示,该药物在改善疾病活动度、减轻患者疾病负担方面均带来了具有临床意义的获益。同时,ianalumab 在两项研究中均展现出良好的安全性,其不良事件及严重不良事件的总体发生率与安慰剂相当。
1.4.2 本周全球TOP10积极/失败临床结果
(1)百时美施贵宝别构心肌肌球蛋白抑制剂3期临床试验结果积极
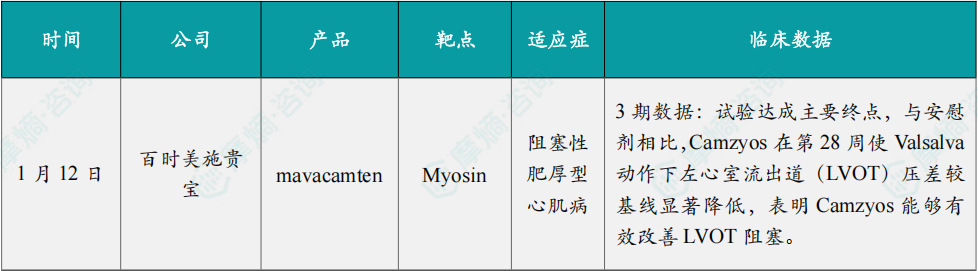
1月12日,百时美施贵宝(Bristol Myers Squibb)公布了3期临床试验SCOUT-HCM的积极顶线结果。该研究评估了 Camzyos(mavacamten)在青少年(12岁至18岁)有症状阻塞性肥厚型心肌病(oHCM)患者中的疗效。试验达成主要终点,与安慰剂相比,Camzyos 在第28周使Valsalva动作下左心室流出道(LVOT)压差较基线显著降低,表明 Camzyos 能够有效改善LVOT阻塞。多项次要终点同样达到统计学显著性,包括反映疾病临床意义的重要指标。该试验中的安全性结果与 Camzyos 在成人中的既往安全性特征一致,在这一更年轻的人群中未发现新的安全性信号。
作为一种选择性、可逆的别构心肌肌球蛋白抑制剂,Camzyos 通过减少动态LVOT阻塞、改善心脏充盈压,从而靶向肥厚型心肌病(HCM)的病理生理机制。Camzyos 既可单独使用,也可在既往基础治疗的基础上使用,包括用于新近确诊的患者。
(2)凌科药业公布JAK1抑制剂治疗类风湿关节炎3期临床结果
1月12日,凌科药业宣布其核心产品 泽普昔替尼(LNK01001)在治疗中重度活动性类风湿关节炎(RA)的3期临床研究中取得积极的顶线数据。
研究显示,在主要及关键次要疗效终点上,泽普昔替尼较安慰剂均显示出具有统计学意义的疗效差异,并展现出良好的安全性和耐受性。泽普昔替尼是一款高选择性的第二代JAK1抑制剂,适用于类风湿关节炎、强直性脊柱炎、特应性皮炎及白癜风适应症。2022年3月,凌科药业与先声药业达成商业化合作,共同推进 泽普昔替尼 在大中华区用于类风湿关节炎及强直性脊柱炎的销售与市场推广。
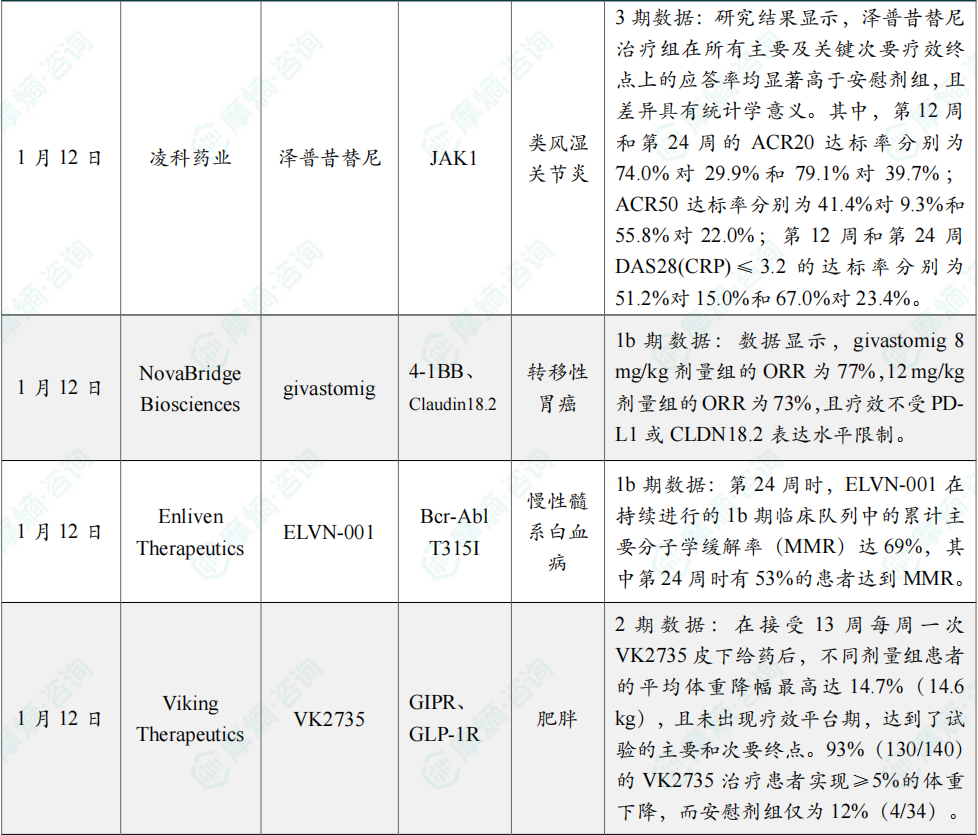
研究结果显示,泽普昔替尼 治疗组在所有主要及关键次要疗效终点上的应答率均显著高于安慰剂组,且差异具有统计学意义。其中,第12周和第24周的ACR20达标率分别为74.0%对29.9%和79.1%对39.7%;ACR50达标率分别为41.4%对9.3%和55.8%对22.0%;第12周和第24周DAS28(CRP)≤3.2的达标率分别为51.2%对15.0%和67.0%对23.4%。在安全性方面,泽普昔替尼 整体耐受性良好。
(3)NovaBridge Biosciences公布givastomig的1b期联合治疗试验新数据
1月12日,NovaBridge Biosciences公司公布了双特异性抗体 givastomig 的1b期联合治疗试验的新数据。
Givastomig 是一种靶向Claudin 18.2(CLDN18.2)阳性肿瘤细胞的双特异性抗体,在表达Claudin 18.2的肿瘤微环境中通过4-1BB信号通路有条件地激活T细胞。该药由NovaBridge公司牵头与ABL Bio公司共同开发,两方平等共享除大中华区和韩国以外的全球权益。目前,givastomig 正在开发用于潜在治疗胃癌及其他Claudin 18.2阳性胃肠道恶性肿瘤。
截至2025年12月2日的数据,54例Claudin 18.2阳性晚期转移性胃癌患者接受了不同剂量的 givastomig 联合 nivolumab 和 mFOLFOX6 作为一线治疗,其中52例患者疗效可评估。
数据显示,givastomig 8 mg/kg剂量组的ORR为77%,12 mg/kg剂量组的ORR为73%,且疗效不受PD-L1或CLDN18.2表达水平限制。8 mg/kg剂量组的中位无进展生存期(PFS)为16.9个月,而12 mg/kg剂量组因随访时间短约4个月,中位PFS数据尚未成熟,但该组6个月的无进展生存率达91%,8 mg/kg剂量组的这一数据为73%。该联合方案安全性良好,与当前标准治疗相当。
(4)Enliven Therapeutics公布ELVN-001的1b期临床数据
1月12日,Enliven Therapeutics公司公布其小分子激酶抑制剂 ELVN-001 的1b期ENABLE临床试验数据,该研究旨在评估ELVN-001对现有酪氨酸激酶抑制剂(TKI)不耐受、复发或难治的慢性髓系白血病(CML)患者的疗效。
ELVN-001 是一种强效、高选择性、潜在“best-in-class”的小分子激酶抑制剂,专门针对CML患者的致癌驱动因子BCR-ABL融合蛋白。ELVN-001 还具有针对耐药性最强的BCR-ABL1耐药突变体T315I和其他已知耐药突变体的活性。
截至2025年12月22日的数据,第24周时,ELVN-001 在持续进行的1b期临床队列中的累计主要分子学缓解率(MMR)达69%,其中第24周时有53%的患者达到MMR。该药物在所有已评估剂量水平下均展现出良好的安全性和耐受性,与既往报道数据一致。
(5)Viking Therapeutics宣布VK2735的2期临床数据在《肥胖》(Obesity)期刊上发表
1月12日,Viking Therapeutics公司宣布,其在研多肽疗法 VK2735 用于治疗肥胖的2期临床试验VENTURE的结果已在《肥胖》(Obesity)期刊上发表。该药物是一种葡萄糖依赖性促胰岛素多肽(GIP)和GLP-1受体双重激动剂,目前正以口服和皮下注射两种剂型开发,用于治疗包括肥胖在内的多种代谢性疾病。
该临床试验的结果显示,在接受13周每周一次 VK2735 皮下给药后,不同剂量组患者的平均体重降幅最高达14.7%(14.6 kg),且未出现疗效平台期,达到了试验的主要和次要终点。93%(130/140)的 VK2735 治疗患者实现≥5%的体重下降,而安慰剂组仅为12%(4/34)。安全性方面,VK2735 总体耐受良好,大多数不良事件为轻度或中度。与安慰剂组相比,治疗组的停药率和研究退出率相当。
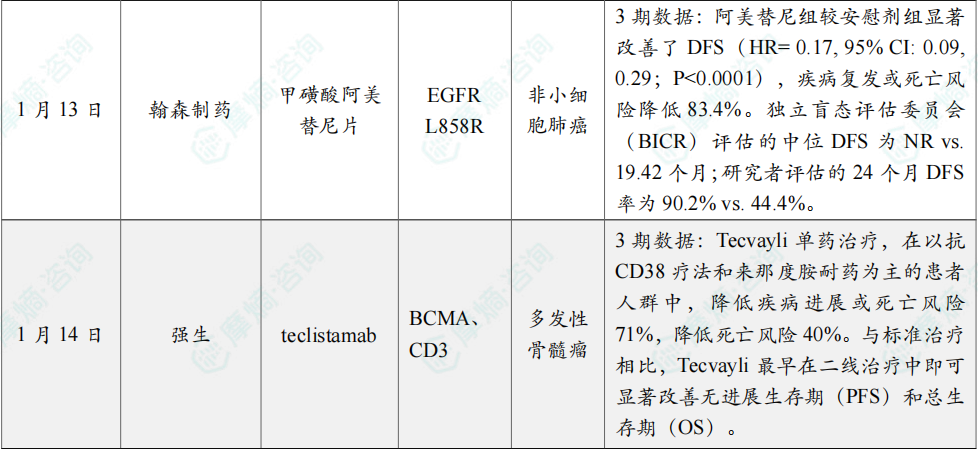
(6)翰森制药创新药阿美替尼3期临床最新数据荣登国际顶刊
1月13日,翰森制药宣布国际顶级肿瘤学期刊《Lancet Oncology》(中文译名:《柳叶刀·肿瘤学》,影响因子:35.9)在线重磅发布了翰森制药创新药 阿美乐®(甲磺酸阿美替尼片,110mg)用于EGFR突变非小细胞肺癌辅助治疗的最新研究结果。数据显示,阿美乐® 能够显著改善完全切除的Ⅱ-ⅢB期EGFR突变NSCLC患者的无病生存期(DFS),且安全性良好。
该研究名为ARTS研究,是首个专注于中国可手术EGFR突变NSCLC患者的Ⅲ期临床试验,在中国48个中心随机、对照、双盲开展,旨在评估 阿美替尼 对比安慰剂在接受肿瘤完全切除术和标准辅助治疗后无疾病进展的EGFR敏感突变阳性的Ⅱ-ⅢB期NSCLC患者中的有效性和安全性。研究共纳入214例患者(阿美替尼组和安慰剂组各107例)。两组基线特征均衡,中位年龄59岁;45%患者的术后病理分期为Ⅱ期,47%的患者为ⅢA期;51%的患者EGFR突变类型为L858R,49%患者的EGFR突变类型为Ex19del。
结果显示,阿美替尼组较安慰剂组显著改善了DFS(HR= 0.17, 95% CI: 0.09, 0.29;P<0.0001),疾病复发或死亡风险降低83.4%。独立盲态评估委员会(BICR)评估的中位DFS为NR vs. 19.42个月;研究者评估的24个月DFS率为90.2% vs. 44.4%。安全性方面,不良事件以1-2级为主,任何导致停药的不良反应发生率仅为0.9%,整体安全性可管理,耐受性良好。
(7)强生双抗疗法3期临床结果积极,治疗多发性骨髓瘤
1月14日,强生公司(Johnson & Johnson)宣布,其3期临床试验MajesTEC-9取得积极的顶线结果。MajesTEC-9研究比较了 Tecvayli(teclistamab)与标准治疗方案在既往接受过1至3线治疗的复发/难治性多发性骨髓瘤患者中的疗效和安全性。
数据显示,Tecvayli 单药治疗,在以抗CD38疗法和来那度胺耐药为主的患者人群中,降低疾病进展或死亡风险71%,降低死亡风险40%。与标准治疗相比,Tecvayli 最早在二线治疗中即可显著改善无进展生存期(PFS)和总生存期(OS)。
Tecvayli 是一款“first-in-class”双特异性T细胞衔接器,通过同时结合表达于T细胞表面的CD3受体,以及表达于多发性骨髓瘤细胞和部分健康B系细胞表面的B细胞成熟抗原(BCMA),从而激活免疫系统。
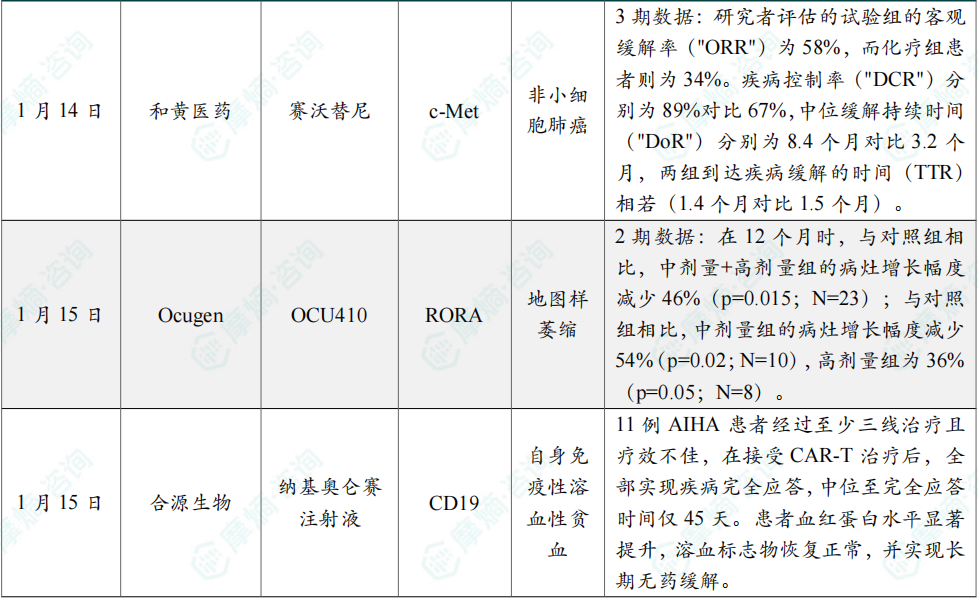
(8)和黄医药宣布SACHI III期研究结果于《柳叶刀 (The Lancet)》发表
1月14日,和黄医药(中国)有限公司宣布SACHI III期研究的结果于《柳叶刀 (The Lancet)》发表。SACHI是一项 赛沃替尼 (沃瑞沙®) 和 奥希替尼 (泰瑞沙®) 的联合疗法用于治疗伴有MET扩增的接受一线表皮生长因子受体 ("EGFR") 酪氨酸激酶抑制剂 ("TKI") 治疗后疾病进展的EGFR突变阳性局部晚期或转移性非小细胞肺癌患者的III期研究。
在意向治疗(intention-to-treat, "ITT")人群中,研究者评估的 赛沃替尼 和 奥希替尼 联合疗法组的中位PFS为8.2个月,而化疗组则为4.5个月。独立审查委员会("IRC")评估的中位PFS分别为7.2个月和4.2个月。疗效方面:研究者评估的试验组的客观缓解率("ORR")为58%,而化疗组患者则为34%。疾病控制率("DCR")分别为89%对比67%,中位缓解持续时间("DoR")分别为8.4个月对比3.2个月,两组到达疾病缓解的时间(TTR)相若(1.4个月对比1.5个月)。
安全性方面:联合疗法展示出可耐受的安全性,试验组组患者发生3级或以上治疗期间不良事件("TEAE")的比例为57%,而化疗组为57%(55/96)。常见的3级或以上TEAE(各组中发生率≥10%)包括中性粒细胞计数减少(14%对比26%)、白细胞计数减少(7%对比13%)和贫血(4% vs 23%)。
(9)Ocugen公布基因疗法2期临床试验初步结果,治疗地图样萎缩
1月15日,Ocugen宣布,其2期临床试验ArMaDa获得积极的12个月初步数据。该研究评估的 OCU410(AAV5-RORA)是一款经玻璃体腔内给药的在研AAV5基因疗法,可递送表达视黄酸相关孤儿受体α(RORA)的转基因。RORA是一种核受体,调控多条与视网膜稳态相关的关键通路,包括氧化应激反应、补体调节、炎症和脂质代谢。
OCU410 正被开发为一种一次性基因疗法,用于治疗继发于干性年龄相关性黄斑变性(dAMD)的地图样萎缩(GA)患者。2期临床试验的关键结果包括:在12个月时,与对照组相比,中剂量+高剂量组的病灶增长幅度减少46%(p=0.015;N=23);与对照组相比,中剂量组的病灶增长幅度减少54%(p=0.02;N=10),高剂量组为36%(p=0.05;N=8)。安全性方面,目前尚未在OCU410的1期和2期临床试验中发现严重不良事件。
(10)合源生物纳基奥仑赛注射液治疗自身免疫性溶血性贫血临床数据荣登《新英格兰医学杂志》
1月15日,《新英格兰医学杂志》(The New England Journal of Medicine, NEJM)重磅发表了中国医学科学院血液病医院(中国医学科学院血液学研究所)施均教授团队领衔的CD19 CAR-T细胞治疗自身免疫性溶血性贫血(AIHA)临床研究论文。该研究中应用了合源生物自主研发的 纳基奥仑赛注射液(商品名:源瑞达®),在全球范围内首次证实CD19 CAR-T疗法在AIHA领域的突破性疗效,为广大难治/复发AIHA患者带来全新治疗希望。
此次发表的研究结果显示,11例AIHA患者经过至少三线治疗且疗效不佳,在接受CAR-T治疗后,全部实现疾病完全应答,中位至完全应答时间仅45天。患者血红蛋白水平显著提升,溶血标志物恢复正常,并实现长期无药缓解。这一成果不仅验证了 纳基奥仑赛注射液 卓越的临床价值,更推动了AIHA治疗机制的认知突破。
同期事件:
1. 2026年第3周01.12-01.18国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2026年第3周01.12-01.18国内仿制药/生物类似物申报/审批数据分析
3. 2026年第3周01.12-01.18国内医药大健康行业政策法规汇总
以上内容均来自{ 摩熵咨询医药行业观察周报(2026.01.12-2026.01.18) },如需查看或下载完整版报告,可点击!
扩展阅读:
1. 2024年第34周08.19-08.25全球创新药研发概览
2. 2024年第27周07.01-07.07全球创新药研发概览
3. 2024年第22周05.27-06.02全球创新药研发概览
查数据,找摩熵!想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论