
近日,艾伯维(AbbVie)与Genmab联合研发的CD3×CD20 T细胞结合双特异性抗体 Epkinly(epcoritamab-bysp)在针对弥漫性大B细胞淋巴瘤(DLBCL)患者的III期临床试验中公布了阶段性结果。数据显示,该研究在主要终点与次要终点的表现呈现分化,引发市场与行业关注。

截图来源:艾伯维官网
根据双方发布的信息,这项名为EPCORE DLBCL-1的III期全球多中心研究,共纳入483例复发/难治性(R/R)DLBCL患者。入组患者均既往接受过至少一线治疗(其中73%患者接受过两线及以上治疗),且因身体条件限制不适合接受大剂量化疗联合自体干细胞移植(HDT-ASCT)。
核心数据:PFS改善,OS未达统计学显著性
研究初步结果显示,Epkinly 在主要终点总生存期(OS)上未实现统计学意义的改善(风险比[HR]为0.96)。作为评估抗肿瘤药物临床价值的核心指标,OS的未达标意味着该药在延长患者生存周期方面的直接证据尚不充分。
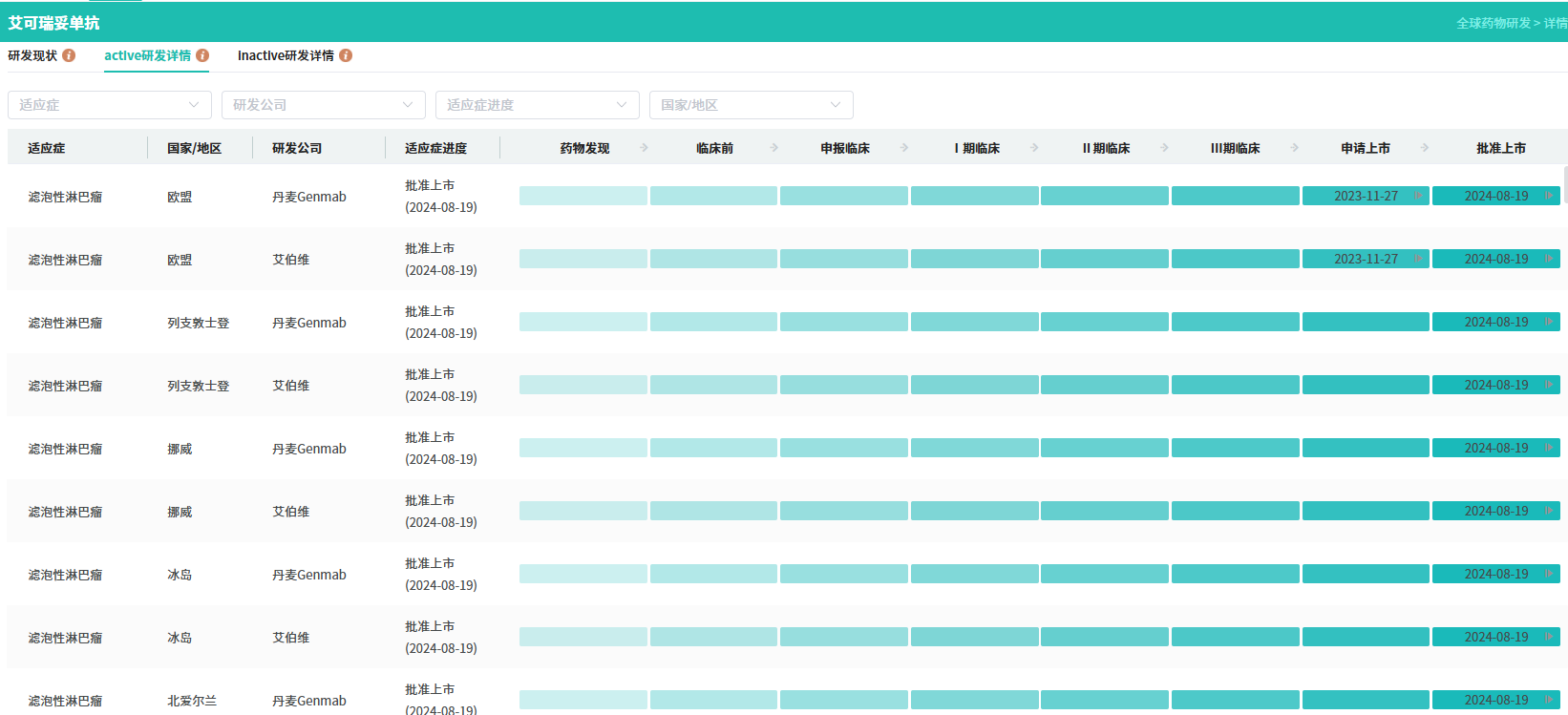
查数据,找摩熵!图源:摩熵医药数据库-全球药物研发数据库
值得关注的是,研究在关键次要终点无进展生存期(PFS)上取得积极结果:患者疾病进展或死亡风险较对照组降低26%,PFS得到显著改善。此外,完全缓解率(CRR)、缓解持续时间(DoR)等多项次要疗效指标亦呈现正向趋势。艾伯维在新闻稿中特别指出,这是全球首个证实CD3×CD20 T细胞双特异性单药治疗可改善R/R DLBCL患者PFS的III期研究,为双抗技术在该适应症的临床应用提供了关键循证支持。
背景回顾:从加速批准到确证性试验
Epkinly 基于Genmab的DuoBody平台开发,采用皮下注射给药方式,于2023年获美国FDA加速批准用于R/R DLBCL,后续扩展至滤泡性淋巴瘤(FL)二线治疗。
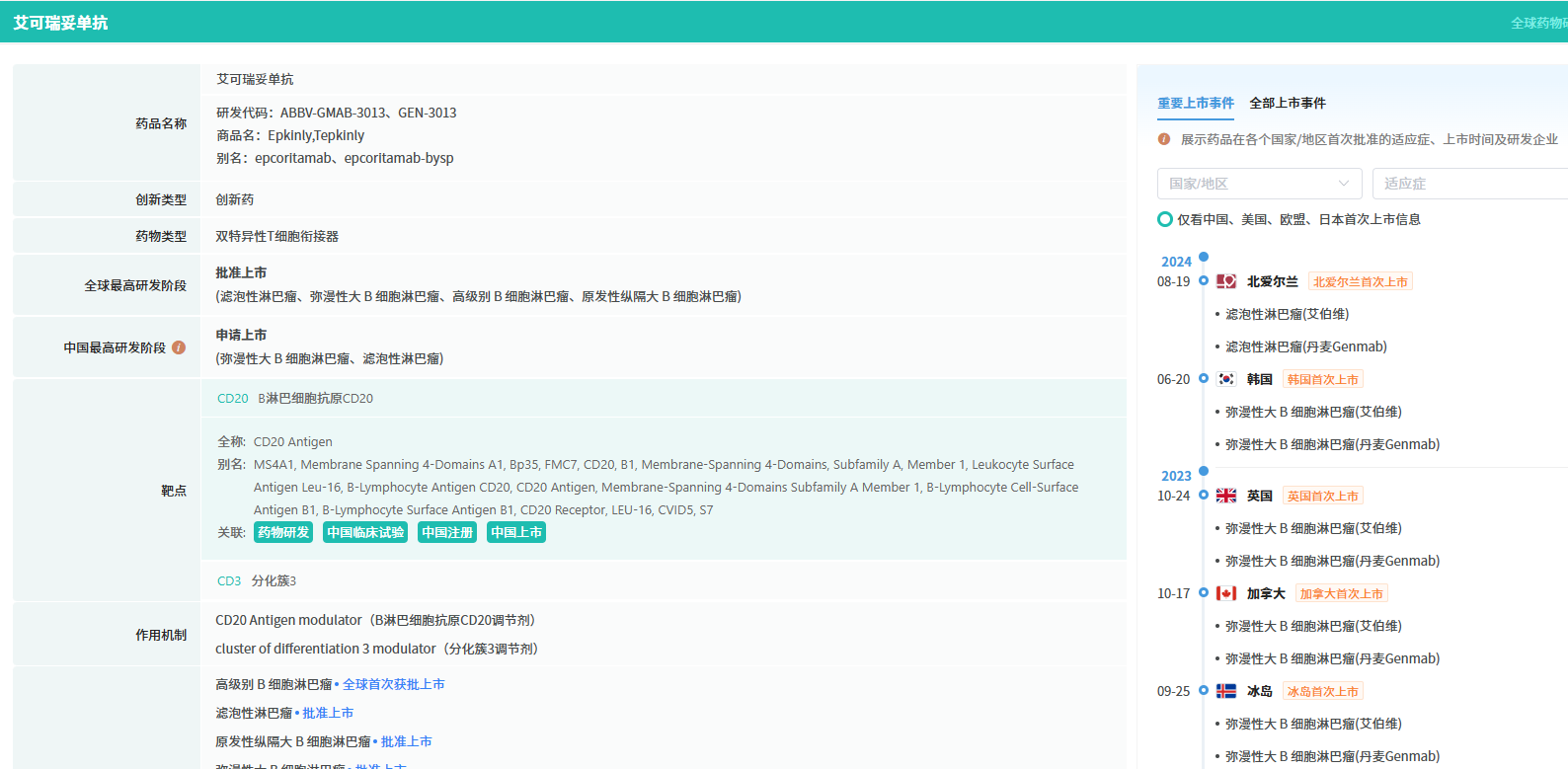
查数据,找摩熵!图源:摩熵医药-全球药物研发数据库
其加速批准主要基于I/II期EPCORE NHL-1试验数据:总缓解率(ORR)61%,完全缓解率(CRR)38%,中位缓解持续时间(DoR)15.6个月。此次III期试验旨在为该药的临床获益提供确证性证据。
市场反应与后续计划
受临床结果影响,Genmab股价在消息公布后下跌约5%,艾伯维股价亦出现小幅波动。目前,EPCORE DLBCL-1试验仍在进行中,完整数据待后续分析。艾伯维与Genmab表示,正综合评估多项潜在影响因素,包括试验期间Omicron变异株感染高峰对入组及随访的干扰(当时疫苗尚未广泛普及),以及研究周期内CAR-T、抗体偶联药物(ADC)等新型抗淋巴瘤疗法的普及对患者后续治疗选择的影响。双方计划与全球监管机构进一步沟通,以确定该药的后续注册与标签更新策略。
作为血液瘤领域备受关注的双特异性抗体,Epkinly 的III期结果既验证了其在疾病控制方面的潜力,也凸显了单药治疗在延长生存周期上的挑战。随着试验推进及更多数据披露,其临床定位与市场前景或将进一步明确。
参考来源:
[1] 企业官网/官方披露
[2] 摩熵医药(原药融云)数据库
扩展阅读:
1. 艾伯维:CD3/CD20双抗艾可瑞妥单抗c获CDE受理
2. 艾伯维因精神分裂症药Emraclidine临床试验受挫股价暴跌,BMS竞品股价飙升
查数据,找摩熵!想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论