
1月16日,国家药品监督管理局药品审评中心(CDE)官网发布信息,康方生物自主研发的1类新药——古莫奇单抗注射液,提交了一项新适应症的上市申请并已获受理。结合该药物当前的研究进展,此次申请的新适应症极有可能是活动性强直性脊柱炎。
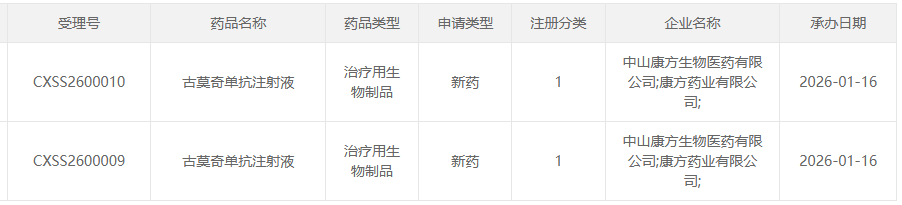
截图来源:CDE官网
一、古莫奇单抗:靶向关键因子的创新利器
古莫奇单抗 是康方生物科研团队精心钻研的成果,属于新型人源化IL - 17(白介素 - 17)单克隆抗体。在人体的免疫系统中,IL - 17是一个不容忽视的角色。它主要由活化的Th17细胞(辅助性T细胞17)分泌产生,是一种典型的促炎性细胞因子。当IL - 17与细胞表面的受体(IL - 17R)成功结合后,就会如同触发了一个“炎症开关”,介导一系列复杂的免疫炎症反应。而银屑病和强直性脊柱炎这两种令人困扰的疾病,其发病机理中IL - 17就起着关键作用,它就像一个“幕后黑手”,推动着疾病的不断发展和恶化。
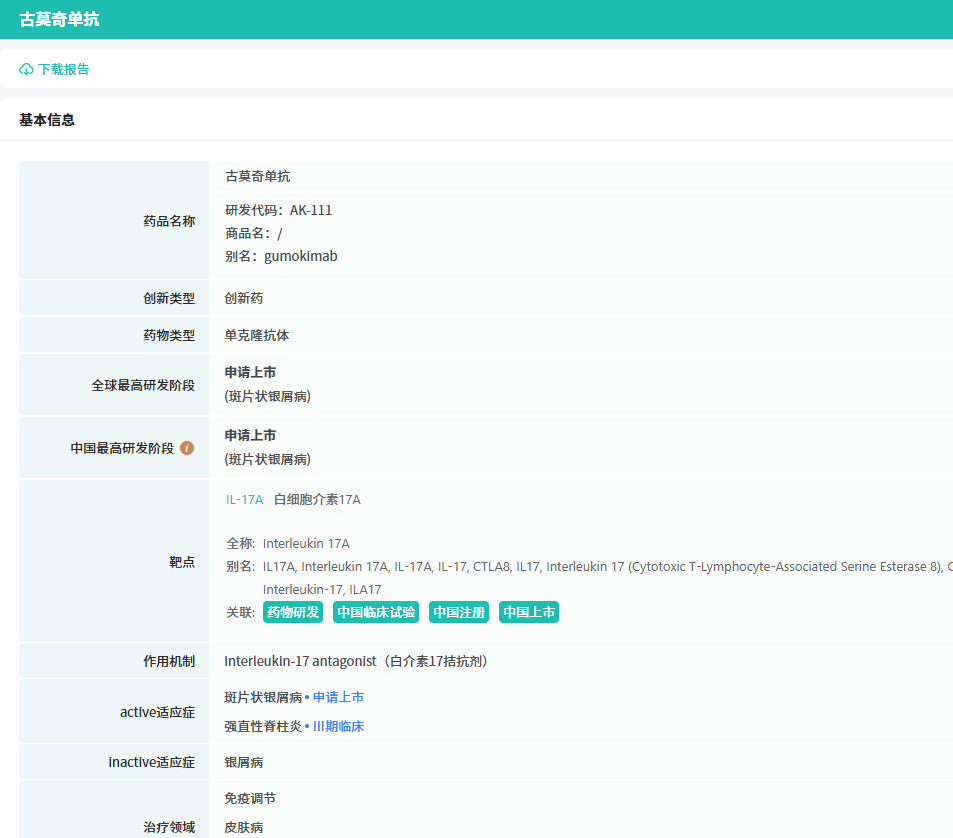
查数据,找摩熵!图源:摩熵医药数据库-全球药物研发数据库
古莫奇单抗 则像是一位精准的“狙击手”,它能够特异性地与IL - 17紧密结合。这种结合就像是为IL - 17戴上了一个“枷锁”,有效阻断了IL - 17与IL - 17R介导的信号传导通路。一旦这条通路被阻断,相关的免疫炎症反应就无法顺利发生和发展,从而达到治疗疾病的目的。基于这一独特的作用机制,古莫奇单抗 被寄予厚望,有望成为治疗银屑病、强直性脊柱炎等自身免疫性疾病的有力武器。
二、研发历程:稳步推进,成果初现
时间来到2025年1月,古莫奇单抗 迎来了其研发道路上的一个重要里程碑——它的首个上市申请获得了CDE的受理。此次申请针对的是中、重度斑块状银屑病的治疗,目前该申请正处于紧张的审评阶段,众多患者和医疗界人士都在翘首以盼审评结果的公布。而此次提交的新适应症上市申请,则是 古莫奇单抗 在研发征程中的又一次重要跨越。

查数据,找摩熵!图源:摩熵医药-全球药物研发数据库
在2025年8月,康方生物向外界宣布了一个振奋人心的消息:古莫奇单抗 在治疗活动性强直性脊柱炎(AS)的关键注册性Ⅲ期临床研究中取得了令人瞩目的阳性结果。这一结果可不是简单的“达标”,而是全方位的“优秀”。主要疗效终点ASAS20及亚组分析、关键次要终点ASAS40,以及其他预先选定的多个次要终点均成功达成。这些数据不仅具有统计学上的显著性,更在临床意义上为患者带来了实实在在的改善。
研究表明,古莫奇单抗 能够高效且快速地缓解活动性强直性脊柱炎患者的症状,让患者原本因疾病而痛苦不堪的身体得到舒缓。同时,它还能显著改善患者的疾病活动度,使患者的身体机能逐渐恢复正常。更重要的是,患者的躯体功能和生活质量也得到了极大的提升,让他们能够重新拥抱美好的生活。
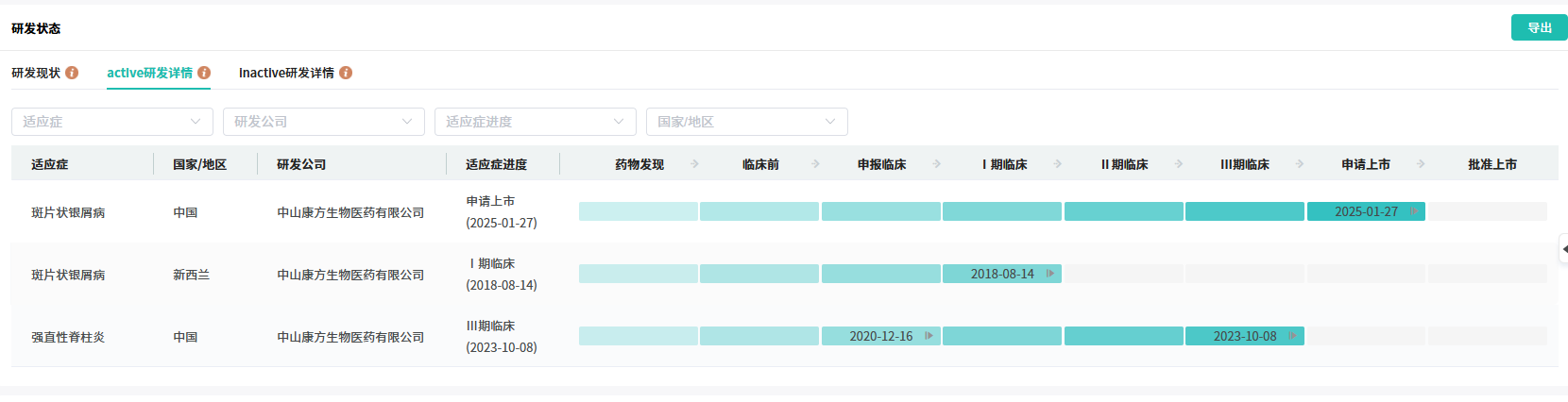
查数据,找摩熵!图源:摩熵医药-全球药物研发数据库
三、行业地位:创新药研发的中坚力量
古莫奇单抗 的成功并非偶然,它是康方生物在创新药物研发领域长期深耕细作的结果。截至目前,古莫奇单抗 已经是康方生物自主研发的第8个成功递交上市申请的创新药物。这一数字的背后,是康方生物科研团队无数个日夜的辛勤付出和不懈努力。
而且,古莫奇单抗 还有着更为特殊的意义。它是继 伊努西单抗 和 依若奇单抗 之后,康方生物在非肿瘤领域成功推进至上市阶段的第3个1类创新药。在非肿瘤领域的创新药物研发往往面临着更多的挑战和困难,但康方生物凭借着其强大的科研实力和创新能力,一次次突破难关,为患者带来了新的希望。古莫奇单抗 的出现,不仅丰富了非肿瘤领域自身免疫性疾病的治疗手段,也为康方生物在创新药研发领域树立了新的标杆,彰显了其在行业内的中坚地位。
随着 古莫奇单抗 新适应症上市申请的受理,我们有理由相信,在不久的将来,这款创新药物将为更多活动性强直性脊柱炎患者带来福音,开启他们健康生活的新篇章。同时,也期待康方生物在创新药物研发的道路上继续砥砺前行,创造更多的辉煌。
参考来源:
[1] CDE官网
[2] 摩熵医药(原药融云)数据库
扩展阅读:
1. 康方生物「依沃西单抗」新适应症申报上市,治疗非小细胞肺癌!
2. 康方生物依沃西:全球首创PD-1/VEGF双抗,III期临床力压帕博利珠单抗!
3. 康方生物依沃西单抗击败全球'药王'K药,肺癌治疗迎来划时代突破!
查数据,找摩熵!想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论