
在2型糖尿病(T2DM)这个庞大的慢病战场上,我们拥有了越来越多的武器。然而,横亘在疗效与现实之间最大的鸿沟,往往不是药物本身的效力,而是患者的“依从性”。
在21世纪初,以西格列汀(Sitagliptin)为代表的DPP-4抑制剂横空出世,凭借其良好的耐受性和不引起低血糖、不增加体重的优势,迅速成为了口服降糖药市场的中流砥柱。但它们大多仍未能摆脱“一日一次”的桎梏。

默克公司的研发团队敏锐地捕捉到了这一未被满足的临床痛点:如果我们能开发出一种药物,只需一周服用一次,就能达到每日服药的疗效,那将极大地解放患者,重塑治疗格局。
这不仅仅是剂型的改变,更是一场向人体代谢速率发起的极限挑战。奥格列汀(Omarigliptin, MK-3102)的故事,就是这场挑战中最精彩的篇章。该药在药物化学上取得了巨大成功,克服了毒性与代谢难题,并于2015年9月在日本率先获批上市。然而,仅一年后,默克在三期临床数据积极的情况下,出人意料地叫停了其在欧美市场的开发。这一“技术成功但商业撤退”的案例,折射出糖尿病赛道竞争逻辑与价值取向的剧烈变革。
一、奥格列汀的药物化学与分子进化
要理解奥格列汀的价值及其后的战略放弃,首先必须深入其科学内核,理解研发团队是如何在分子水平上通过精密的结构修饰来平衡药效、安全性和代谢稳定性的。这一过程是药物研发“设计-合成-测试-分析”(DMTA)循环的经典案例。
1. 起点:西格列汀的晶体结构启示
奥格列汀的发现并非凭空而来,而是基于对西格列汀与DPP-4酶活性位点结合模式的深刻理解。X射线晶体衍射研究显示,DPP-4酶拥有一个较大的活性空腔(S1和S2亚位点)。西格列汀通过其三唑并吡嗪核心与酶形成关键相互作用。
西格列汀及其环己胺类似物与DPP-4活性位点的晶体复合物结构
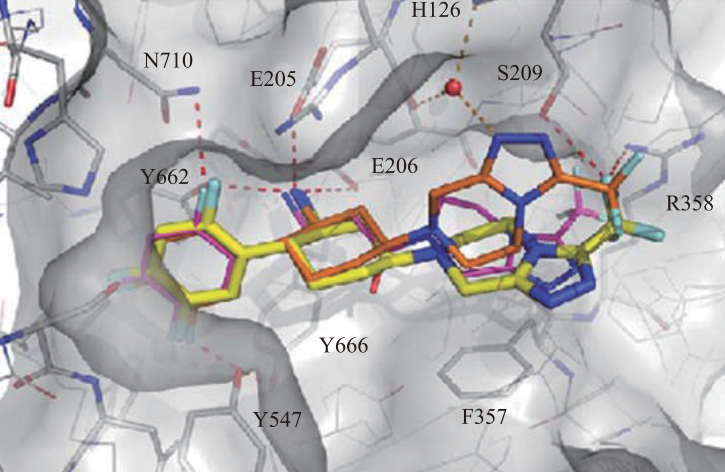
默克团队最初的设计策略是引入刚性更强的环己胺骨架(化合物6a),以期获得更强的结合亲和力。这一策略确实奏效,化合物6a对DPP-4的抑制活性极强(IC50 = 0.5 nmol/L)。然而,高活性伴随着高风险。在早期的心脏安全性筛选中,6a表现出对hERG钾离子通道的强抑制作用(IC50 = 4.8 µmol/L)。hERG通道的阻滞是药物引起QT间期延长、导致致死性心律失常(如尖端扭转型室速)的主要原因。在犬类模型中,6a确实引起了QT间期延长,这直接判了该先导化合物的死刑。
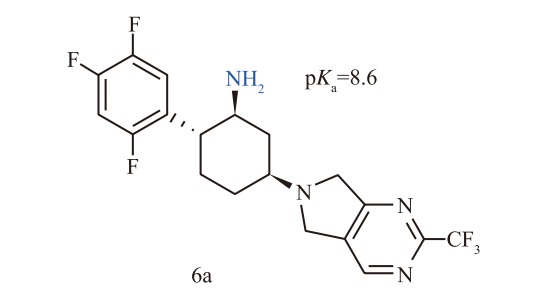
2. 关键转折:降低碱性与解决代谢软肋
为了消除hERG毒性,化学家们采取了经典的药物化学策略:降低分子中碱性氮原子的pKa值。通过将环己基替换为四氢吡喃环(Tetrahydropyran),他们得到了化合物7a。这一修饰将氨基的pKa从8.6降低至7.3,显著降低了分子在生理pH下的正电荷密度,从而大幅削弱了其与hERG通道的结合(IC50 > 30 µmol/L),消除了心脏毒性隐患。
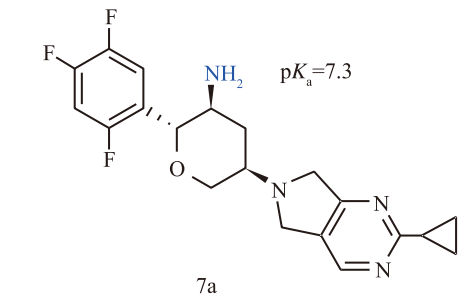
然而,“按下葫芦浮起瓢”。化合物7a在动物体内表现出严重的代谢不稳定性。在大鼠和犬的药代动力学(PK)研究中,高达30%-50%的原型药物被迅速氧化代谢,生成吡咯并嘧啶衍生物(7c)。更致命的是,这个代谢产物失去了对DPP-4的选择性,转而抑制DPP-8和DPP-9。
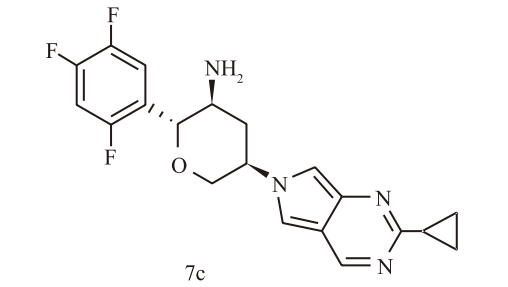
为何选择性至关重要?早期研究表明,抑制DPP-8/9会导致严重的毒性反应,包括脱发、血小板减少、网状内皮系统组织细胞增生,甚至导致实验动物死亡。因此,对DPP-4的高选择性(特别是相对于DPP-8/9)是该类药物研发的“红线”。
3. 终极优化:奥格列汀(MK-3102)的诞生
面对代谢不稳定性的挑战,默克团队进行了分子骨架的深度重构:
- 骨架跃迁:将代谢不稳定的吡咯并嘧啶环替换为吡唑并吡咯(Pyrazolopyrrole)骨架。这一刚性稠环结构不仅封闭了易被氧化的位点,还保留了与酶关键残基的结合能力。
- 引入砜基:在吡唑氮原子上引入一个甲磺酰基(-SO2CH3)。这一基团的引入是点睛之笔,它不仅调节了分子的电子分布,增强了与酶S2亚位点的相互作用,还极大地改善了分子的药代动力学性质,使其半衰期大幅延长,满足了每周给药的需求。
- 立体化学确证:通过对所有8个可能的立体异构体进行合成和测试,确定了(2R, 3S, 5R)构型具有最优的活性和选择性。
最终诞生的 奥格列汀,IC50仅为1.6 nmol/L(比西格列汀强10倍以上),对DPP-8/9的选择性超过10,000倍,且在人体内的半衰期长达100小时以上,完美实现了“每周一次”的设计目标。
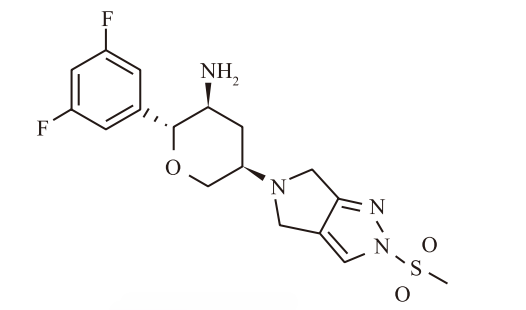
4. 绿色化学与工艺创新
除了分子设计,奥格列汀的工业化合成路线同样体现了制药工业的高水准。其关键点在于通过钌催化的不对称转移氢化反应,一步构建了四氢吡喃环上的两个手性中心,非对映选择性高达24:1。
此外,为了避免分离具有潜在致突变风险的中间体(1-甲磺酰基吡唑),工艺化学家开发了“一锅法”还原胺化工艺。这种对工艺安全性和原子经济性的极致追求,是现代药物研发中鲜为人知但至关重要的一环。
二、2016年的战略转折:心血管结局试验(CVOT)
如果说 奥格列汀 在科学上是成功的,那么它在欧美市场的“撤退”则完全是一场由市场环境剧变引发的战略调整。要理解这一点,必须回到2015-2016年那个糖尿病药物研发的分水岭时刻。
1. 监管风暴后的新标准
2008年,由于 罗格列酮(Avandia)的心血管安全性争议,FDA发布了新的指导原则,要求所有新型降糖药必须进行大规模的心血管结局试验(CVOT),以证明其不会增加心血管风险(非劣效性)。这导致了糖尿病药物研发成本的飙升,也改变了竞争的维度。
2. SGLT2抑制剂的“降维打击”
2015年9月,EMPA-REG OUTCOME研究结果公布,SGLT2抑制剂 恩格列净(Empagliflozin/Jardiance)不仅证明了心血管安全性,更出人意料地显示出心血管获益:
- 心血管死亡风险降低38%。
- 全因死亡率降低32%。
- 心力衰竭住院风险降低35%。
EMPA-REG研究结果
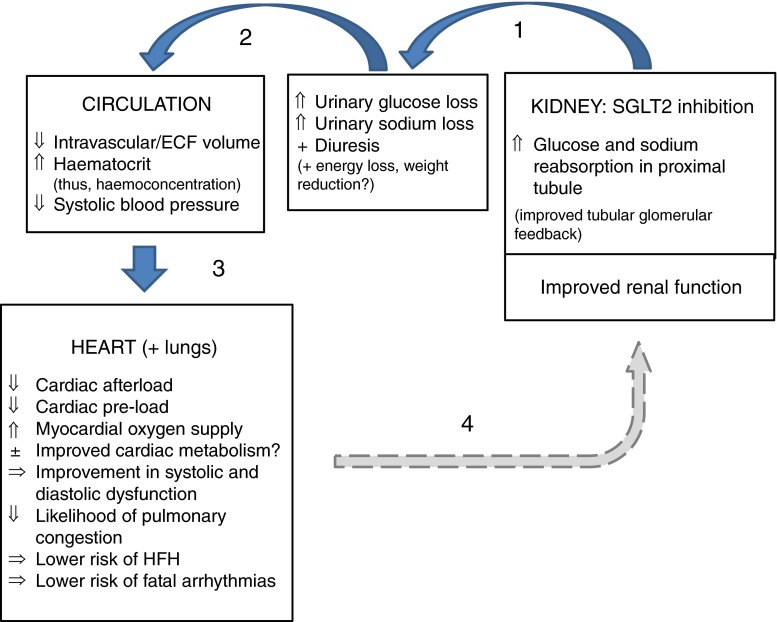
这一结果震惊了整个医学界。在此之前,降糖药的目标仅仅是降低 HbA1c(糖化血红蛋白)。恩格列净的出现,将治疗目标瞬间提升到了“降低死亡率”和“心肾保护”的高度。
3. DPP-4抑制剂的尴尬处境
与之形成鲜明对比的是,DPP-4抑制剂的CVOT结果——TECOS(西格列汀)、SAVOR-TIMI 53(沙格列汀)和 EXAMINE(阿格列汀)——均只证明了“不增加风险”(安全性),而未能显示出任何心血管获益。
- TECOS研究(2015年发表)显示,西格列汀组与安慰剂组在主要心血管不良事件(MACE)上无显著差异。
- 更糟糕的是,SAVOR-TIMI 53研究还发现 沙格列汀 可能微弱增加心衰住院风险。
在 恩格列净(以及随后的GLP-1激动剂利拉鲁肽)确立了“救命”的价值主张后,仅仅能“降糖”且“不害命”的DPP-4抑制剂瞬间失去了溢价能力。默克管理层敏锐地意识到,在2016年后的美国市场,支付方(保险公司)和医生将优先选择具有CV获益证据的SGLT2和GLP-1类药物。推出一款新的DPP-4抑制剂,哪怕是每周一次,也只是在红海中进行微不足道的战术升级,而非战略突破。
omarigliptin临床试验数据
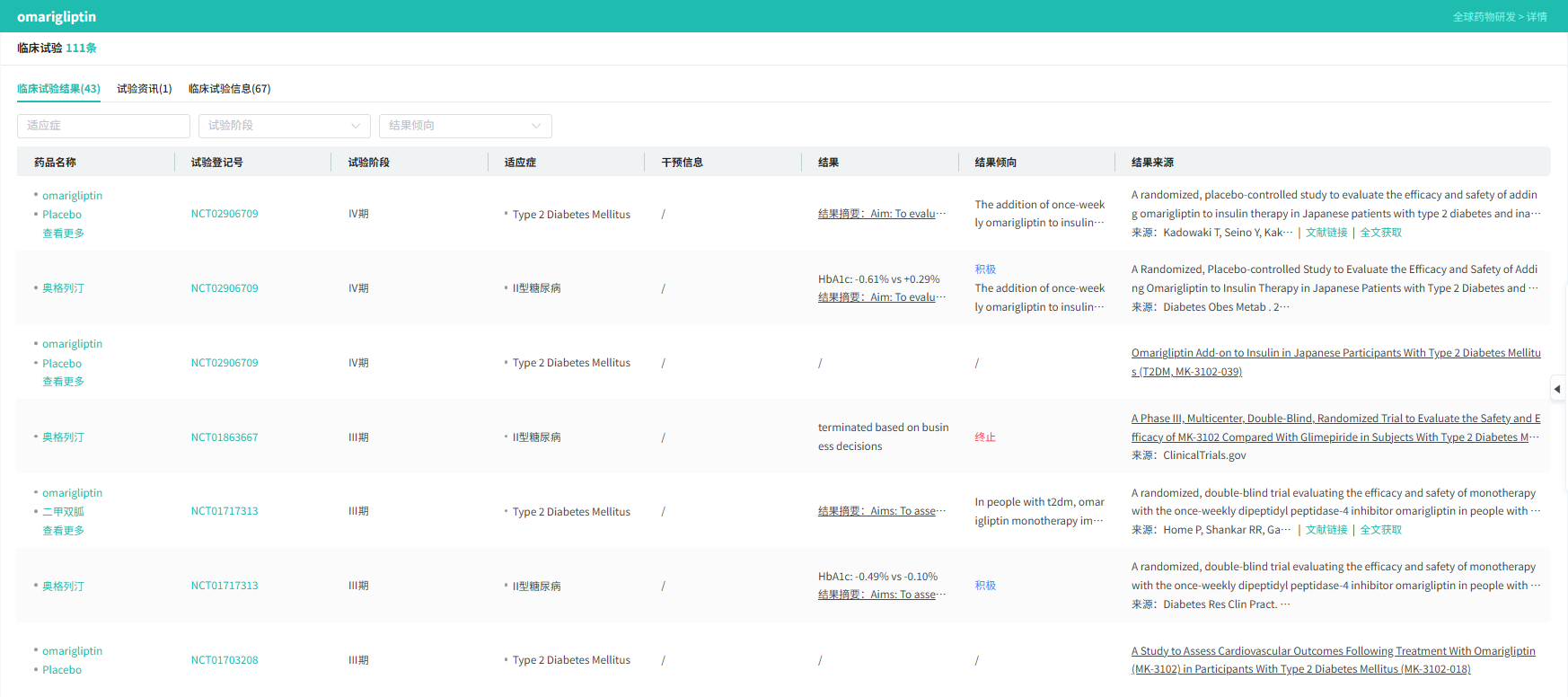
查数据,找摩熵!图源:摩熵医药数据库
4. 内部资源的重新配置
当时,默克正在与辉瑞合作开发自己的SGLT2抑制剂——埃格列净(Ertugliflozin/Steglatro)。为了在至关重要的SGLT2赛道上追赶阿斯利康(达格列净)和勃林格殷格翰/礼来(恩格列净),默克需要集中所有资源进行VERTIS CV等大型临床试验。牺牲商业前景黯淡的奥格列汀,以保全具有战略意义的埃格列净,是典型的“断臂求生”式的投资组合管理策略。
三、行为心理学的反直觉——“每周一次”的依从性陷阱
奥格列汀最大的卖点是“便利”。直觉告诉我们,一周吃一次药肯定比每天吃药容易坚持。然而,真实世界的数据却给出了截然相反的结论。
1. 习惯回路的缺失
行为心理学认为,习惯的养成依赖于“触发—行为—奖励”的回路。
- 每日服药:非常容易与日常生活的固定环节(如刷牙、吃早餐)挂钩,形成“自动化”行为。
- 每周服药:缺乏每日触发。患者需要依赖情景记忆:“今天是周二吗?我吃药了吗?”这种记忆机制随着年龄增长会显著衰退 。
2.“二甲双胍锚点”效应
绝大多数2型糖尿病患者都在服用 二甲双胍,而 二甲双胍 必须每天服用(甚至一天两次)。
- 同步性原理:当患者每天都要打开药瓶吃 二甲双胍 时,顺手吃一颗 西格列汀 并不增加认知负担。
- 异步性干扰:如果换成 奥格列汀,患者就需要管理两个时间表:一个是每天的 二甲双胍,一个是每周二的 奥格列汀。这种不同步反而增加了混乱和遗忘的风险。
真实世界数据显示,对于口服药,改为每周一次并未显著提高依从性,甚至在某些研究中,依从性反而不如每日给药。这与注射剂(如Ozempic)不同,因为注射本身带有痛苦和仪式感,减少频率能带来实质性的解脱,而吞服药片的边际成本极低。
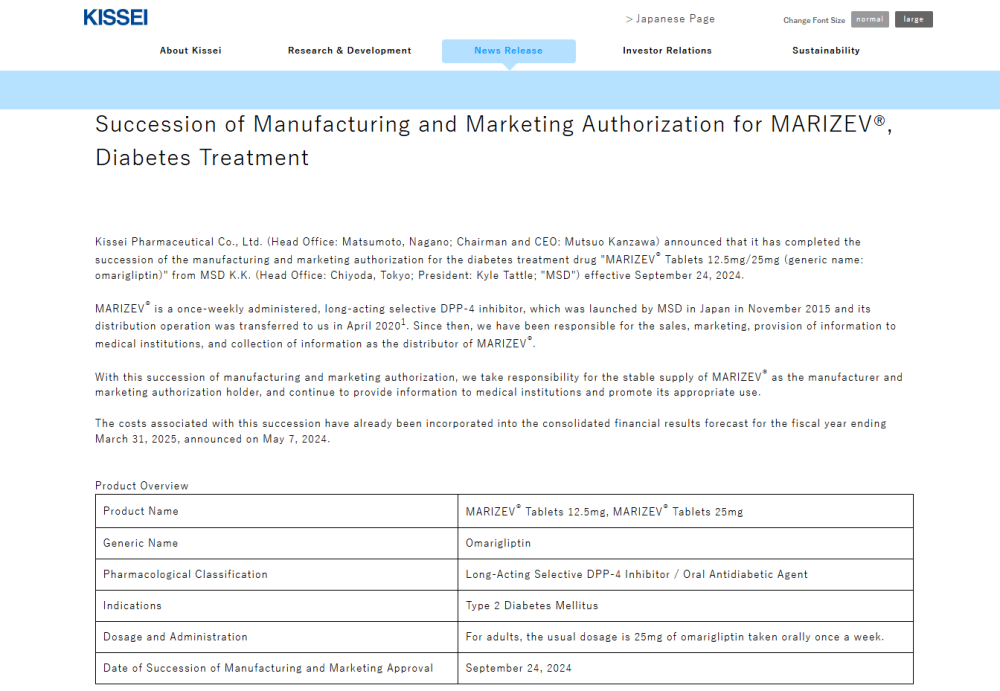
四、奥格列汀为何在日本获得成功?
虽然在欧美被弃,奥格列汀 在日本却以Marizev的品牌成功上市,并由Kissei Pharmaceutical(橘生药品)接手运营。这反映了日本市场独特的病理生理学特征和医疗文化。
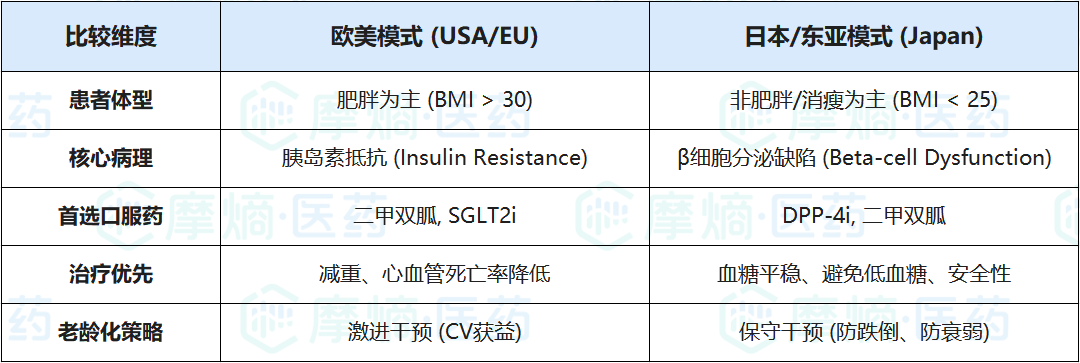
1. 亚洲T2DM的“瘦型”特征
东西方T2DM患者的病理机制存在显著差异:
- 西方表型:高BMI(肥胖),主要驱动因素是严重的胰岛素抵抗。因此,能减重的药物(GLP-1, SGLT2)是刚需。
- 亚洲表型:BMI较低(往往<25 kg/m²),主要驱动因素是β细胞功能障碍导致的基础胰岛素分泌不足。
由于DPP-4抑制剂的作用机制是增强内源性GLP-1水平以刺激胰岛素分泌,它们在β细胞功能受损但胰岛素抵抗不严重的亚洲人群中,往往表现出比在西方人群中更好的降糖效力。Meta分析数据显示,在亚洲人群中,DPP-4抑制剂降低HbA1c的幅度显著大于非亚洲人群。
2. 日本市场的特殊性
DPP-4的统治地位:日本是全球DPP-4抑制剂渗透率最高的市场,一度占据口服降糖药市场份额的60%以上(美国仅为~15%)。日本医生极度看重药物的安全性,尤其是对于不肥胖的老年患者,DPP-4抑制剂不引起低血糖、胃肠道反应少的特点使其成为首选。
每周给药的接受度:在日本完善的社区医疗体系下,药剂师对患者的用药指导更为细致,且日本患者对医嘱的依从性普遍较高,这在一定程度上弥补了每周口服药容易被遗忘的缺陷。
竞争格局:武田制药(Takeda)同期在日本推出了另一款每周一次的DPP-4抑制剂 曲格列汀(Trelagliptin/Zafatek)。两款药物的并存教育了市场,形成了一个稳定的细分领域。2024年,橘生药品完全接管 Marizev 的生产和销售,标志着该药物已完全融入日本本土医药生态,成为服务于特定人群(如需长期护理的老年人)的成熟产品。
东西方T2DM管理逻辑差异
五、2025年的战局
时间来到2025年,以 司美格鲁肽(Semaglutide)和 替尔泊肽(Tirzepatide)为代表的GLP-1药物已经统治了代谢病市场。但在光鲜的减重数字背后,一个隐形的健康危机正在浮出水面,这反而为 奥格列汀 这类老药赋予了新的时代意义。
1. GLP-1的阴暗面:肌肉流失
2024-2025年,随着GLP-1药物在老年群体中的渗透率增加,临床医生开始警惕其带来的肌肉减少症(Sarcopenia)风险。研究显示,使用 司美格鲁肽 或 替尔泊肽 进行快速减重时,丢失的体重中约有25%-40%是瘦体重,即肌肉和骨骼。
对于年轻肥胖者,这或许可以接受。但对于75岁以上、本就存在肌肉衰减的老年T2DM患者,这种肌肉流失可能是灾难性的,直接导致跌倒、骨折、虚弱和生活自理能力丧失。
2. DPP-4抑制剂:虚弱老人的“避风港”
这为 奥格列汀 及其同类药物创造了一个不可替代的生态位。
- 肌肉中性/保护:现有证据表明,DPP-4抑制剂是体重中性的,不引起肌肉流失。一些研究甚至提示其可能通过改善胰岛素敏感性和抗炎作用,对老年肌肉质量具有保护效应。
- 2025年指南风向标:最新的临床研究(如发表在Diabetes Care上的Medicare数据分析)指出,虽然SGLT2和GLP-1在延缓虚弱进展方面总体优于磺脲类,但在特定高龄、非肥胖、衰弱患者中,DPP-4抑制剂因其极佳的耐受性和不引起分解代谢的特性,被重新评估为最安全的维持治疗手段。
在日本这一全球老龄化最严重的国家,医生普遍倾向于在老年患者中使用DPP-4抑制剂而非SGLT2(担忧脱水)或GLP-1(担忧厌食和肌肉流失),这正是Marizev能够持续生存的深层社会学根源。
3. 小分子GLP-1的突破——Orforglipron
虽然注射型GLP-1(如司美格鲁肽注射液/Ozempic)已成神药,但口服制剂仍是各大药企争夺的终极高地。口服司美格鲁肽(Rybelsus),它是首个上市的口服GLP-1,但它是多肽药物,生物利用度极低,依赖SNAC技术促进吸收。其最大的痛点是极其严苛的服药要求。
礼来和中外制药合作研发的 Orforglipron(奥氟格列隆)为小分子口服GLP-1RA药物,根据摩熵医药数据库显示,其于2026年1月10日申请上市。 与市面上现有的多肽类注射制剂不同,Orforglipron 属于小分子口服GLP-1受体激动剂。这一技术路径突破了传统多肽药物生物利用度低、必须空腹服用的限制,有望极大提升患者的依从性。此次上市申请的提交,不仅是礼来在代谢疾病领域布局的关键一步,也预示着全球GLP-1药物市场将正式进入“口服小分子”竞争的深水区,为广大肥胖及2型糖尿病患者提供了更便捷的治疗选择。
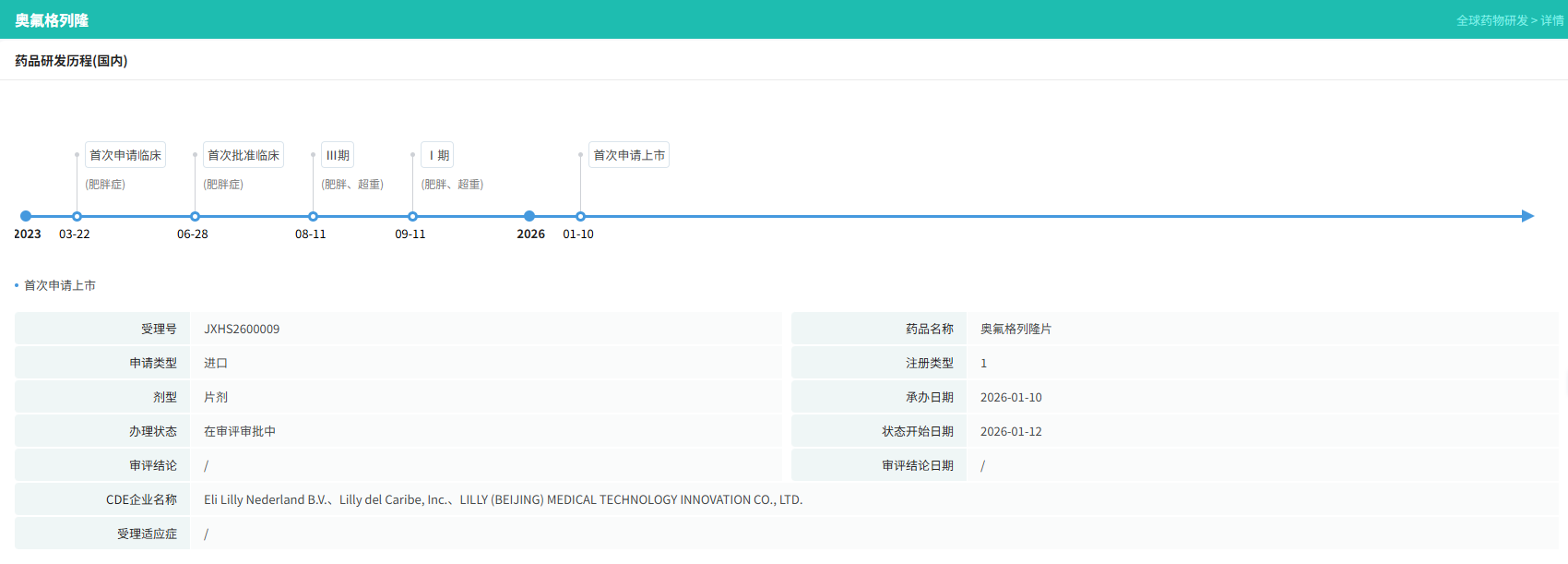
查数据,找摩熵!图源:摩熵医药-全球药物研发数据库
结语
奥格列汀(MK-3102)并非历史上最大的药物研发失败,但它是最能体现现代医药工业复杂性的案例之一。它是一面镜子,映照出药物研发不仅仅是化学和生物学的较量,更是对人性(依从性)、种族差异(病理生理学)和商业博弈的深刻洞察。在GLP-1光芒万丈的今天,回望 奥格列汀 的足迹,我们看到的不仅是遗憾,更是通往下一代更精准、更人性化药物治疗的必经之路。
【往期精彩】
1. 博纳吐单抗的设计与开发:BiTE技术先锋,作用机制揭秘、临床应用挑战及与CAR-T的较量
2. 从专利基石到策略博弈:药物研发中小分子与大分子的专利密码
3. 新药研发密码:构效循环、利平斯基五规则与PROTACs新范式大揭秘
查数据,找摩熵!想要解锁更多药品信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!




















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论