
12月17日,赛诺菲(Sanofi)宣布,第二代心肌肌球蛋白抑制剂(CMI)阿夫凯泰片正式获得中国国家药品监督管理局(NMPA)批准,用于治疗纽约心脏协会(NYHA)心功能分级II-III级的梗阻性肥厚型心肌病(HCM)成人患者,以改善运动能力和症状。

阿夫凯泰片是肥厚型心肌病领域潜在“同类最佳”的治疗药物,作为第二代心肌肌球蛋白抑制剂,阿夫凯泰片能够精准靶向心肌肌球蛋白,直接抑制产力横桥的形成,减轻心肌过度收缩。此次获批标志着阿夫凯泰片是在中国实现“全球首发”的创新药,据摩熵医药数据库显示,阿夫凯泰片中国获批早于美欧等全球其他地区,2025年12月7日,国内箕星药业上海公司获批,用于肥厚性心肌病。
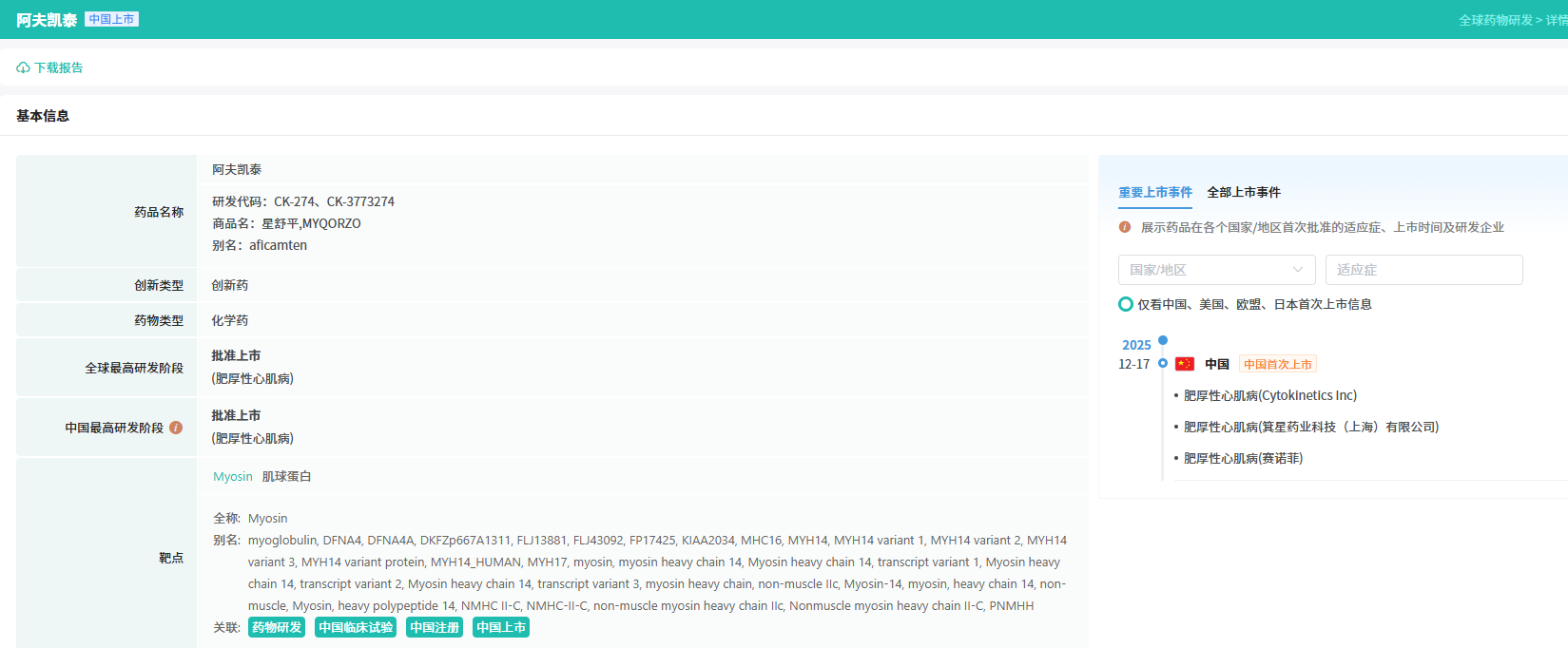
查数据,找摩熵!→图源:摩熵医药全球药物研发数据库
肥厚型心肌病作为最常见的遗传性心脏疾病,可能引发猝死、心力衰竭、血栓栓塞等致命风险。值得关注的是,在所有肥厚型心肌病患者中,约三分之二属于预后更差的梗阻性HCM。对于这部分患者来说,LVOT-G升高是疾病进展的关键因素,会进一步加剧心功能损伤,相较于非梗阻性肥厚型心肌病(nHCM)患者死亡率翻倍。
此外,在治疗方面,传统药物仅能缓解部分症状,无法干预疾病病因,也难以延缓疾病进展。而侵入式治疗对于对专业技术及经验要求高,可及性较差,且普遍存在手术并发症,再干预风险较高,患者普遍的接受度较低。
阿夫凯泰片的研发状态
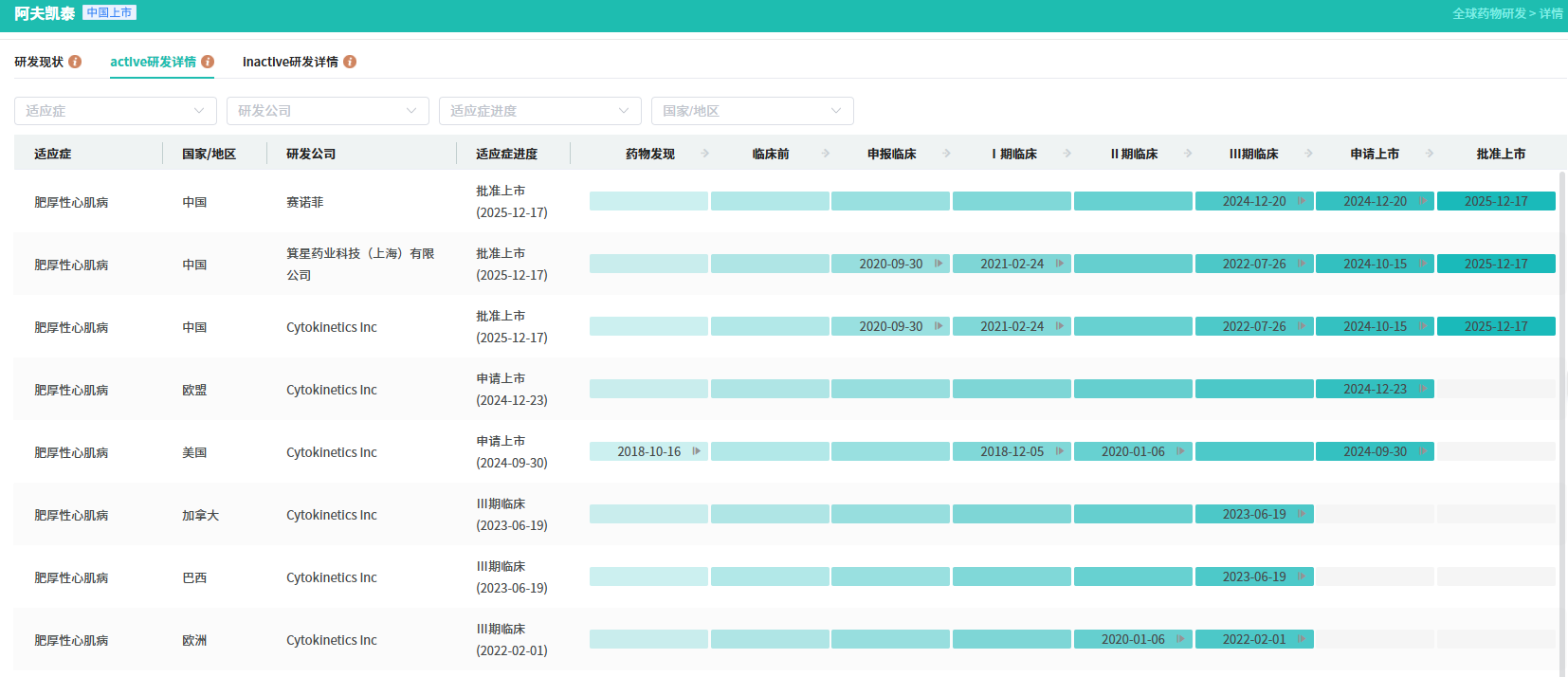
查数据,找摩熵!→图源:摩熵医药全球药物研发数据库
赛诺菲与箕星药业于2024年12月签订协议,收购箕星在大中华区独家开发和商业化阿夫凯泰片的权益,用于治疗梗阻性及非梗阻性肥厚型心肌病患者。
此次阿夫凯泰片的获批主要基于关键性全球3期临床研究SEQUOIA-HCM所取得的积极结果。研究达成通过心肺运动试验(CPET)测得的峰值摄氧量(pVO2)主要研究终点以及LVOT-G变化、纽约心脏病协会(NYHA)心功能分级改善等十项次要终点”。其中相较于安慰剂组,经阿夫凯泰片治疗24周后,pVO2水平较基线升高1.7mL/kg/min。
治疗12周NYHA心功能改善≥1级患者比例达48.6%,24周该比例达58.5%,治疗24周后基线符合室间隔减容术(SRT)的患者中更有88%不再符合SRT指征。此外,阿夫凯泰片耐受性良好,不良事件发生率与安慰剂相当。
参考来源:
[1] 企业官微/官方披露
[2] 摩熵医药(原药融云)数据库
扩展阅读:
1. 赛诺菲/再生元:度普利尤单抗已获欧洲药品管理局(EMA)批准
2. 赛诺菲大动作!削减管线、终止研究,业绩仍稳健增长5.1%
3. 赛诺菲[替利珠单抗]中国上市申请获受理,创新疗法或延缓1型糖尿病进程
查数据,找摩熵!想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!




















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论