1.5.1 本周全球TOP10创新药研发进展
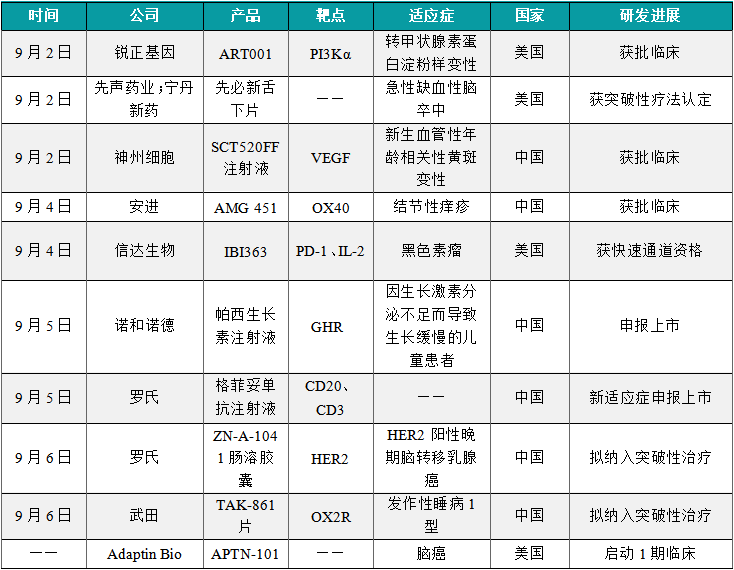
(1)锐正基因基因编辑新药ART001获美国FDA临床批准
9月2日,锐正基因(Accuredit)宣布其自主研发的基于非病毒载体的体内基因编辑药物ART001获美国FDA临床试验许可,拟开发用于治疗转甲状腺素蛋白淀粉样变性(ATTR)。ART001注射液由锐正基因研发,通过脂质纳米颗粒(LNP)将CRISPR基因组编辑组件递送到肝脏,对TTR基因进行编辑,从而阻断TTR蛋白的表达,从根源上避免产生淀粉样物质异常沉积。由于体内基因编辑药物有潜力终生只需用药一次即可停止病情进展甚至逆转和”治愈“疾病,有望为患者带来新的治疗方法。此外,据锐正基因公开资料介绍,该公司开发的体内基因技术平台以脂质纳米颗粒(LNP)作为递送载体,不需使用病毒和细胞,有望大幅度降低新药研发生产成本。
(2)先声药业与宁丹新药合作开发的先必新舌下片获FDA突破性疗法认定
9月2日,先声药业宣布与宁丹新药合作开发的先必新舌下片(依达拉奉右莰醇舌下片)获FDA突破性疗法认定,用于治疗急性缺血性脑卒中(AIS)。依达拉奉右莰醇舌下片是一种脑细胞保护剂,含依达拉奉和右莰醇两种活性成分,具有抗氧化、抗炎和协同增效作用,能够显著减少AIS导致的脑细胞损伤。该药还具有独特的舌下片配方,有望增加卒中治疗方式的灵活性。2023年6月,该产品在中国的上市申请已经获NMPA受理,首个适应症为用于改善AIS所致的神经症状、日常生活活动能力和功能障碍。
(3)神州细胞1类新药SCT520FF注射液获批临床
9月2日,神州细胞1类新药SCT520FF注射液获批临床,适应症为新生血管性年龄相关性黄斑变性。年龄相关性黄斑变性(AMD)是一种潜在进展性黄斑病变,是老年人中央视力不可逆丧失的最常见病因。公开资料显示,SCT520FF注射液是神州细胞自主研发的一款抗血管生成生物药。抗血管内皮生长因子(VEGF)药物的到来,为治疗湿性年龄相关性黄斑变性提供了新的治疗方法。这些药物通过减少新生血管的生长和水肿起作用。目前无论是全球还是中国,已经有多款抗血管生成生物药物获批上市。与此同时,业界还在继续探索研发更多新型药物,来提升临床疗效和安全性。
(4)安进1类新药AMG 451再获批临床,治疗结节性痒疹
9月4日,安进(Amgen)的1类新药AMG 451一项新的临床申请获得批准,适应症为结节性痒疹。公开资料显示,AMG 451(rocatinlimab)是一款全人源化抗OX40单克隆抗体在研新药,安进通过一项高达12.5亿美元的合作获得了共同开发和商业化该产品的权益。OX40(又称CD134)是一类重要的T细胞共刺激分子,是近年来新药研发的前沿靶点之一。它一方面可以通过调控效应T细胞的增殖和存活增强免疫活性,另一方面可抑制调节性T细胞(Tregs)的活性和增殖。因此,刺激免疫反应的OX40激动剂设计旨在提高T细胞效应,增强免疫应答。OX40靶向抗体的开发,有望为多种免疫疾病带来治疗效果。
(5)信达生物双抗癌症新药IBI363获FDA快速通道资格
9月4日,信达生物宣布其PD-1/IL-2双特异性抗体融合蛋白IBI363获得美国FDA授予快速通道资格(fast track designation, FTD),拟定适应症为既往接受过至少一线含PD-1/L1检查点抑制剂系统性治疗后进展的局部晚期或转移性黑色素瘤(脉络膜黑色素瘤除外)。IBI363是由信达生物自主研发的潜在“first-in-class”PD-1/IL-2双特异性融合蛋白,同时具有阻断PD-1/PD-L1通路和激活IL-2通路两项功能。IBI363的IL-2臂经过了设计改造,保留了其对IL-2 Rα的亲和力,但削弱了对IL-2Rβ和IL-2Rγ的结合能力,以此降低毒性;而PD-1结合臂可以同时实现对PD-1的阻断和IL-2的选择性递送。目前,信达生物正在中国、美国、澳大利亚同时开展1/2期临床研究探索IBI363在各种晚期恶性肿瘤的有效性和安全性。
(6)诺和诺德帕西生长素注射液在中国申报上市
9月5日,诺和诺德(Novo Nordisk)申报的帕西生长素注射液的新药上市申请获得受理。根据公开信息,这应该是诺和诺德研发的每周一次长效生长激素Sogroya®(somapacitan)。该产品在中国开展的用于治疗因生长激素分泌不足而导致生长缓慢的儿童患者的一项3期研究现已经完成。Sogroya®(somapacitan)注射液是一种含有与人体产生的生长激素相似的人生长激素类似物,可用于治疗成人生长激素缺乏症(AGHD)。Sogroya®已在美国、欧 盟、日本、澳大利亚和沙特阿拉伯获批,每周仅需在皮下注射一次用于成人生长激素缺乏症(AGHD)患者内源性生长激素的替代治疗。该产品还能用于治疗2.5岁及以上的儿童,他们没有足够的生长激素。
(7)罗氏双抗癌症新药格菲妥单抗注射液新适应症在中国申报上市
9月5日,罗氏(Roche)格菲妥单抗注射液新适应症上市申请获得受理,具体适应症尚未披露。格菲妥单抗是一款靶向CD20和CD3的双特异性T细胞衔接蛋白。根据罗氏官网及公开资料推测,本次申报上市的新适应症可能为:联合吉西他滨和奥沙利铂治疗不适合进行自体干细胞移植的弥漫性大B细胞淋巴瘤(2L+ DLBCL)。据罗氏官网,格菲妥单抗还有多项适应症处于3期临床阶段,包括联合Polivy和R-CHP一线治疗DLBCL、治疗复发难治性套细胞淋巴瘤。根据中国药物临床试验与信息公示平台官网,罗氏已经在中国开展了一项3期、开放性、多中心、随机研究,旨在复发性/难治性套细胞淋巴瘤患者中评价格菲妥单抗单药治疗对比研究者选择治疗的有效性和安全性。
(8)罗氏ZN-A-1041肠溶胶囊拟纳入突破性治疗品种
9月6日,苏州赞荣医药科技有限公司申报的ZN-A-1041肠溶胶囊拟纳入突破性治疗品种,适应症为:ZN-A-1041联合卡培他滨和曲妥珠单抗用于既往接受过含曲妥珠单抗治疗进展的HER2阳性晚期脑转移乳腺癌患者。公开资料显示,ZN-A-1041是一款口服小分子HER2靶向小分子抑制剂,具备高度血脑屏障通透性。2023年5月罗氏(Roche)与赞荣医药就收购这款在研药物全球权益达成了总额约6.8亿美元的协议。据中国药物临床试验登记与公示信息平台,ZN-A-1041针对HER2阳性晚期实体瘤的两项研究正在进行中。其中一项1期研究,旨在评价ZN-A-1041肠溶胶囊单药或联合给药在HER2阳性晚期实体瘤患者中的安全性、耐受性、药代动力学与有效性。
(9)武田1类创新药TAK-861片拟纳入突破性治疗品种
9月6日,武田(Takeda)TAK-861片拟纳入突破性治疗品种,针对适应症为发作性睡病1型(NT1)。公开资料显示,TAK-861是一种口服食欲素受体2(OX2R)激动剂。NT1是一种慢性、罕见的中枢神经系统过度嗜睡障碍,由于食欲素(orexin)神经元的大量丧失,导致大脑和脑脊液中食欲素神经肽水平低下。NT1患者会出现过度白天嗜睡(EDS)、猝倒、夜间睡眠中断、入睡和醒来时的幻觉等症状。这些衰弱症状显著降低生活质量,并严重影响患者工作、生活和人际关系。TAK-861旨在通过选择性刺激食欲素受体来解决NT1中的食欲素缺乏问题。激活食欲肽2受体的激动剂可能替代内源性食欲肽,激活促进清醒的信号通路。
(10)Adaptin Bio脑癌疗法APTN-101临床试验即将启动
近日,Adaptin Bio宣布走出隐匿模式,并宣布其主打项目APTN-101的IND申请已获美国FDA批准,该公司即将推动该候选药物的“first-in-human”临床1期试验,以评估其用于治疗胶质母细胞瘤(GBM)的疗效与安全性。APTN-101是一种专有的BRiTE疗法,设计靶向EGFRvIII分子,这是一种与侵袭性脑肿瘤相关的蛋白。在临床前研究中,APTN-101具有超过对照药物7倍的大脑分布增强的效果,并在消除恶性胶质瘤肿瘤方面表现强劲,具有成为“best-in-class”药物的潜力。
1.5.2本周全球TOP10积极/失败临床结果
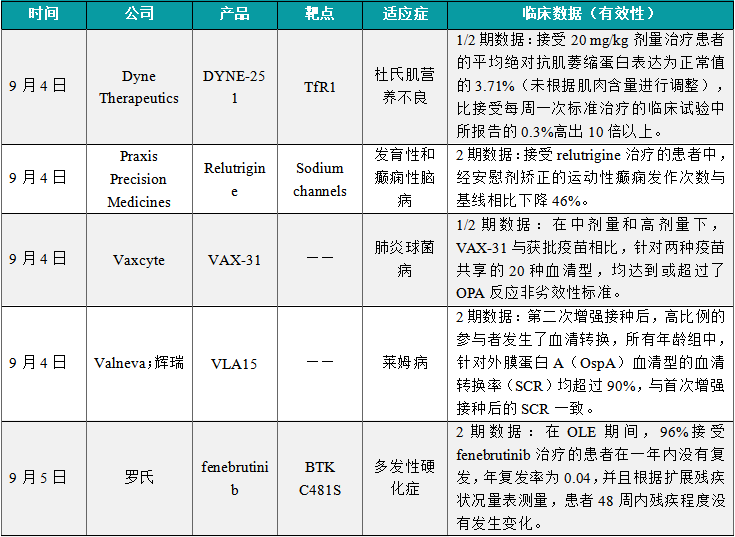
(1)Dyne Therapeutics公布创新寡核苷酸偶联疗法DYNE-251的1/2期临床结果
9月4日,Dyne Therapeutics公布其进行中的1/2期试验DELIVER的最新临床数据。该试验检视其在研抗体偶联寡核苷酸疗法DYNE-251在适合进行外显子51跳跃治疗的杜氏肌营养不良(DMD)患者中的疗效与安全性。根据新闻稿,在接受DYNE-251治疗后,多个队列患者的抗肌萎缩蛋白表达达到前所未有的水平,且患者的临床功能获得改善。结果显示,抗肌萎缩蛋白表达提升:DYNE-251组患者显示出高度的抗肌萎缩蛋白表达。接受20 mg/kg剂量治疗患者的平均绝对抗肌萎缩蛋白表达为正常值的3.71%(未根据肌肉含量进行调整),比接受每周一次标准治疗的临床试验中所报告的0.3%高出10倍以上。患者的临床功能改善:接受20 mg/kg和10 mg/kg剂量治疗的患者在多个临床功能终点均有显著改善。
(2)Praxis Precision Medicines公布在研疗法relutrigine 2期试验积极数据
9月4日,Praxis Precision Medicines宣布,在研疗法relutrigine在2期临床概念验证研究中获得积极顶线结果,该研究评估了relutrigine在SCN2A和SCN8A发育性和癫痫性脑病(DEE)患者中的疗效。试验结果显示,在EMBOLD研究中,relutrigine表现出良好的安全性和耐受性。最常见的不良事件(AE)包括感染、呕吐、发热、嗜睡和便秘,没有患者因不良事件而中途退出。在疗效方面,接受relutrigine治疗的患者中,经安慰剂矫正的运动性癫痫发作次数与基线相比下降46%。值得一提的是,在接受relutrigine治疗的患者中,5名患者实现了28天无癫痫发作,而安慰剂组中无患者达成这一状态。
(3)Vaxcyte公布31价肺炎球菌结合疫苗VAX-31的 1/2期临床结果
9月4日,Vaxcyte宣布其候选31价肺炎球菌结合疫苗VAX-31在一项针对1015名50岁及以上健康成人的1/2期临床试验中取得了积极的顶线结果。VAX-31在所有研究剂量中均显示出良好的耐受性,并在整个六个月的评估期间展现了与获批20价肺炎球菌结合疫苗相似的安全性。VAX-31在所有研究剂量中对所有31种血清型均表现出强劲的调理吞噬作用(OPA)免疫反应。在中剂量和高剂量下,VAX-31与获批疫苗相比,针对两种疫苗共享的20种血清型,均达到或超过了OPA反应非劣效性标准。高剂量的VAX-31与获批20价疫苗相比,20种血清型中18种的平均OPA免疫反应更强,其中7种血清型的免疫反应显著高于活性对照。对于VAX-31独有的11种血清型,所有三种剂量与获批20价疫苗相比均达到了优效性标准。
(4)Valneva和辉瑞共同公布莱姆病候选疫苗VLA15的2期临床数据
9月4日,Valneva和辉瑞(Pfizer)公司宣布,双方联合开发的莱姆病(Lyme disease)候选疫苗VLA15在2期临床试验中获得积极的免疫原性和安全性数据。2期临床试验VLA15-221的结果再次展示了该候选疫苗可激发针对覆盖的六种血清型的显著记忆性抗体反应,这些结果在儿童(5至11岁)、青少年(12至17岁)和成人(18至65岁)参与者中均保持一致。在第二次增强接种后,高比例的参与者发生了血清转换,所有年龄组中,针对外膜蛋白A(OspA)血清型的血清转换率(SCR)均超过90%,与首次增强接种后的SCR一致。接种首次和第二次增强疫苗一个月后(即第19个月和第31个月),参与者的抗体几何平均滴度相似且维持在较高水平。
(5)罗氏公布BTK抑制剂fenebrutinib的2期临床数据
9月5日,罗氏(Roche)公布临床2期试验FENopta的开放标签扩展(OLE)研究48周新数据。结果表明,接受其口服布鲁顿酪氨酸激酶(BTK)抑制剂fenebrutinib治疗长达一年的复发性多发性硬化(RMS)患者中,高达96%患者没有发生疾病复发与进展。结果显示,在OLE期间,96%接受fenebrutinib治疗的患者在一年内没有复发,年复发率(ARR)为0.04,并且根据扩展残疾状况量表(EDSS)测量,患者48周内残疾程度没有发生变化。此外,根据磁共振成像(MRI)扫描结果,fenebrutinib持续抑制颅脑疾病活动。48周后,99%的患者不再出现T1 Gd+病灶。
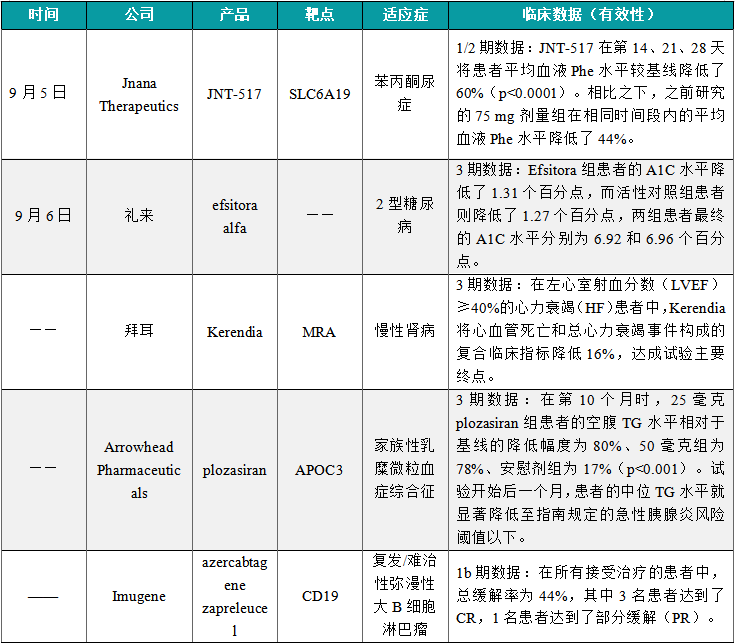
(6)Jnana Therapeutics公布苯丙酮尿症疗法JNT-517的1/2期临床数据
9月5日,Jnana Therapeutics今日公布了其在研疗法JNT-517治疗苯丙酮尿症(PKU)成人患者的1/2期临床试验中的第二剂量组(150 mg,每日两次)的试验结果。数据显示,75 mg和150 mg组均显示出具有临床意义、统计学上显著的疗效。结果显示:JNT-517在第14、21、28天将患者平均血液Phe水平较基线降低了60%(p<0.0001)。相比之下,之前研究的75 mg剂量组在相同时间段内的平均血液Phe水平降低了44%。患者在用药开始后7天内观察到快速的疗效,血液Phe水平显著降低,并在28天的用药期间持续维持。无论基线Phe水平或之前的PKU治疗史如何,所有参与者均表现出显著的疗效。
(7)礼来公布创新疗法efsitora alfa的两项3期临床数据
9月6日,礼来(宣布了QWINT-1和QWINT-3两项3期临床试验的积极顶线结果,这些试验分别评估其每周一次胰岛素efsitora alfa(efsitora)在胰岛素初治的2型糖尿病成人患者,以及那些从接受每日基础胰岛素注射转为使用efsitora患者中的疗效。在这两项试验中,efsitora与每日基础胰岛素相比在降低糖化血红蛋白(A1C)水平效果上达非劣效性。QWINT-1分析显示,Efsitora组患者的A1C水平降低了1.31个百分点,而活性对照组患者则降低了1.27个百分点,两组患者最终的A1C水平分别为6.92和6.96个百分点。QWINT-3分析显示,Efsitora组患者的A1C水平降低了0.86个百分点,而活性对照组患者则降低了0.75个百分点,两组患者最终的A1C水平分别为6.93和7.03个百分点。
(8)拜耳公布“first-in-class”疗法Kerendia 的3期临床结果
近日,拜耳(Bayer)公司在2024年欧洲心脏病学会(ESC)大会上发布了“first-in-class”疗法Kerendia(finerenone)的3期临床试验FINEARTS-HF的详细结果。试验结果显示,在左心室射血分数(LVEF)≥40%的心力衰竭(HF)患者中,Kerendia将心血管死亡和总心力衰竭事件构成的复合临床指标降低16%,达成试验主要终点。这项研究的积极数据意味着Kerendia的作用不局限于伴有T2D的CKD患者群体,也能为心力衰竭(LVEF≥40%)患者提供临床获益。新闻稿指出,Kerendia是首个在3期临床试验里,在这一患者群体中达到主要复合心血管终点的MRA。
(9)Arrowhead Pharmaceuticals公布在研RNAi疗法plozasiran的3期临床结果
近日,Arrowhead Pharmaceuticals公布其在研RNAi疗法plozasiran用于治疗家族性乳糜微粒血症综合征(FCS)患者的3期PALISADE研究结果。分析显示,试验成功达到主要终点和所有关键次要终点,plozasiran使患者的甘油三酯(TG)、载脂蛋白C-III(APOC3)水平显著下降,并使急性胰腺炎(AP)的发病率显著降低。在第10个月时,25毫克plozasiran组患者的空腹TG水平相对于基线的降低幅度为80%、50毫克组为78%、安慰剂组为17%(p<0.001)。试验开始后一个月,患者的中位TG水平就显著降低至指南规定的急性胰腺炎风险阈值以下,并且在12个月的治疗期间,患者的中位TG水平获得维持。
(10)Imugene公布azercabtagene zapreleucel的1b期临床结果
近日,Imugene公司宣布,其现货型同种异体CD19靶向CAR-T细胞疗法azercabtagene zapreleucel(azer-cel)治疗复发/难治性弥漫性大B细胞淋巴瘤(一种非霍奇金淋巴瘤)的1b期临床试验取得了令人鼓舞的初步结果。结果显示,所有接受azer-cel和清淋化疗的患者都显示出可接受的安全性。此外,azer-cel+清淋化疗+IL-2的治疗在DLBCL患者中显示出了临床上有意义的疗效和持续性。在所有接受治疗的患者中,总缓解率为44%,其中3名患者达到了CR,1名患者达到了部分缓解(PR)。队列B中获得CR的两名患者已分别持续缓解超过90天和120天。
同期事件:
1. 2024年第36周09.02-09.08国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2024年第36周09.02-09.08国内仿制药/生物类似物申报/审批数据分析
3. 2024年第36周09.02-09.08国内医药大健康行业政策法规汇总
4. 2024年第36周09.02-09.08全球医药大健康行业投融资数据
以上内容均来自{摩熵咨询医药行业观察周报(2024.09.02-2024.09.08)},如需查看或下载报告,可点击!
<END>
想要解锁更多药物研发信息吗?查询摩熵医药数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论