
将肽类和蛋白质类药物从注射给药转变为口服给药,是制药领域百年来的梦想与挑战。截至今日,我们见证了两个标志性分子的截然不同的命运:诺和诺德(Novo Nordisk)的口服司美格鲁肽(Semaglutide,商品名Rybelsus®)作为首个口服GLP-1受体激动剂(GLP-1RA)在全球范围内成功商业化,而口服胰岛素在历经无数次尝试后,其领跑者如Oramed公司的 ORMD-0801 和诺和诺德早期的 OI338GT 项目均以失败告终。到底什么原因造成这一“冰火两重天”局面?
1. 口服司美格鲁肽的成功之路——技术、数据与策略的完美结合
口服司美格鲁肽于2019年获得美国FDA批准,并于2024年1月在中国获批上市。它的成功并非偶然,而是建立在三大支柱之上:革命性的递送技术、扎实的临床证据以及清晰的商业化路径。
1.1 核心技术突破:SNAC平台克服口服肽类药物天堑
肽类药物口服给药面临两大核心障碍:胃肠道中蛋白酶的快速降解和肠道上皮细胞的低通透性。诺和诺德通过其专有的Eligen®技术,特别是核心赋形剂SNAC(SodiumN-(8-[2-hydroxybenzoyl]amino)caprylate,沙卡布若钠),巧妙地解决了这些问题。
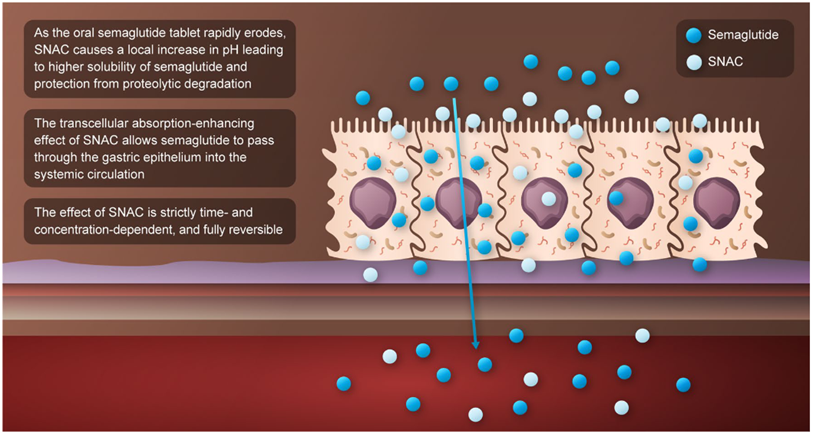
图1 口服司美格鲁肽的作用模式(参考1)
SNAC的作用机制是多方面的,堪称“贴身保镖”:
局部环境改造与保护:当药片在胃中崩解时,SNAC能够瞬时提高胃部局部pH值,从而抑制胃蛋白酶的活性,保护司美格鲁肽免于被降解。
促进跨细胞吸收:SNAC是一种吸收促进剂,它能与司美格鲁肽分子发生非共价的疏水相互作用,增加其脂溶性。这使得药物分子能够更容易地以“跨细胞”途径(transcellular pathway)穿过胃上皮细胞膜,进入血液循环。
增加细胞间通透性:SNAC还能暂时性地影响细胞间的紧密连接,增加胃黏膜的通透性,为药物提供一条“旁细胞”吸收(paracellular pathway)的额外通道。
正是SNAC这一创新性的单一分子解决方案,取代了传统“肠溶包衣+蛋白酶抑制剂+渗透增强剂”的复杂组合,高效地将口服司美格鲁肽的生物利用度提升至一个虽低(约1%)但稳定、可预测且在临床上有效的水平,这是其成功的技术基石。
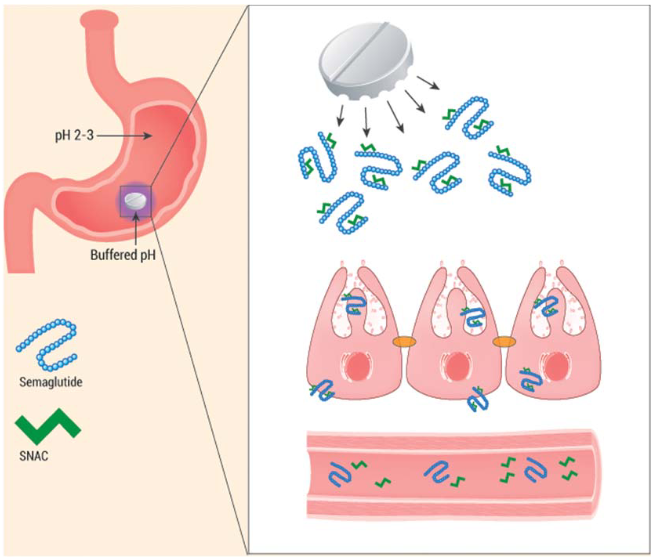
图2口服司美格鲁肽与SNAC共配制剂的吸收机制示意图。本示意图展示了以片剂形式存在的口服司美格鲁肽与SNAC共配制剂在胃中溶解和吸收的过程。当片剂在胃中崩解时,司美格鲁肽和SNAC被释放出来。SNAC发挥局部缓冲作用,图中以片剂周围的紫色区域表示。该缓冲作用保护司美格鲁肽免受胃蛋白酶(一种胃酶)的降解。由于在胃中避免了胃蛋白酶诱导的肽类降解,司美格鲁肽在通过跨细胞途径穿越胃粘膜的过程中,与SNAC分子保持微弱且非共价的结合状态。一旦SNAC和司美格鲁肽进入体循环,两者便会解离。(参考2)
1.2 强大的临床证据:PIONEER项目构建的循证金字塔
诺和诺德为口服司美格鲁肽设计了规模宏大的PIONEER全球III期临床试验项目,该项目包含超过10个独立的临床试验,入组了近万名2型糖尿病患者,全面评估了其疗效和安全性。
卓越的疗效数据:
强效降糖与减重:PIONEER系列研究一致证明,口服司美格鲁肽在降糖和减重方面表现优异。例如,研究显示14mg、25mg和50mg剂量组的糖化血红蛋白(HbA1c)分别降低1.5%、1.9%和2.2%,体重分别减轻4.5kg、7.0kg和9.2kg。在中国患者亚组的PIONEER11研究中,HbA1c降幅高达1.6%,达标率(<7%)接近92.3%,效果显著。更高剂量的50mg在OASIS1试验中,68周可使体重平均降低17.4%。
心血管安全性得到证实:PIONEER6心血管结局试验(CVOT)表明,口服司美格鲁肽的心血管风险特征不劣于安慰剂。而司美格鲁肽注射剂在SELECT试验中已证明能显著降低主要不良心血管事件(MACE)风险,为整个产品家族提供了强大的心血管获益证据。
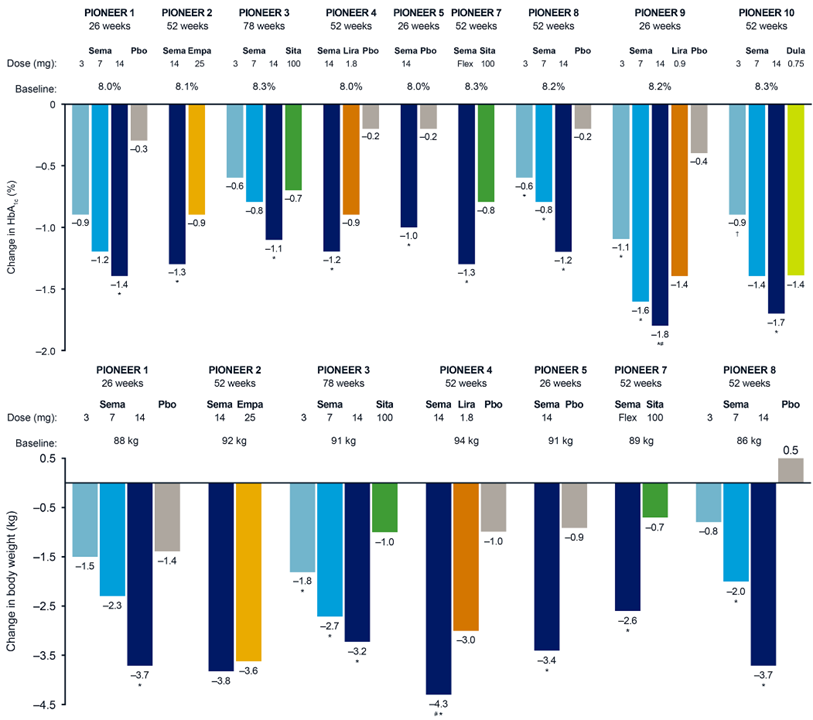
图3 PIONEER系列试验中口服司美格鲁肽与对照药物相比的HbA1c和体重自基线变化情况(参考1)
清晰且可管理的安全性特征:
PIONEER项目的数据显示,口服司美格鲁肽最常见的不良反应是胃肠道事件(如恶心、腹泻、呕吐),这些事件大多为轻至中度,且通常具有自限性,在治疗初期和剂量递增期更为常见。这一安全性特征与GLP-1RA类药物的已知情况相符,易于临床管理。其免疫原性风险低,临床试验中未观察到有临床意义的中和抗体。
这一系列设计严谨、数据扎实的临床试验,为监管机构的审批提供了无可辩驳的证据,也为上市后的市场推广奠定了坚实的基础。
1.3 精准的监管与市场准入策略
诺和诺德凭借充分的临床前和临床数据,成功推动了口服司美格鲁肽的全球监管审批。
监管审批:FDA于2019年9月率先批准其上市。其后,诺和诺德积极在中国递交申请,并于2024年1月获得国家药品监督管理局(NMPA)的批准。在FDA的审评过程中,尽管其注射剂型的顾问委员会曾对糖尿病视网膜病变的风险表示担忧,但最终以16票赞成、0票反对的压倒性结果支持批准,认为通过标签说明即可管理该风险这为口服剂型的顺利审批扫清了部分障碍。
中国市场准入:司美格鲁肽注射剂型在2021年已被纳入中国国家医保药品目录(NRDL),为其市场渗透奠定了良好基础。口服剂型获批后,但凭借其作为“首款口服GLP-1”的独特性和巨大的临床需求,其市场前景被广泛看好。
综上,口服司美格鲁肽的成功,是创新制剂技术、大规模循证医学证据和成熟商业化运作三者协同作用的结果。
2. 口服胰岛素的百年困局——难以逾越的技术与商业鸿沟
口服胰岛素的研发历史几乎与胰岛素发现的历史一样长,被誉为糖尿病治疗领域的“圣杯”。然而,一个世纪以来,尽管投入了巨大的研发资源,但截至2025年,全球仍无一款口服胰岛素成功商业化。其失败根源于多个相互关联且难以解决的深层次问题。
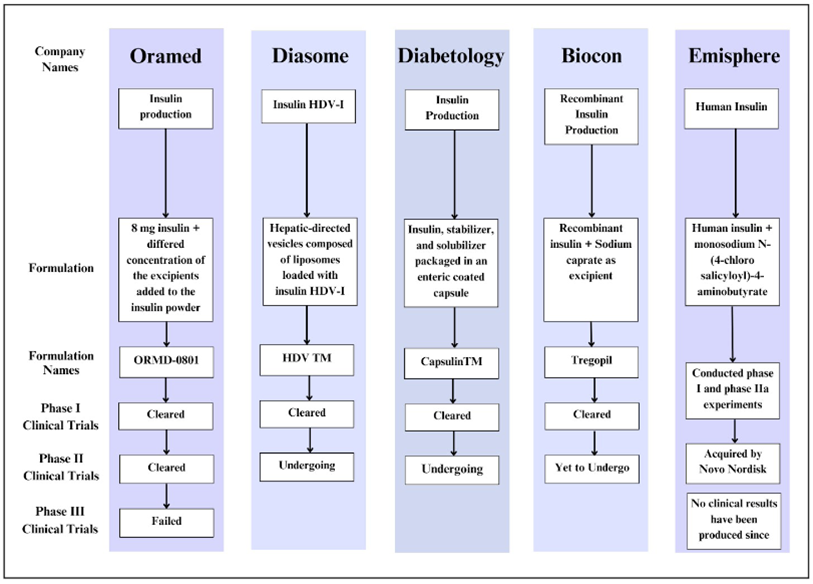
图4 口服胰岛素的努力(参考3)
2.1 固若金汤的生理屏障:制剂技术的“阿喀琉斯之踵”
胰岛素是一种由51个氨基酸组成的蛋白质,其口服递送面临比司美格鲁肽(31个氨基酸的肽)更为严峻的挑战。
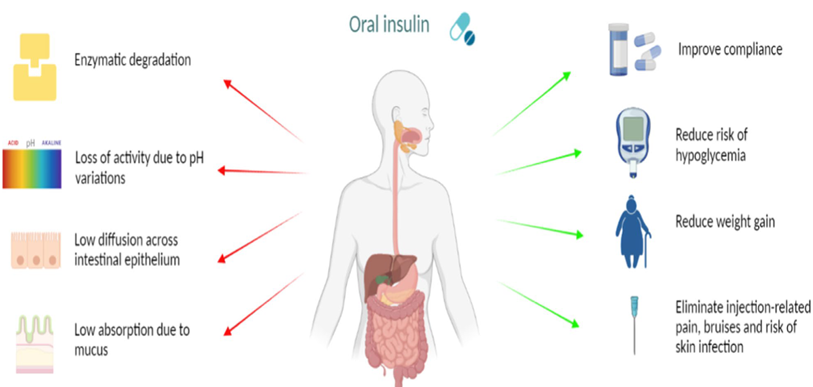
图5 口服胰岛素的挑战(参考4)
极端的胃肠道环境:胰岛素在胃的强酸环境下(pH1-2)极易变性失活,并迅速被胃蛋白酶降解。进入小肠后,又会面临胰蛋白酶等多种蛋白水解酶的攻击。
极低的肠道吸收效率:作为大分子蛋白质,胰岛素难以穿透由粘液层和紧密连接的肠上皮细胞构成的物理屏障。其生物利用度通常远低于1%,且个体间和个体内差异巨大。
递送技术策略的局限性:尽管研发人员尝试了各种技术,如肠溶包衣(保护药物通过胃部)、蛋白酶抑制剂(降低酶解)、纳米载体(如脂质体、纳米粒)和化学修饰等但这些策略往往“治标不治本”。它们或者保护不完全,或者增加了制剂的复杂性和生产成本,且始终未能将生物利用度提升至一个稳定且商业上可行的水平。
2.2 临床试验的屡战屡败:从希望到失望的轮回
众多备受期待的口服胰岛素候选药物,最终都在关键的临床后期阶段折戟。
- 案例一:Oramed ORMD-0801的III期临床失败
作为近年来走得最远的口服胰岛素项目,Oramed公司的 ORMD-0801 采用了其POD™技术平台,结合了肠溶包衣、蛋白酶抑制剂和吸收促进剂。然而,在2023年初,Oramed宣布其两项关键性III期临床试验(如ORA-D-013-1)均未能达到其主要终点(在26周时降低HbA1c)和次要终点。这一决定性的失败,直接导致公司宣布停止该药物针对2型糖尿病的开发,给整个领域带来了沉重打击。值得注意的是,ORMD-0801 的中国权益由天麦生物持有。在天麦生物于国内开展的III期临床试验中,其试验方案(例如入组患者的疾病程度、用药剂量等)与Oramed在海外失败的试验存在差异。因此,这款产品在中国的研发前景需要单独评估。
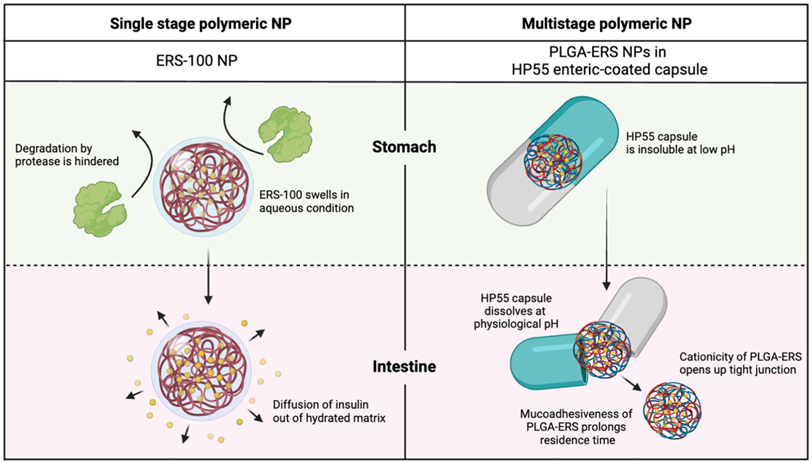
图6 单级与多级聚合物纳米颗粒的比较。基于共同辅料ERS-100,对HP55肠溶胶囊包裹的ERS-100纳米颗粒与PLGA-ERS纳米颗粒进行比较。(参考4)
- 案例二:诺和诺德OI338GT的商业考量
作为胰岛素领域的领导者,诺和诺德也曾大力投入口服胰岛素的研发。其项目OI338GT是一种口服长效基础胰岛素类似物。然而,在2016年,尽管项目已进入II期临床,诺和诺德却宣布终止该项目。官方给出的原因是“出于商业运作的考虑”。深入分析可知,这是因为要达到与注射胰岛素相当的疗效,所需的口服剂量巨大,导致生产成本(Cost of Goods)过高,完全不具备商业可行性。
这些失败案例揭示了一个残酷的现实:在现有技术条件下,口服胰岛素无法在疗效、稳定性、安全性和成本之间取得平衡。
2.3 严峻的商业与监管挑战
高昂的制造成本与规模化生产难题:由于生物利用度极低,口服胰岛素需要数倍甚至数十倍于注射剂的原料药(API),这直接导致其生产成本居高不下。同时,复杂的制剂工艺(如纳米颗粒的制备)在大规模生产中难以保证批次间的质量均一性和稳定性,构成了巨大的制造挑战(CMC)。
缺乏明确的临床价值定位:在GLP-1RA等新型降糖药(特别是口服司美格鲁肽)可同时提供强效降糖、显著减重和心血管获益的多重优势背景下,一款仅仅是“无需注射”但价格昂贵、疗效可能不稳定的口服胰岛素,其临床价值主张(value proposition)变得愈发模糊和缺乏吸引力。
监管机构的审慎态度:尽管搜索结果中没有找到FDA或NMPA针对具体口服胰岛素项目终止的官方公开信函(表明终止决定多为企业主动行为),但可以预见,任何口服胰岛素要想获批,必须在大型临床试验中证明其与现有标准疗法(如注射胰岛素)相比至少达到非劣效性,同时还要有可接受的安全性、稳定性和成本效益。历史上的多次失败,使得监管机构对此类产品的审评必然会更加严格。
结论:殊途同归的启示与分野
口服司美格鲁肽的成功与口服胰岛素的百年困局,为大分子药物口服递送领域提供了教科书式的正反案例。两者的分野根植于技术、分子特性、临床价值与商业可行性的多重维度。
1. 技术平台是决胜基石:口服司美格鲁肽的胜利,本质上是其SNAC递送平台的胜利。该平台以相对普适、高效的单一分子方案,系统性地解决了肽类药物的胃肠道屏障,将生物利用度稳定在临床有效的水平。反观口服胰岛素,其固有的复杂结构与极端不稳定性,使得任何“打补丁”式的传统技术组合都难以在疗效、安全性与经济性之间取得平衡。
2. 分子特性与临床价值是根本驱动:司美格鲁肽分子本身经优化后稳定性高、半衰期长,其口服制剂更提供了“强效降糖+显著减重+心血管获益”的多重临床价值,超越了单纯的便利性。而口服胰岛素的核心价值仅在于“无针注射”,在现有技术下,其疗效的精准性与稳定性无法媲美注射剂,高昂的成本也使其在新型疗法面前缺乏竞争力。
3. 商业可行性是最终裁判:诺和诺德对口服胰岛素项目的果断放弃,清晰地表明:一项技术即便在科学上可行,若无法实现规模化、可负担的生产,也注定无法成为成功的商品。口服司美格鲁肽则证明了,通过革命性的制剂技术、严谨的临床开发与成熟的商业运作,攻克口服肽类药物的堡垒是完全可能的。
综上所述,口服司美格鲁肽的成功,为整个行业点亮了指路明灯。而口服胰岛素的破局,仍有待于未来出现能够系统性颠覆其递送难题的下一代技术。在此之前,它依然是制药科学领域那个充满诱惑却又遥不可及的“圣杯”。
参考文献:
1. The development of oral semaglutide, an oral GLP‑1 analog, for the treatment of type
2. diabetes2.Oral Semaglutide: A Review of the First Oral Glucagon-Like Peptide-1 Receptor Agonist
3. Oral Insulin: Challenges and Potential Solutions with a Case Study of Pharmaceutical Company Ventures
4. Critical updates on oral insulin drug delivery systems for type 2 diabetes mellitus
5. 首个口服胰岛素在国内申报上市争议:海外临床失败,巨头纷纷被“劝退”
扩展阅读:
1. 诺和盈获批:全球首款长期体重管理司美格鲁肽注射液登陆中国…
2. 诺和诺德司美格鲁肽再闯新关:CKD适应症申请获CDE受理
3. 第6批国采(胰岛素专项)执行在即!多地发文,5月底将执行!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论