
近日,启函生物宣布其自主研发、具有全球权益的首款通用型、双靶点(CD19/BCMA)CAR-T细胞产品 QT-019B 的新药临床试验申请,已获得国家药监局的默示许可。QT-019B 是首个连续获得美国FDA和中国CDE默示批准的由中国企业自主研发的通用型双靶点CAR-T细胞产品。目前,其首个适应症为难治性系统性红斑狼疮(rSLE)。
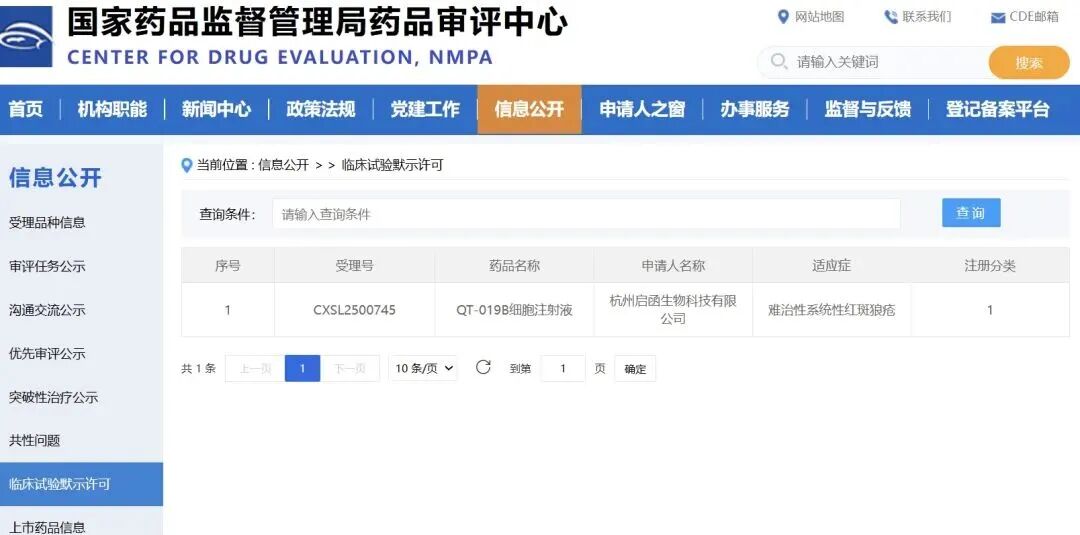
QT-019B针对CD19和BCMA双重靶点,有望满足不同类型自身免疫性疾病的医疗需求,可能适用于诸多与自身抗体相关的疾病。公司将结合自身免疫性疾病患者未满足的临床需求、研究者发起的临床研究(IIT)数据,以及考虑不同适应症的注册路径,将陆续开发包括多发性硬化(MS)、自身免疫性溶血性贫血(AIHA)、特发性肌炎(IIM)等在内的适应症,以满足更广泛患者的医疗需求。
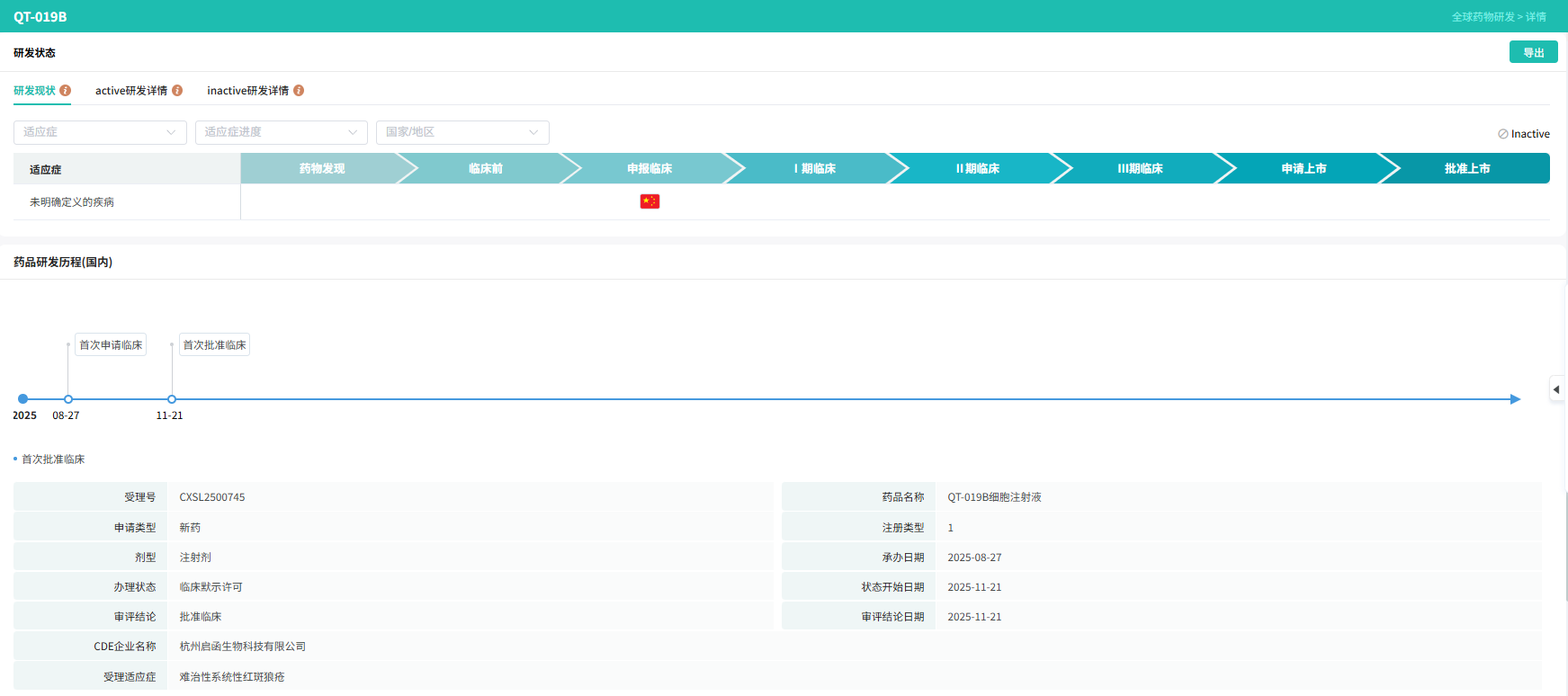
截图来源:摩熵医药数据库-全球药物研发数据库
启函生物由杨璐菡博士与乔治·丘奇(George Church)教授共同创立,是一家致力于将高通量基因编辑技术应用于细胞治疗和器官移植领域的生物科技公司,旨在为罹患严重疾病患者提供安全、有效、可规模化和全球可及的治疗方案。

利用先进的基因编辑技术和对移植免疫学的深刻理解,启函建立了独有的“移植免疫兼容”的细胞和器官平台,用于生产能够躲避宿主免疫攻击的新一代细胞和器官,应用于同种异体和异种移植。 在同种异体方向上,公司致力于产生各种基因改造的人类细胞和组织,包括用于免疫肿瘤学的免疫细胞以及用于再生医学的胰岛细胞、心肌细胞和神经元细胞等。在异种方向上,公司使用多基因编辑的猪作为生物反应器来“生产”安全有效的异种器官,致力于拯救需要器官移植的患者。
公司还将重点研发用于治疗自身免疫性疾病的下一代通用型CAR-T产品。公司将结合近期已获专利的科研成果,旨在降低或去除清淋化疗预处理,实现低/无清淋、单次给药治疗自免疾病的理想给药治疗模式。该产品将陆续进入研究者发起的临床试验阶段,未来进一步推进IND新药开发申请,致力于打造无清淋、安全有效且价格合理的理想治疗方案。
参考来源:
[1] CDE官网
[2] 摩熵医药(原药融云)数据库
[3] 启函生物官方披露
扩展阅读:
2. 新型CAR-T细胞疗法生产工艺!3天内,可生产抗CD19 CAR-T 细胞
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论