

2022年3月31日 ,中国上海 —— 嘉和生物药业(开曼)控股有限公司(简称“嘉和生物”或“公司”,股票代码:6998.HK)公布2021年度业绩,就公司在2021年度的重要进展和业绩成果进行分享。
截至目前,嘉和生物已经实现佳佑健®(英夫利西单抗,GB242)的成功获批和商业化在即;杰洛利单抗报上市申请被CDE纳入优先审评,未来预计将有多个产品递交上市申请;成功优化产品管线、加速重点临床项目推进;搭建全球首创/全球最佳、差异化、免疫肿瘤双/多特异性抗体研发平台,开启全球首创/全球最佳(FIC/BIC)自主研发的征程;大力布局全球创新和外部授权与合作。
嘉和生物董事会主席兼首席执行官郭峰博士表示:
“嘉和生物已经为未来四年设定了明确的战略目标,并制定了清晰的执行规划。通过丰富创新管线、对全球自研FIC/BIC研发管线的高效推进,加速推进临床研发管线,多个品种的成功上市销售,和对外授权与合作;嘉和生物将持续加速践行自主创新与布局全球,并依托卓越的执行力和紧密的跨部门合作,不断创造佳绩。”
具体而言,嘉和生物计划于2022年着力实现:
- 佳佑健®(英夫利西单抗,GB242)的成功商业化推广。艾比宁®(杰洛利单抗,GB226)复发或难治性外周T细胞淋巴瘤适应症的获批上市,并积极寻求其他适应症和新联合疗法的潜力。
- 持续加速推进重点项目,包括GB492 (IMSA101)与GB226联合治疗的临床1期试验及初步临床POC验证;以及后续对GB491 (CDK4/6)一线、二线治疗HR+/HER2-晚期乳腺癌3期临床试验的快速推进。
- 持续加速推进重点项目,包括GB492 (IMSA101)与GB226联合治疗的临床1期试验及初步临床POC验证;以及后续对GB491 (CDK4/6)一线、二线治疗HR+/HER2-晚期乳腺癌3期临床试验的快速推进。
- 推进多维度的有高度差异化的FIC/BIC潜力的早期研发项目探索,目前已有5个FIC/BIC双/多抗分子发现项目启动;GB267已经立项进入IND-enabling阶段。从2023年起,计划平均每年将有1个FIC/BIC潜力的自研新药研发候选药物递交IND。
- 达成与 mRNA药物研发平台就早期mRNA肿瘤免疫治疗研究的合作。
1 首个产品实现获批、商业化在即,更多产品将逐步实现获批与商业化
佳佑健®(英夫利西单抗,GB242)于2022年2月23日正式获得国家药品监督管理局批准,用于治疗类风湿关节炎、强直性脊柱炎、银屑病、成人溃疡性结肠炎、成人及6岁以上儿童克罗恩病、瘘管性克罗恩病。嘉和生物已经就佳佑健®(英夫利西单抗,GB242)的商业推广做好准备。
艾比宁®(杰洛利单抗,GB226)复发或难治性外周T细胞淋巴瘤(PTCL)适应症的新药报上市的申请已获国家药品监督管理局(NMPA)正式受理且被药品审评中心(CDE)纳入优先审评,并已成功通过药品注册临床现场及生产现场核查。
嘉和生物已上市\报上市产品
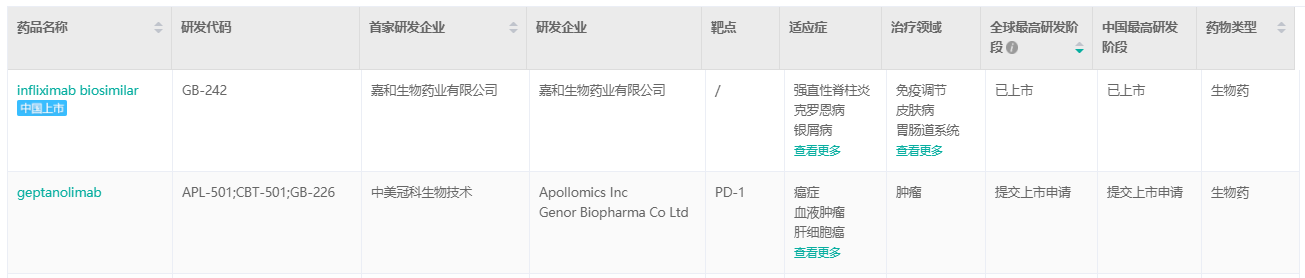
截图来源:药融云全球药物研发数据库
2 多个重点临床项目加速推进
经药融云数据库查询,嘉和生物产品管线目前除了1款已上市、一款报上市,还有多款产品正在紧锣密鼓地开展临床试验(3款处于临床3期、2款处于临床2期、以及5款处于临床1期)。
嘉和生物产品管线研发阶段
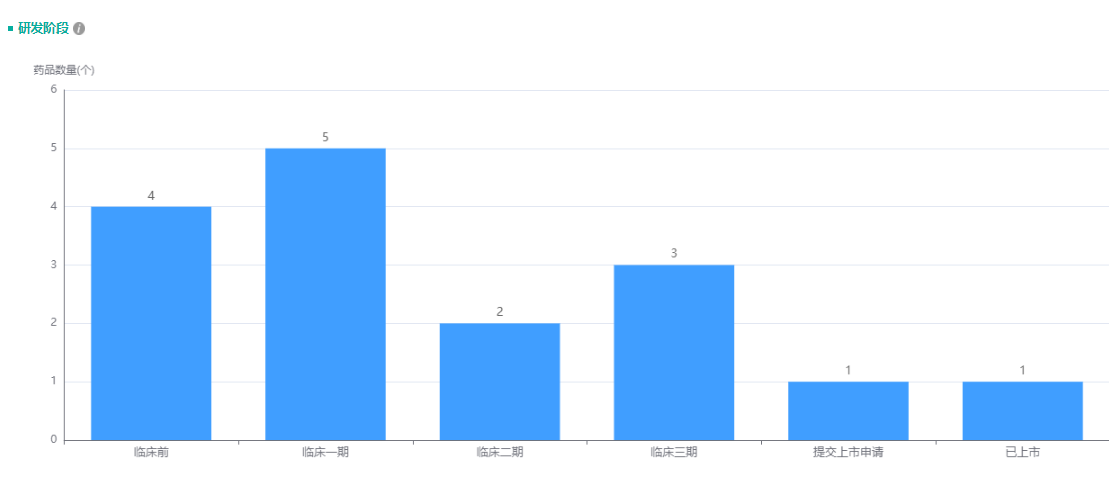
截图来源:药融云全球药物研发数据库
依托各部门的高度专业性和跨部门紧密合作,嘉和生物加速产品管线临床试验申请、快速推进临床进展。
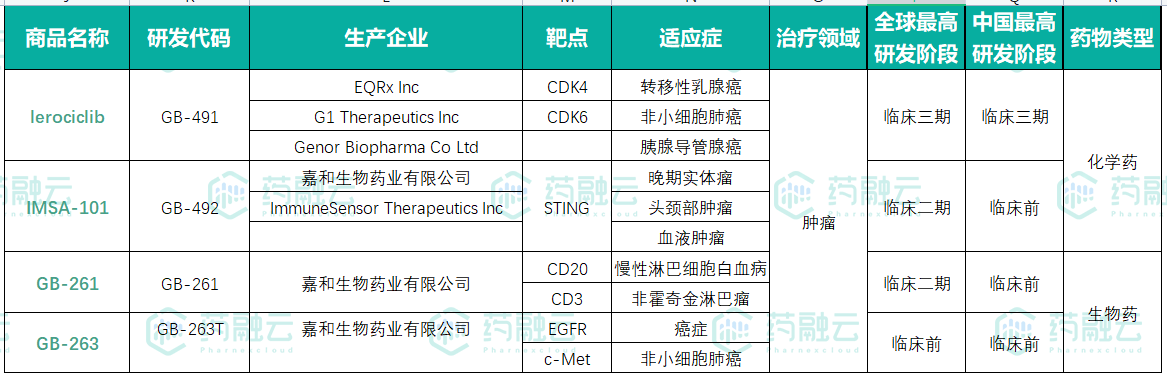
数据来源:药融云数据库
GB491(Lerociclib,细胞周期蛋白依赖性激酶(CDK) 4/6抑制剂)——致力于为乳腺癌患者提供安全性较佳且疗效优秀的CDK4/6抑制剂。
嘉和生物的GB491(Lerociclib)是一款新型、有效、高选择性口服CDK4/6抑制剂,与内分泌治疗相结合,治疗晚期乳腺癌。根据2020年欧洲肿瘤学术大会(ESMO)上发表的数据,GB491显示出更好的安全性、耐受性,使不间断的每天给药成为可能,长期用药获益更佳;有望成为同类最佳CDK4/6候选药物。
2021年5月,嘉和生物向国家药品监督管理局(NMPA)递交两项GB4913期IND申请:(1)联合来曲唑治疗一线HR+/HER2-晚期乳腺癌; (2)联合氟维司群治疗二线HR+/HER2-晚期乳腺癌,并于2021年7月获得批准。
- 以充分的临床数据证明产品无种族差异,成功豁免桥接试验,加速进入3期临床阶段。二线3期临床试验于2021年6月获得伦理委员会(EC)批准,于2021年10月完成首例患者给药(FPD),临床试验在快速推进中。
- 以安全性导入期的方式与3期临床试验无缝衔接,将3期临床试验提前。一线3期临床试验于2021年8月获得伦理委员会(EC)批准,2022年1月完成首例患者给药(FPD)。
- 基于适应性及无缝衔接试验设计、科学的借鉴和数据桥接、无缝的注册策略及出色执行,持续加速一线及二线的3期试验。
嘉和生物CMC与项目管理团队在与中国、欧洲、美国的4家CDMO合作中,解决各种跨国家和地区CDMO技术和沟通问题,严格保证各国家(地区)相关法规符合性,于一年内成功生产原料药(API)、GB491临床药品与安慰剂供应3期研究,有力保障项目的高度推进。
GB492(IMSA101)干扰素基因刺激因子(STimulator of Interferon Genes,STING)
GB492(IMSA101)为癌细胞固有免疫感知的主要介质。多项研究表明,STING激动剂可以激活cGAS-STING信号,与其他免疫检查点抑制剂(ICI)联合使用时,可显著增强癌症免疫周期的疗效,这可能成为一种潜在的首创疗法。
2021年3月,嘉和生物向国家药监局提交GB492的IND申请,并于2021年5月获得IND批准开展1期临床试验以评估GB492单药治疗及与PD-(L)1单克隆抗体联合用药治疗晚期/难治性恶性肿瘤患者的安全性及初步疗效;7月获得EC批准,随后在2021 年9 月于中国完成首例患者给药,并在2022年1月完成单药第一个剂量组(400ug)爬坡。
嘉和生物该临床试验采用创新的FIH试验设计将GB492单独给药时和联合GB226给药时的剂量递增相结合,是国内首个获批临床的STING激动剂联合疗法。2022年1月,成功获得药品审评中心(CDE)批准,豁免单药爬坡,直接进入联合PD-1爬坡试验。
GB261 (CD20/CD3,双特异性抗体)
GB261(CD20/CD3)是内部研发的针对CD20及CD3的新型双特异性抗体,是首个与CD3 结合亲和力低并保持Fc功能(ADCC 及CDC)的T细胞衔接器。
嘉和生物于2021 年 3 月,向澳大利亚Bellberry临床研究伦理委员会递交GB261的FIH临床试验申请。2022年3月18日,国家药品监督管理局(NMPA)受理GB261的临床试验申请。
利用差异化的产品特点,GB261临床试验起始剂量被认为高于同类型的化合物,在保证安全性的同时,尽量减少患者暴露于无效剂量,因此极大地提高了剂量爬坡的效率。
嘉和生物第一个剂量组已经完成, 初步数据显示没有CRS,且本品T1/2超过一周。表明GB261在较高的起始剂量下安全,与产品设计、临床前及差异化特点一致。
GB263T(EGFR/cMET/cMET,三特异性抗体)
GB263T是具有高度差异化设计的一种靶向EGFR及两种不同cMet表位的三特异性抗体。
嘉和生物于2021年12月20日向澳大利亚Bellberry临床研究伦理委员会递交GB263T的FIH临床试验的临床试验申请,并于2022年3月28日获得EC批准。同时,GB263T在中国的临床试验申请也已经于2022年3月28日获得国家药品监督管理局正式受理。
GB263T的研发推进充分展现跨团队合作优势,提升了嘉和生物的全球化能力和创新实践。有赖于与全球知名KOL紧密合作,临床试验方案在毒理学数据获得当天即定稿,快速推进递交EC。
得益于嘉和生物集团强有力的CMC实力保障与快速推进的执行力,GB263T在短短12个月的时间内,便按照国际化标准,完成了工艺技术开发、毒理及临床用药生产、临床试验申请等工作,远快于行业平均时长。该品种表达量高达5-6g/L,纯度高达99.5%,产品质量良好。
3 建立有FIC/BIC潜力的自主研发管线
嘉和生物成功搭建早期发现全球首创/全球最佳、差异化、免疫肿瘤双/多特异性抗体研发平台。持续以解决未满足的临床需求为出发点,专注开发有FIC/BIC潜力的靶点和项目,近30人的早期新药研发核心团队拥有从创新靶点分子发现到 IND 递交的新药研发能力和临床前研究一体化平台。
早期研发的抗体发现和抗体工程研发团队具备抗体亲和力测定和结合表位分析技术及多靶点稳转细胞株等,助力高效、高质量的药物筛选。基于嘉和生物研发团队对靶点分子生物学,细胞生物学及免疫学机制的深入理解,进行了多维度的FIC/BIC潜力的创新探索。基于全球创新的立项理念,启动多个创新靶点项目、积极布局不同技术形式的管线。
4 吸纳高级管理人才、积极拓展全球创新
2021年度,嘉和生物进一步强化核心管理团队。2021年 1月首席科学官韩淑华博士加入本集团。拥有25年学术研究经验及新药研发经验的韩博士在肿瘤免疫、炎症和自身免疫性疾病等领域有很深的造诣,曾任美国贝勒医学院免疫学及病理学终身教授,并取得丰硕的学术成果。韩博士的加入帮助嘉和生物快速搭建起内部的高质量的早期研发团队,从靶点发现快速推进具有全球创新性的肿瘤免疫抗体项目。
2021年10月,梁其斌先生加入嘉和生物任首席技术官。梁其斌先生作为国际生物技术行业的资深人士,拥有近30年国际知名生物制药公司CMC及生产部门的运营和管理经验。梁其斌先生的加入将对进一步加强核心技术的创新能力起到积极影响,并带领团队在技术、研发、工艺、管理等方面高效创新。
拓展全球创新方面,嘉和生物于2021年12月任命来自中国、美国、英国和澳大利亚等地的多位世界领先的肿瘤免疫学家和临床肿瘤关键意见领袖成为嘉和生物科学顾问委员会的成员。(包括Alex A. Adjei博士、Zhijian Chen博士、Yangxin Fu博士、David Kerr CBE博士、Leonard Saltz博士、John F. Seymour AM博士和John R. Zalcberg OAM博士。)
诸位全球顶级科学家的加入,也体现了他们对于嘉和生物研发理念、科研实力,和不断探索精神的高度认可。他们的加入将加快嘉和生物全球创新的步伐,为嘉和FIC/BIC立项和差异化管线的搭建进行评估、筹谋划策并提供宝贵的建议;还将支持候选药物在中国、美国、澳大利亚以及欧洲临床开发的快速推进。
5 财务摘要
据嘉和生物公布的2021年度业绩显示:
- 于报告期内, 研发开支为人民币6.127亿元。有关支出主要归因于(i)新药研发费及正在进行的临床试验开支及(ii)员工薪金及相关福利成本。
- 于报告期内,全面亏损总额为人民币8.658亿元,而截至2020年12月31日止年度则为人民币30.328亿元,主要由于根据香港财务报告准则,优先股于本公司首次公开发售中转换为普通股后,截至2020年12月31日止年度,本集团就优先股公允价值亏损净额录得非经常性亏损人民币19.338亿元。
- 根据非香港财务报告准则计量,于报告期内,经调整亏损(1)为人民币7.028亿元,而截至2020年12月31日止年度则为人民币6.546亿元。
(1) 经调整亏损乃按于2021年及2020年之亏损扣除(i)优先股的公允价值亏损,(ii)以股份为基础的付款开支,(iii)汇兑亏损净额及(iv)上市开支计算。
关于嘉和生物
嘉和生物药业(简称“嘉和生物”,股票代码:6998.HK)成立于2007年,是一家创新驱动型生物制药公司;目前已拥有强大的产品管线,涵盖全球前三大肿瘤(乳腺癌、肺癌、胃肠道肿瘤)以及血液肿瘤。
立足中国、布局全球,嘉和生物着力打造一个具备药物创新研发、临床前研究、临床开发、注册、CMC开发以及商业化生产的创新性、平台型、一体化公司。
嘉和生物搭建早期发现全球首创/差异化、免疫肿瘤双/多特异性抗体研发平台。通过位于中国上海业界领先的,在大分子药物开发领域拥有丰富经验的CMC(化学、生产和质量控制)工艺技术研发中心,公司拥有国际先进的工艺流程开发能力、临床前及临床用药生产能力,强大完善的分析检测能力和完备的质量体系。
嘉和生物位于中国云南玉溪的商业化GMP生产基地拥有领先的高表达量连续灌流培养技术(~20g/L)、自主研发培养基、高成本效益的商业化生产能力和一支高度满足GMP合规性的技术团队,高效实现嘉和产品线III期临床及关键临床研究用药生产、上市工艺验证及最终上市产品的商业化生产。
想要解锁更多药企信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企创新药产品布局、基本信息以及研发阶段、仿制药申报情况、药物销售情况、投融资情况、年报与前景,可否投入!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论