

上篇谈到了确定了终分子,此篇将为大家介绍IND阶段的CMC研究,即药学研究部分。
IND: Investigational New Drug 临床用新药申请。
CMC:Chemical Manufactural Control 药学研究
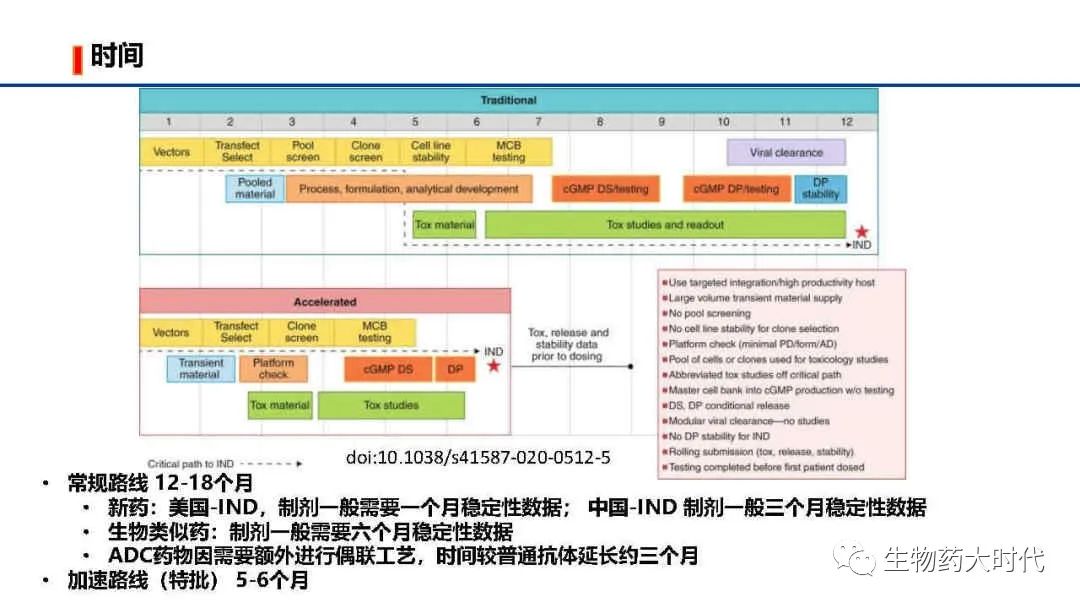
抗体药物常用哺乳动物表达,以常规CHO细胞流加为例仅细胞流加培养周期仅长达14天,大规模生产时需要扩种,仅得到细胞收获液就需要一个多月时间。因而抗体药物CMC开发(药学开发)时间较化药长很多,成本也高很多。
不同公司,不同类型药物整个IND开发(代指从序列开始CMC+非临床研究总时长)时间不同。
- 常规路线 12-18个月
新药:美国-IND,制剂一般需要一个月稳定性数据; 中国-IND 制剂一般三个月稳定性数据
生物类似药:制剂一般需要六个月稳定性数据
ADC药物因需要额外进行偶联工艺,时间较普通抗体延长约三个月
- 加速路线
(特批路线,需要多部门联用)可缩减到5-6个月,一般是新发传染病爆发,如本次的新冠疫情,药明生物6个月内完成了某新冠抗体IND阶段所需的CMC开发工作。最主要的区别在于直接用目的质粒转染后的细胞直接进行毒理和工艺开发(常规则需要用筛选得到单克隆细胞进行毒理样品的生产)。
由于生物制品固有生产特性,一般而言,工艺稳健性与开发时间呈正相关,同时项目风险也会随开发时间延长而降低。 因而需要平衡好时间和风险。
根据药物类型不同,整个开发周期不同。
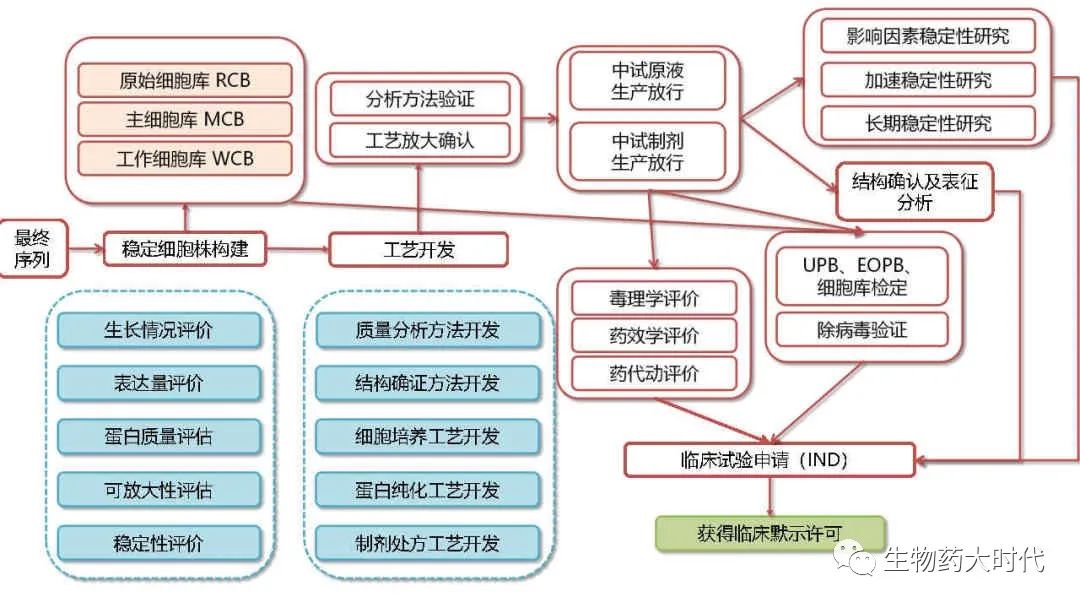
本文主要探讨的是常规路线,且不涉及类似ADC药物等需要进一步偶联或其他处理的抗体。
该图展示了整个IND开发的示意图。 本文将展开阐述。
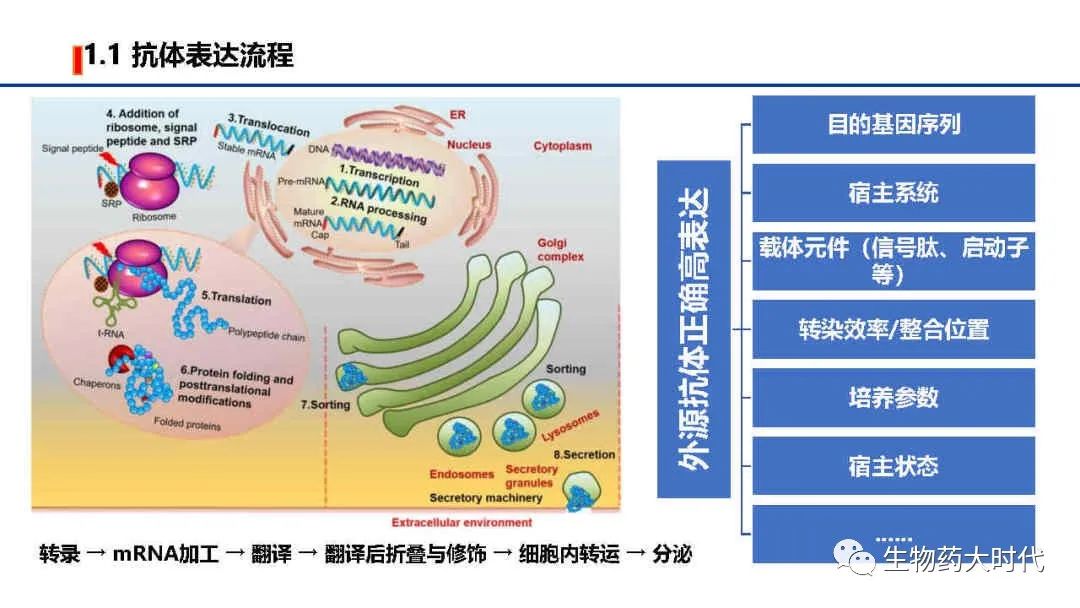
首先还是介绍下抗体在细胞内的表达过程,左图为示意图:
1、遗传信息细胞核内由DNA转录成mRNA。
2、mRNA前体加了5’端的帽子和3’端的polyA和剪除内含子后形成成熟mRNA,
3、转移至细胞质。
4、mRNA与核糖体、信号肽、信号识别粒子(SRP)结合。
5、在tRNA的帮助下翻译成蛋白质。
6、新合成的蛋白质经历翻译后修饰,并获得了可将其定位/分选到其正确位置的信号序列。
7、分选后,蛋白质通过高尔基体,被包含在分泌囊泡中,分泌囊泡与细胞膜融合,将蛋白分泌至细胞外。
而右图则是对抗体表达有影响的各类因素。
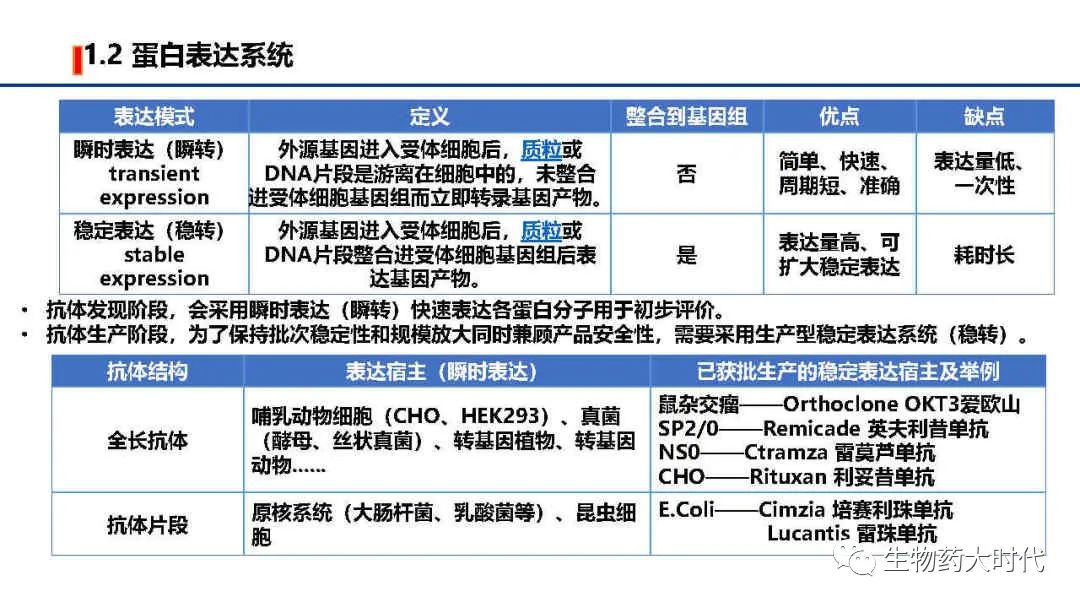
首先需要区分瞬转表达与稳转表达,简言之瞬转表达是一次性。而稳转表达方可通过不断扩种放大得到批次相同的产品。目前获批的抗体均需通过稳定表达体系生产。
另外考虑抗体折叠和翻译后修饰,全长抗体最主要的表达系统是哺乳动物细胞,此外还有酵母、转基因动物、转基因植物等;但临床上是使用的产品表达体系均是鼠源细胞,优势在于能够指导蛋白质的正确折叠,提供复杂的N型糖基化和准确的O型糖基化等多种翻译后加工功能,因而表达产物在分子结构、理化性质和生物学功能方面接近天然的高等生物蛋白质分子。 而植物等表达的蛋白会有独特的糖基化修饰,会导致免疫反应。
抗体片段如Fab、Scfv,其不需要Fc区域糖基化修饰,且折叠相对简单,则可用原核系统(大肠杆菌、乳酸菌等)、昆虫细胞进行表达。目前已获批的上市的Lucantis 雷珠单抗、Cimzia 培赛利珠单抗均是用大肠杆菌表达。
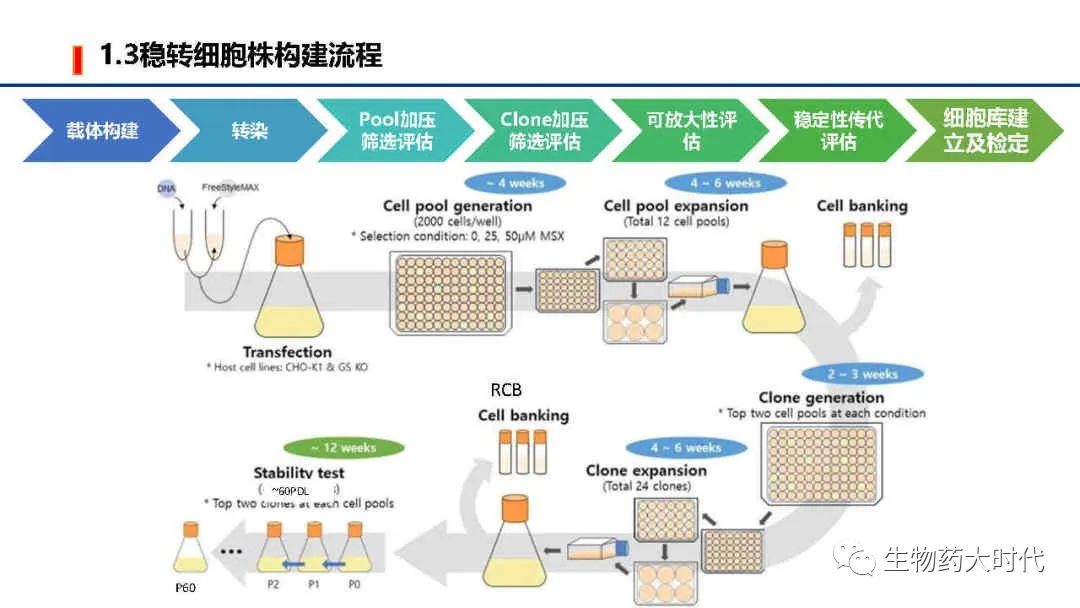
CLD: Cell line Development 细胞株开发
细胞株开发是CMC开发的起始,也是CMC工作中的核心。
可以说 “抗体序列决定整个项目的成败,而一个细胞株决定CMC工作研究的成败。”
载体构建—转染—细胞群pool加压筛选及扩培评价—单克隆细胞加压筛选及扩培评价—稳定性传代评估(60代)和可放大评估。
一般稳定性评估60代足以支持20000L的商业化培养,但若是连续流培养,稳定性评估会更多。
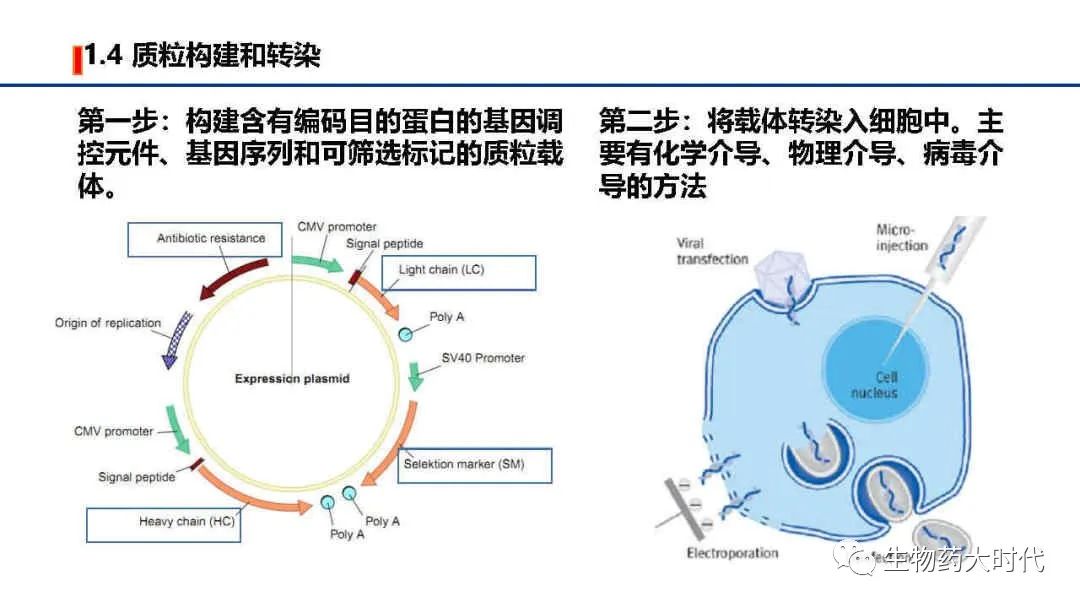
左图为表达载体-质粒的示意图:LC和HC则是目的抗体序列;Promoter为启动子,启动转录;signal peptide为信号肽,帮助蛋白分泌到细胞外;Selektion marker(SM)为筛选标记,如下一页所示,若是在GS缺陷型细胞中,此处可插入谷氨酰胺合成酶(GS)基因序列,使其表达;Antibiotic resistance 为抗性基因,也如下一页所示,将插入抗生素筛选标记,如氨基糖苷磷酸转移酶,则可用G418进行筛选。
右图则是将载体的转入到细胞中的示意图,化学介导如脂质体转染,物理介导如电转,病毒介导如慢病毒侵染的方法
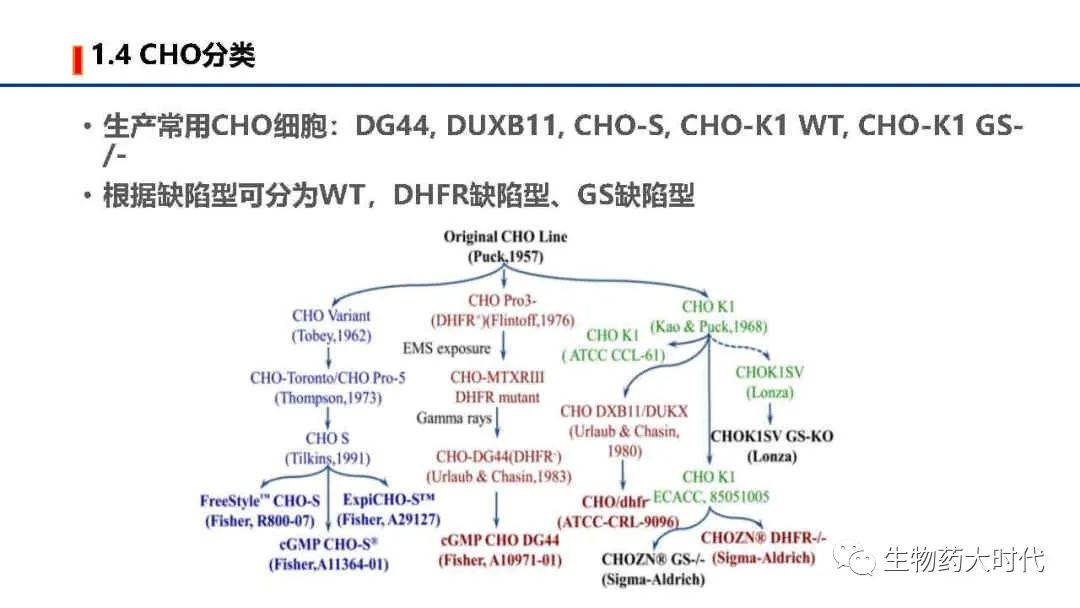
CHO细胞的优点
1. CHO细胞遗传背景清晰, 不易传播人类病毒, 具有很高的安全性, 以CHO作为宿主细胞表达生物蛋白质, 容易被药物审核机构, 如FDA审批通过;
2. CHO细胞可以通过悬浮驯化适应无血清悬浮培养, 并能够实现在无血清培养基中快速及高密度生长,这为药物的质量控制和大规模生产带来极大的便利和实惠;
3. CHO细胞表达的重组蛋白质能够获得类似于人源蛋白质的翻译后修饰, 如翻译后的糖基化修饰、 唾液酸化修饰等, 生产的蛋白质较其它表达系统更加与人体天然的生物蛋白质相似第四, 较少分泌内源性蛋白, 降低纯化难度;
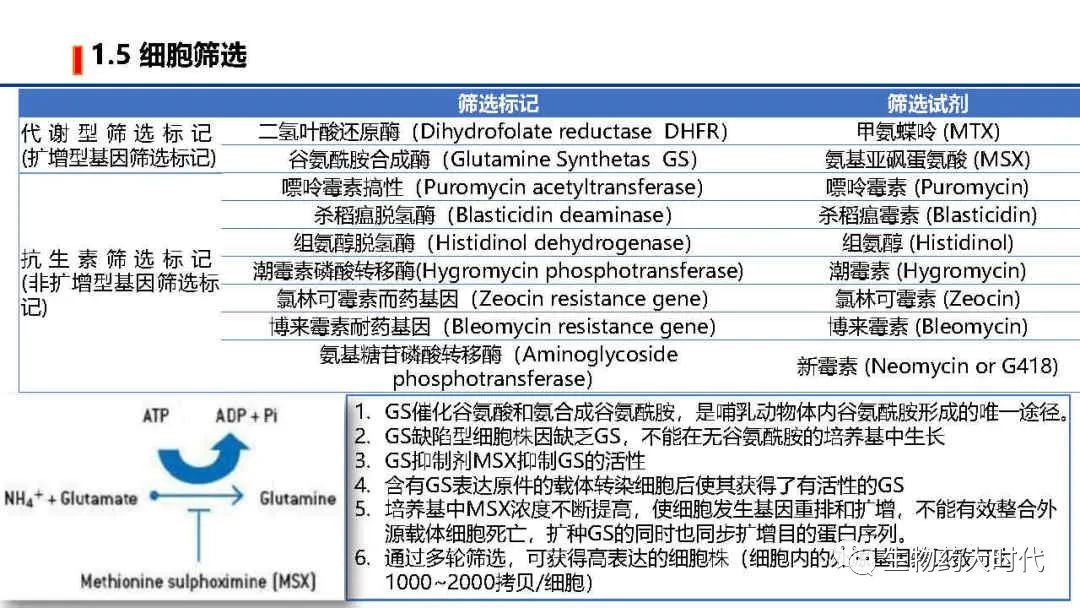
4. CHO细胞已经开发出了多种商业化高效高表达系统, 如二氢叶酸还原酶筛选体系、 谷氨酰胺合成酶筛选体系和遗传霉素筛选体系等。
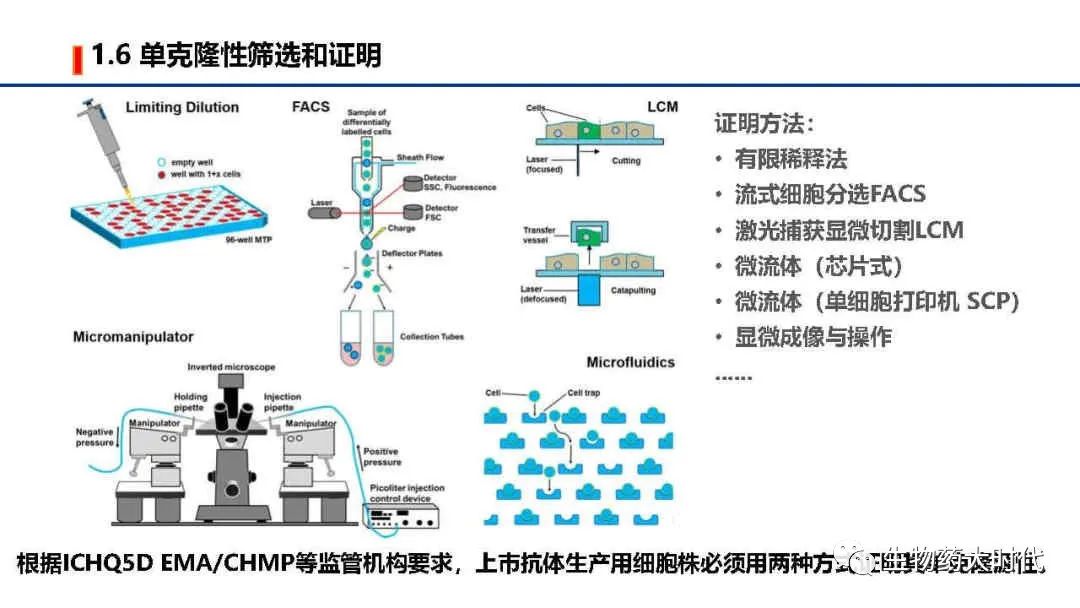
根据ICHQ5D EMA/CHMP等监管机构要求,上市抗体生产用细胞株必须用两种方式证明其单克隆源性。目前常用得到单克隆及证明的方法包括有限稀释法、流式细胞分选FACS、激光捕获显微切割LCM、微流体(芯片式)、微粒体(单细胞打印机 SCP)显微成像与操作等。
生物制品生产的放大不同于化学药,不只是容器投料量放大, 需要一步步将细胞扩大培养至相应规模,因而在这个过程,传代稳定是非常重要的。
CHO细胞在长期传代过程中存在的稳定性表达问题, 主要体现在:
- 1. CHO 细胞遗传不稳定性引起的表达不稳定
CHO 细胞系基因组本身具有不稳定性。通常, 中国仓鼠体细胞的染色体为 11 对22 条, 而中国仓鼠卵巢细胞的染色体则发生了大面积不稳定重排重组现象, 不同细胞系染色体的数目也不恒定。基因组的不稳定性, 主要表现在其染色体层面上的拷贝数变异。
- 2. 外源基因随机整合引起的表达不稳定
传统方法主要是通过表达质粒转染后, 利用压力筛选从而获得目的蛋白质表达细胞株。因此, 外源基因都是通过随机整合方式, 整合到CHO 基因组内。由于整合位点的不确定性, 可能在细胞培养后期引起表达不稳定。
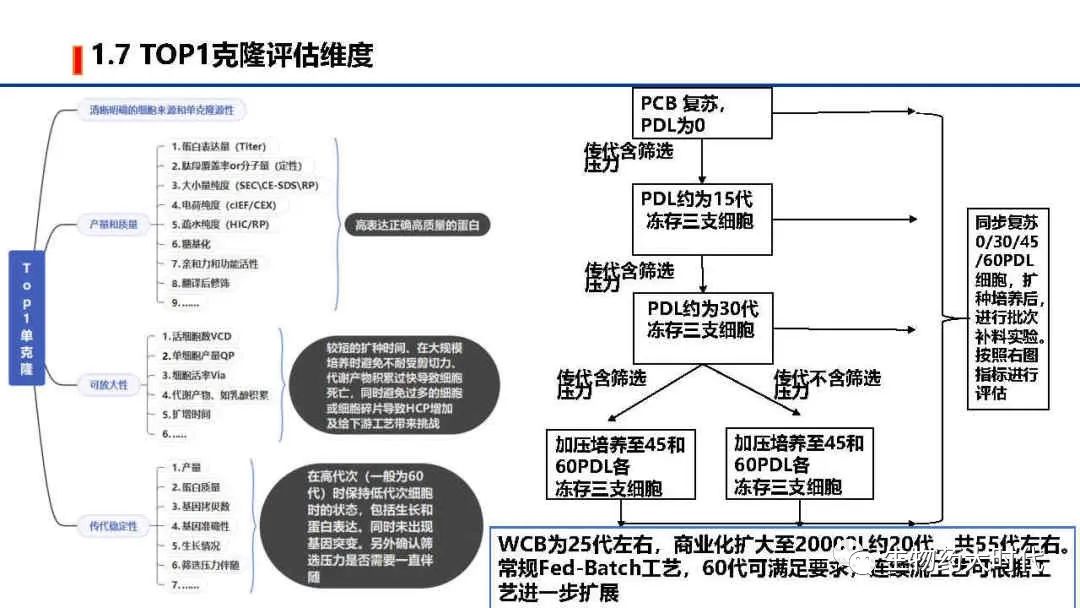
左图图展示了挑选TOP1单克隆的评估维度,包括了清晰明确的细胞来源和单克隆原性、产量和质量、可放大性、传代稳定性。
右图展示了稳定性评估的常规流程。 根据目前最大商业化规模为15000L,那么若进行批次流加工艺,能保证60代内稳定,则可认为该细胞稳定可用于后期商业化。连续流工艺可根据情况进一步扩展。
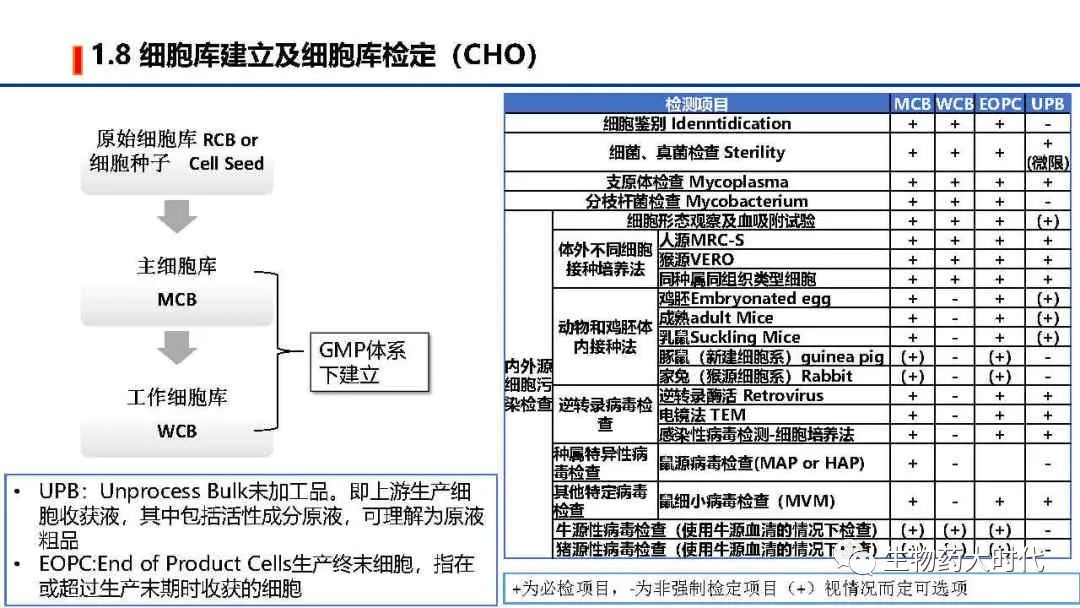
MCB/WCB需在GMP体系下建立。同步在生产过程中还需要检测UPB和EOPC, 在NDA前还需对“体外细胞传代限次细胞”进行检测研究。
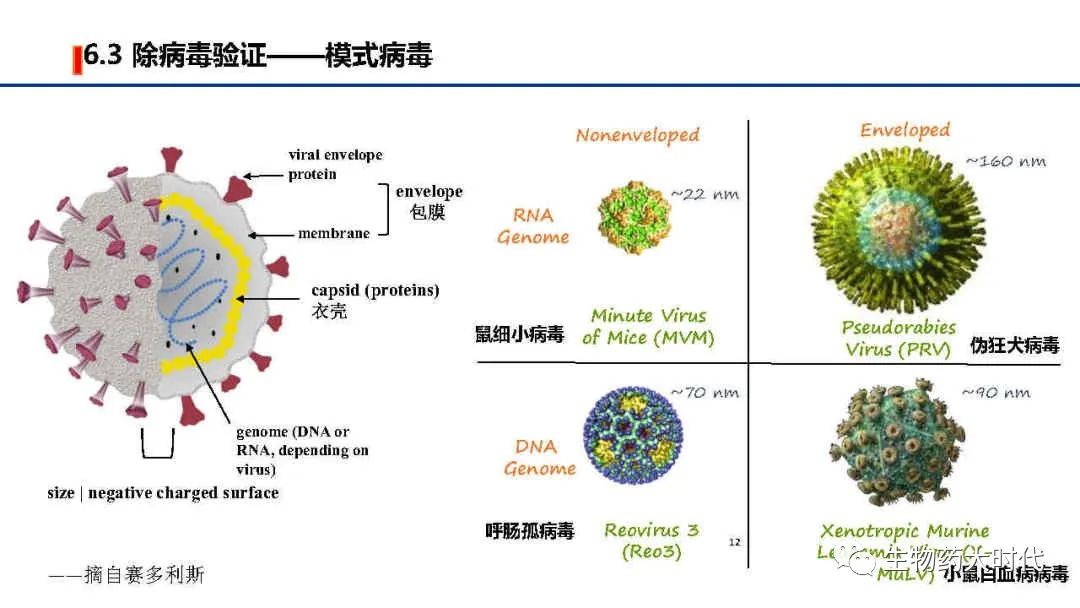
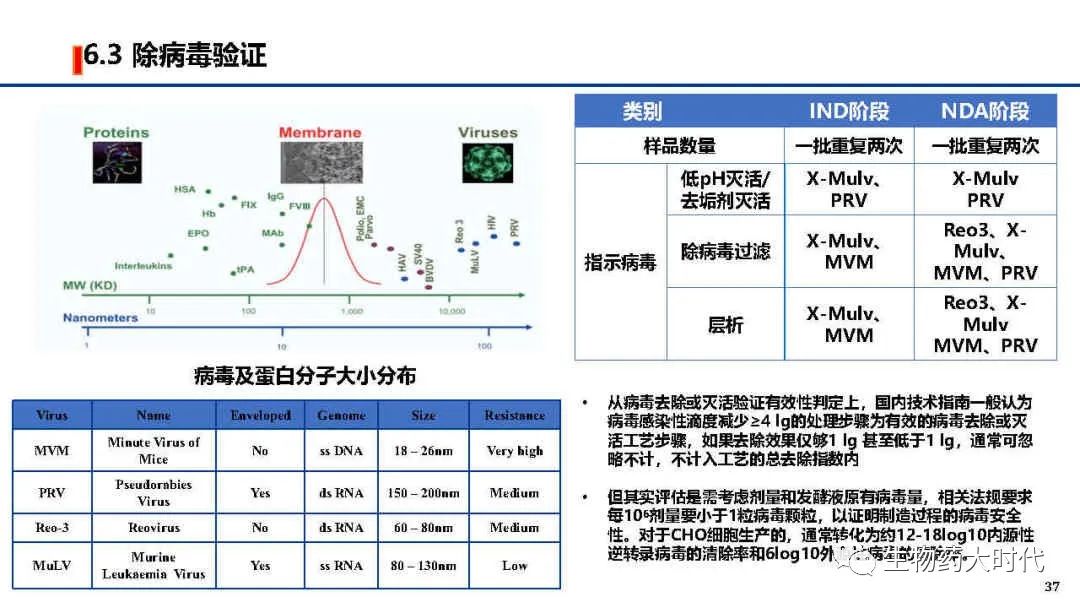
根据ICH Q5A 生物技术产品的病毒安全性评价 和中国药典《生物制品生产检定用动物细胞基质制备及质量控制》等有关规定,需对细胞库等进行检定,右图为常规的CHO细胞检测项目。
至此完成细胞株开发的全部工作。
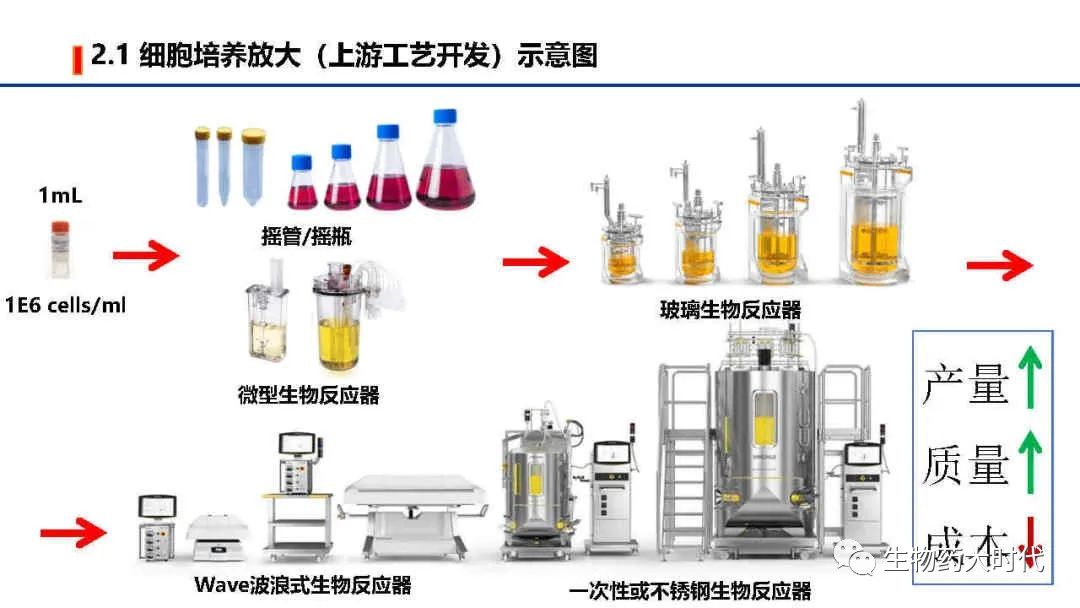
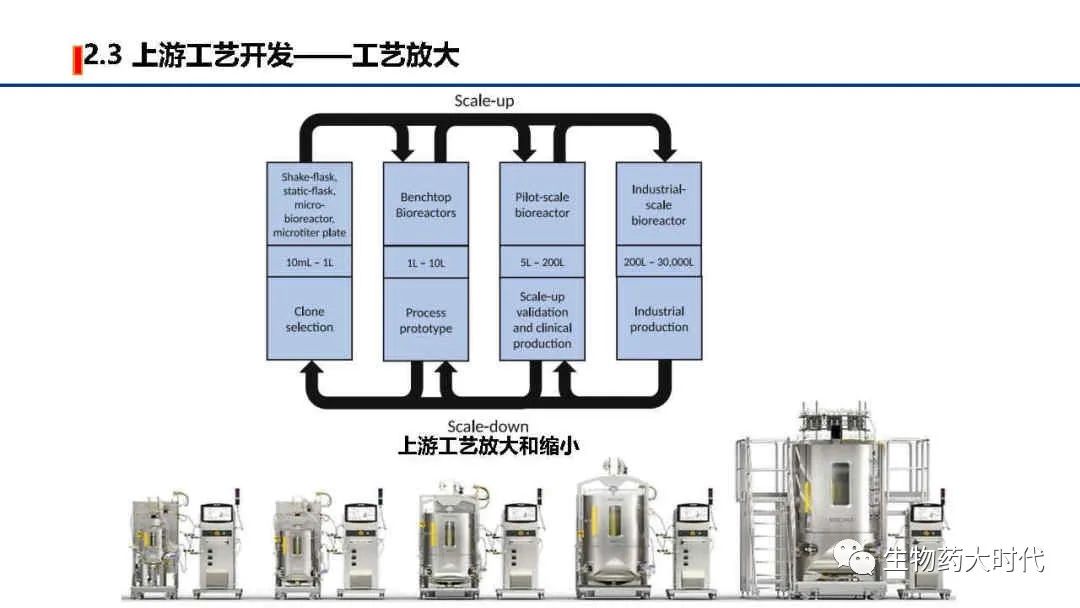
如图展示了,上游工艺开发的主要工作,以高产量、高质量、低成本为目标,探究如何从细胞库(一般为1ml,1E6个细胞数)开始,通过各种条件优化和参数控制,使细胞不断翻倍生长,至可扩大至中试规模(一般为200L以上)乃至商业化规模(2000L以上),在维持细胞存活生长的同时,保持有效的抗体生产能力。
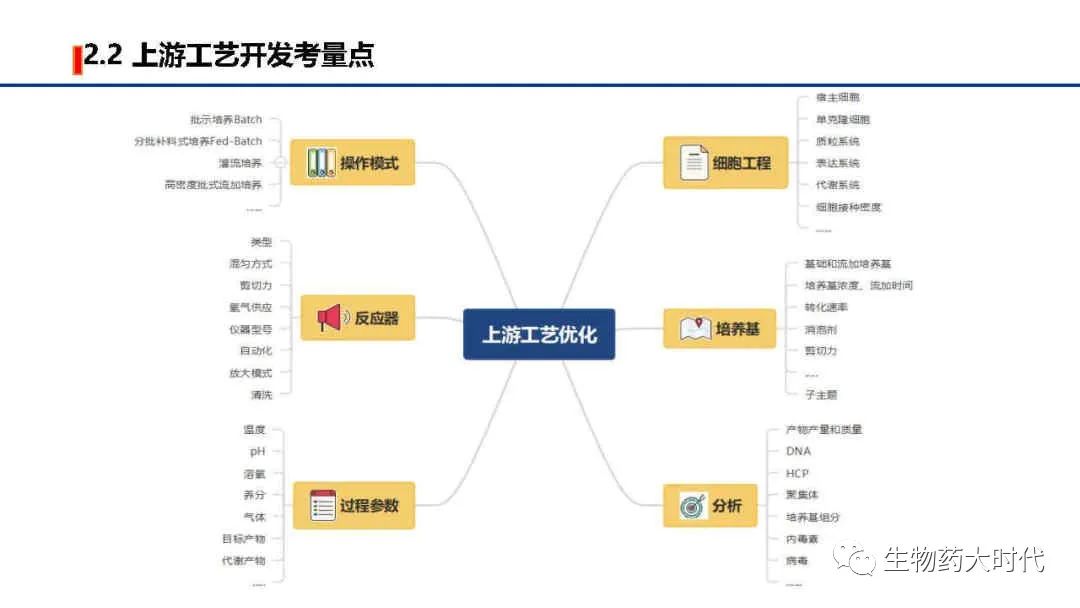
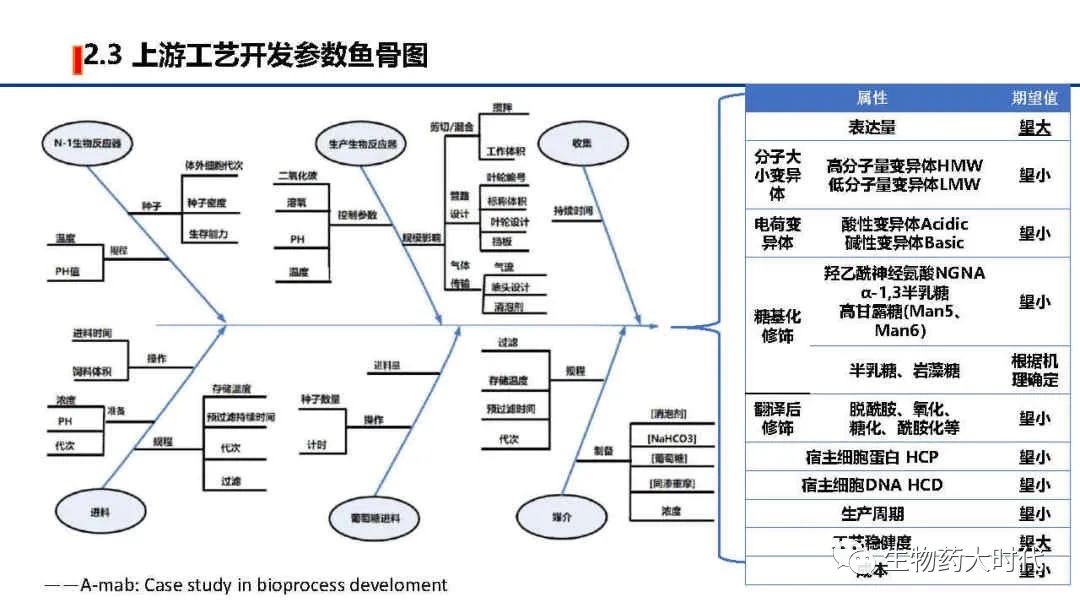
左图展示了培养过程中需要调控的各类参数,最终得到的细胞收获液中,希望实现表达量极大值, 各类产品相关物质(如分子大小变异体、电荷变异体)和工艺相关杂质(如宿主细胞蛋白质和宿主细胞DNA)极小值, 同时期望生产周期短(细胞扩增倍数短、细胞单产高,可使扩种阶段和蛋白表达阶段缩短时间)、成本低(如降低培养基的成本、同时单批次得到更多高质量蛋白),另一方面是希望工艺稳健度高,各个参数微小的变化都不影响细胞生长和蛋白表达。
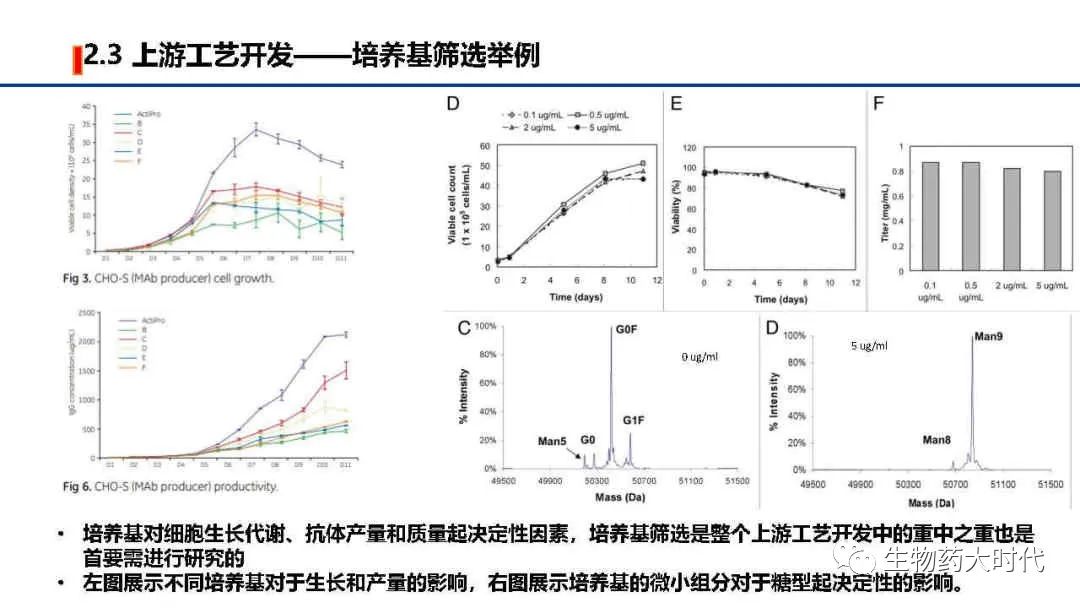
摘自 Yu M, Brown D, Reed C, et al. Production, characterization, and pharmacokinetic properties of antibodies with N-linked mannose-5 glycans. MAbs. 2012;4(4):475-487.
分泌性表达主要用到上述5大技术。 但若是包涵体表达抗体片段,如大肠杆菌Ecoli,对于大肠杆菌,最经常使用的方法是高压匀浆的方法,可以使细胞完全破碎,并且这种方法可以以不同的规模使用,2到5个循环可以使细胞完全破碎。酵母细胞由于含有更加有弹力的细胞壁,所以需要的循环可能更多,或者在容器中加入一些玻璃颗粒。破碎细胞还可以使用物理的方法如超声,或者化学的方法如化学试剂和酶,如溶菌酶和EDTA(乙二胺四乙酸)来破碎细胞。
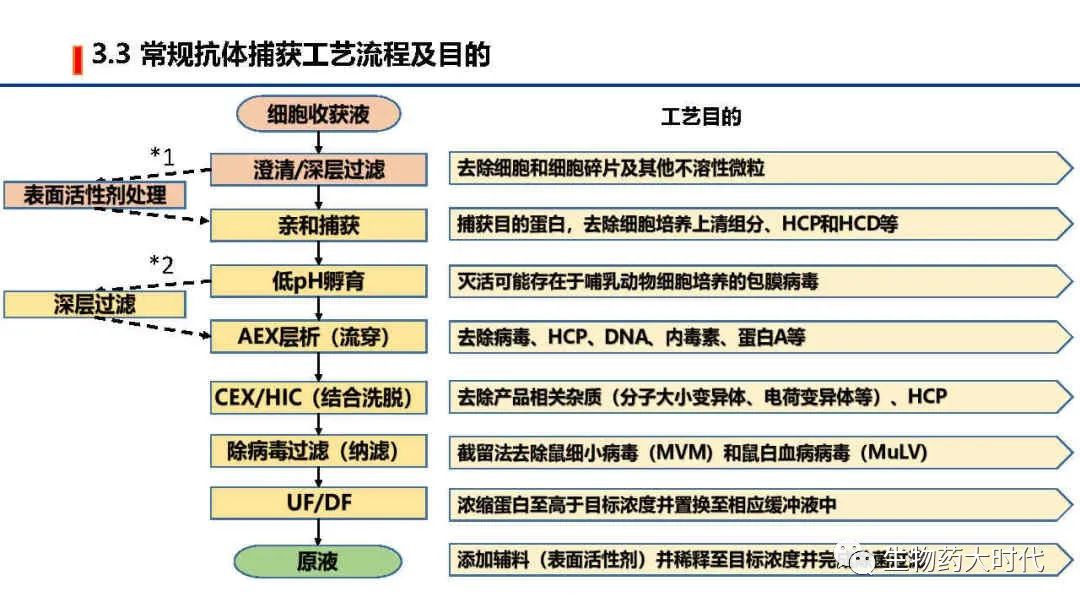
1、当抗体不耐受低pH孵育时,将1号途径采用表面活性剂处理的方式灭活病毒而不进行低pH孵育。 如某些不稳定的IgG4亚型抗体及其融合蛋白。
2、当某些抗体在经历亲和低pH洗脱或和低pH孵育后,会导致大量HCP蛋白沉淀(宿主蛋白大多等电点在4.5-7.0,经历由中性至3.5pH洗脱过程,会导致HCP因接近等电点溶解度下降而析出),表观现象为浊度显著增大,对后续的除菌过滤和柱层析造成较大影响。 因而此时根据需要进行二级的深层过滤,去除不溶性蛋白。
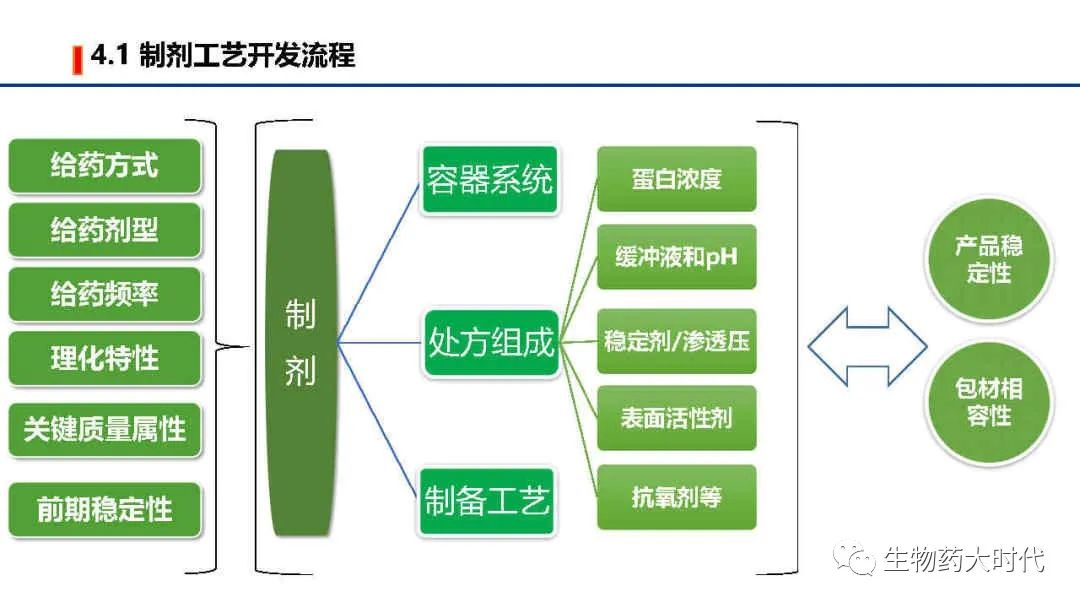

由于酸不稳定及生物利用度问题,目前上市的抗体药均是无菌注射剂。 给药方式分为 静脉滴注、静脉注射、皮下注射、肌内注射等。 皮下注射因输注的体积有限,因而给药剂量和抗体最高能达到的浓度需要额外关注。
首选是水针即溶液型,若水溶液不稳定,会考虑采用冻干。
若是多次使用时,处方组成需考虑防腐剂的种类和浓度。
根据上述需求,确定给药方式后,也随之确定了采用何种容器系统。 如皮下注射,可用预灌封或全自动预灌封注射笔以及卡式瓶配合注射笔的方式,若是多次给药,可以考虑卡式瓶配合注射笔方式。


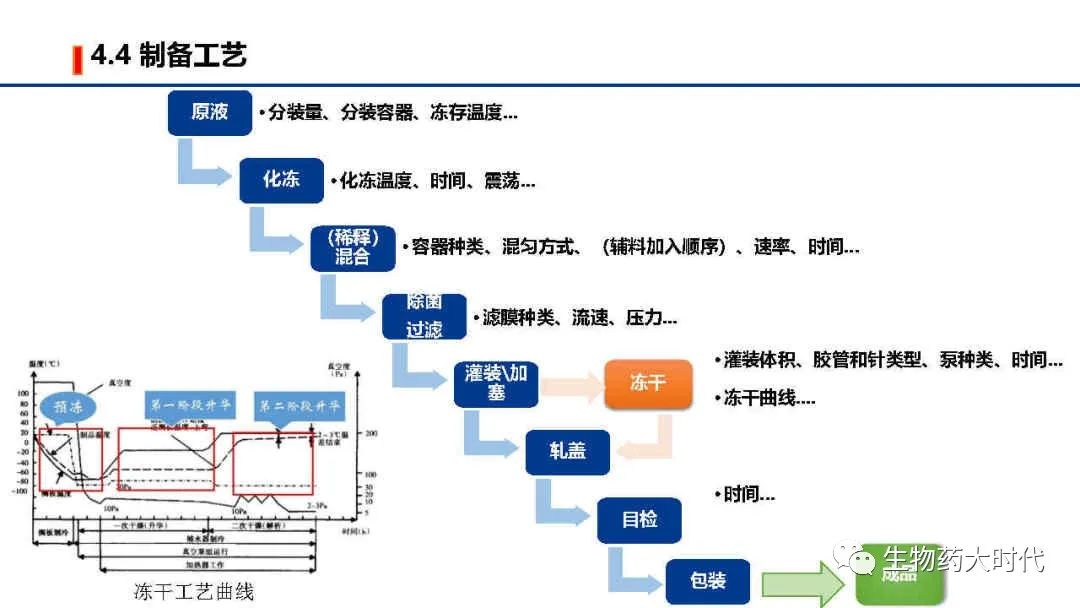
冻干为额外项,若产品水针不稳定,则在工艺开发时额外需要开发冻干工艺参数,即冻干曲线的绘制。 再制备中也同样在最终轧盖前完成冻干。
IND阶段,制备工艺研究较少,主要针对重要的参数进行摸索。 制剂工艺主要在临床期间对各参数进行详细的工艺表征和验证。
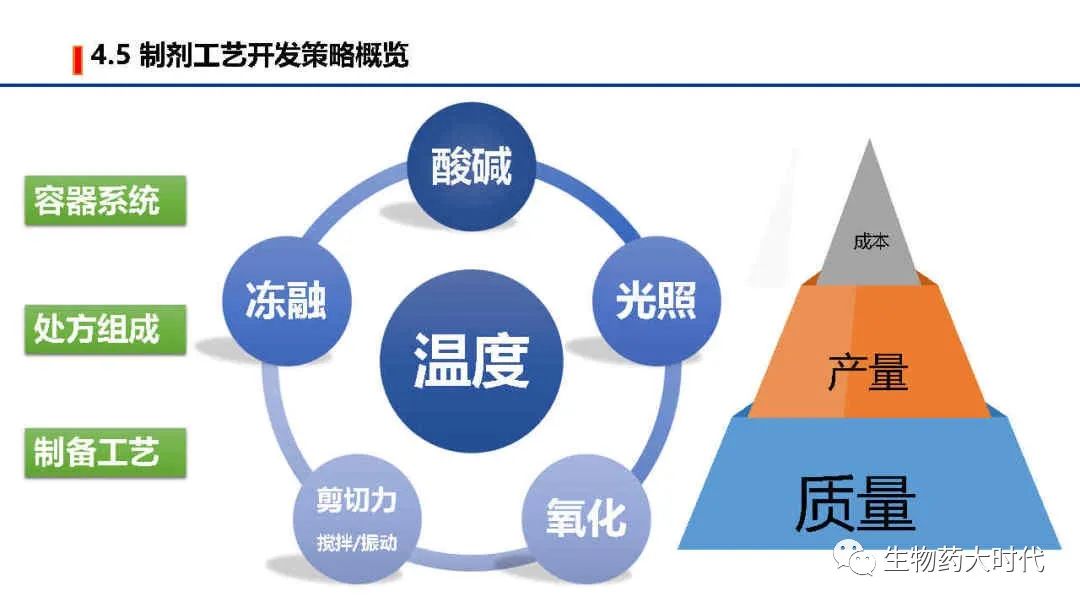
六个极端因素,即影响因素试验,用于筛选不同的处方组成、容器系统和制备工艺。 主要以产品质量作为主要目标,在制备工艺过程还需考虑产量/收率问题,最终需考虑成本。如对于冻干保护剂,在效果一样的前提下,会优选蔗糖,因为海藻糖的价格几乎是蔗糖的8-10倍。
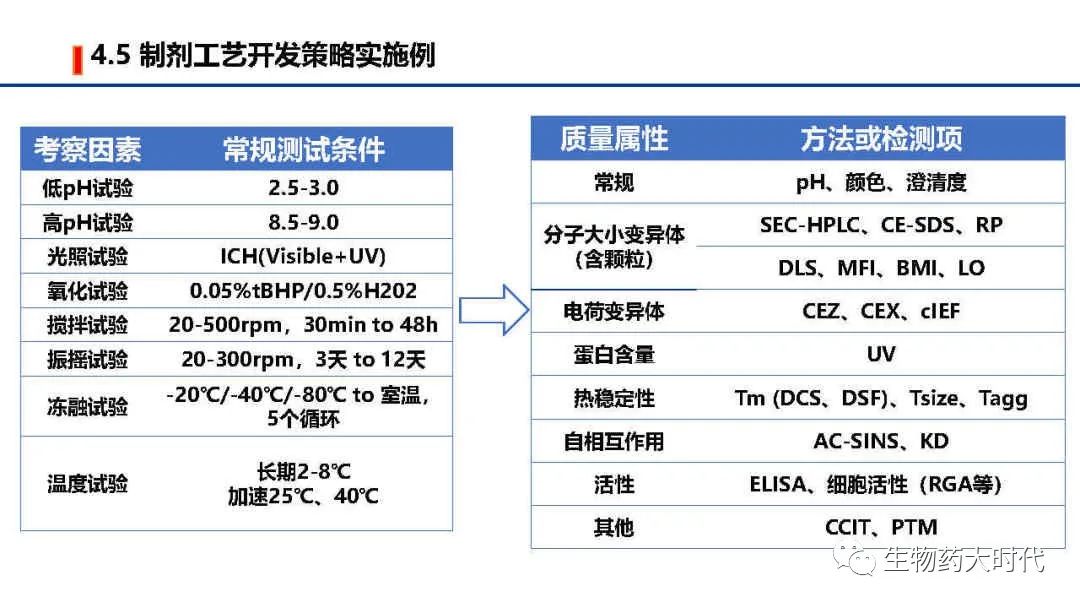
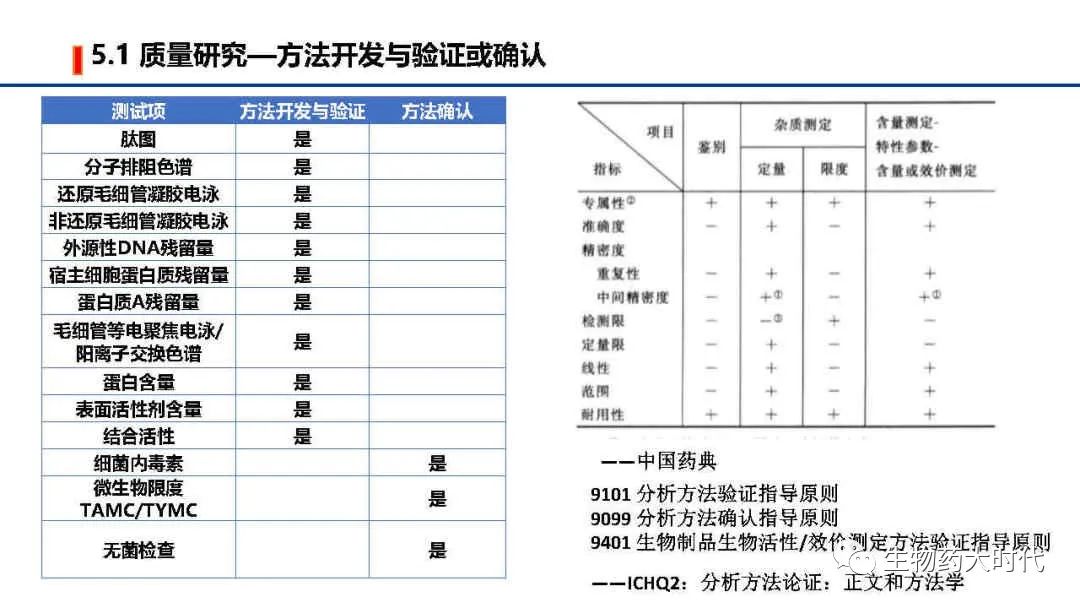

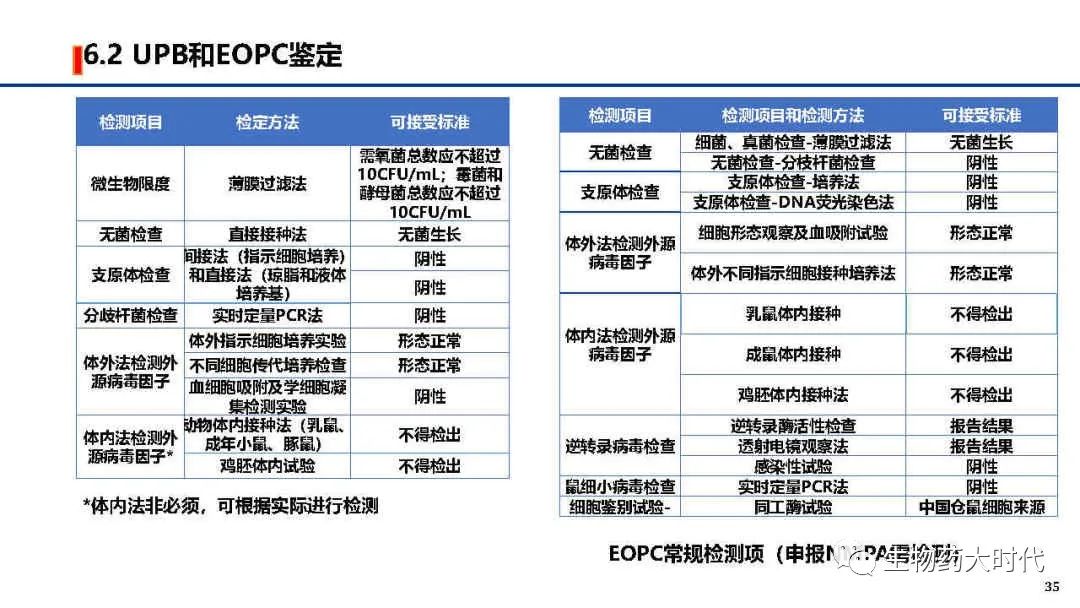
UPB:Unprocess Bulk未加工品。即上游生产细胞收获液,其中包括活性成分原液,可理解为原液粗品
EOPC:End of Product Cells生产终末细胞,指在或超过生产末期时收获的细胞
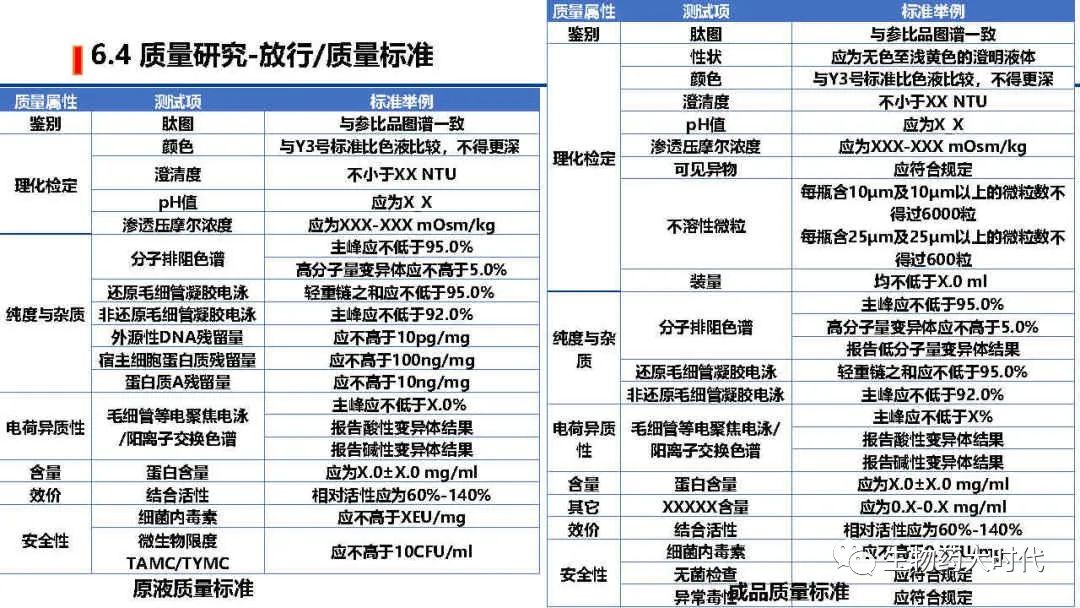
左图为原液常规的质量标准检测项和标准举例, 右侧则为成品质量标准检测项和标准举例。 鉴别最好是用肽图。但用icIEF CEX 活性等具体较高专属性的两个以上方法亦可。 同时效价一般用结合活性也足以,但在NDA阶段需要补充细胞活性方法。 同时IND阶段的质量标准范围较宽,后续代方法稳定和收集足够的数据后可进一步收紧。
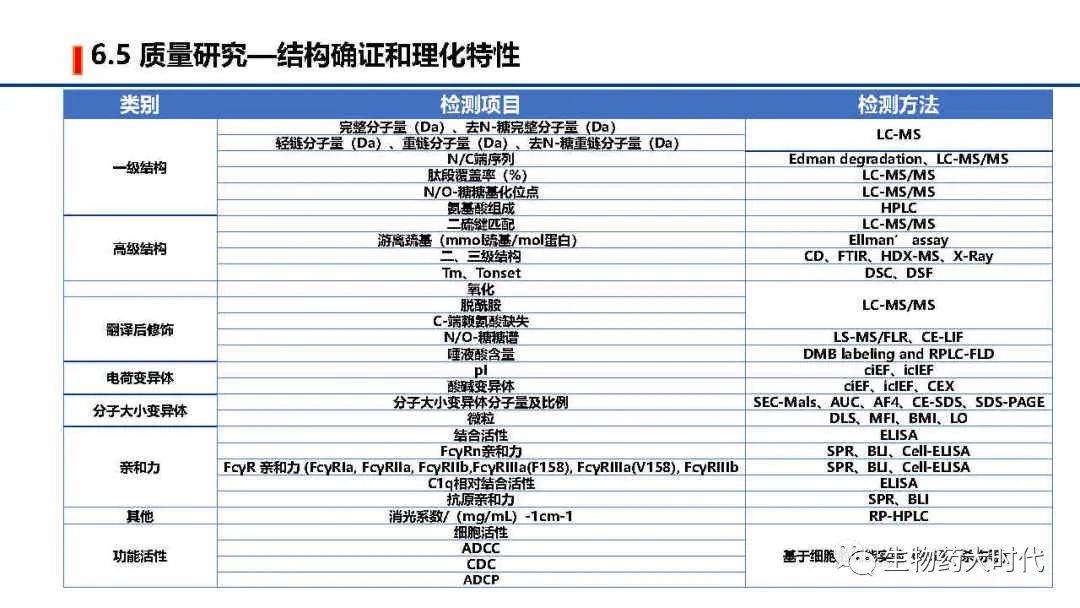
IND阶段也需要展开全面的结构确认和理化特性研究,但较NDA阶段可略删减,如功能实验的ADCC、CDC等部分,若抗体并非通过此作用发挥作用,可用亲和力检测进行代替。检测方法也可选其中完成即可。
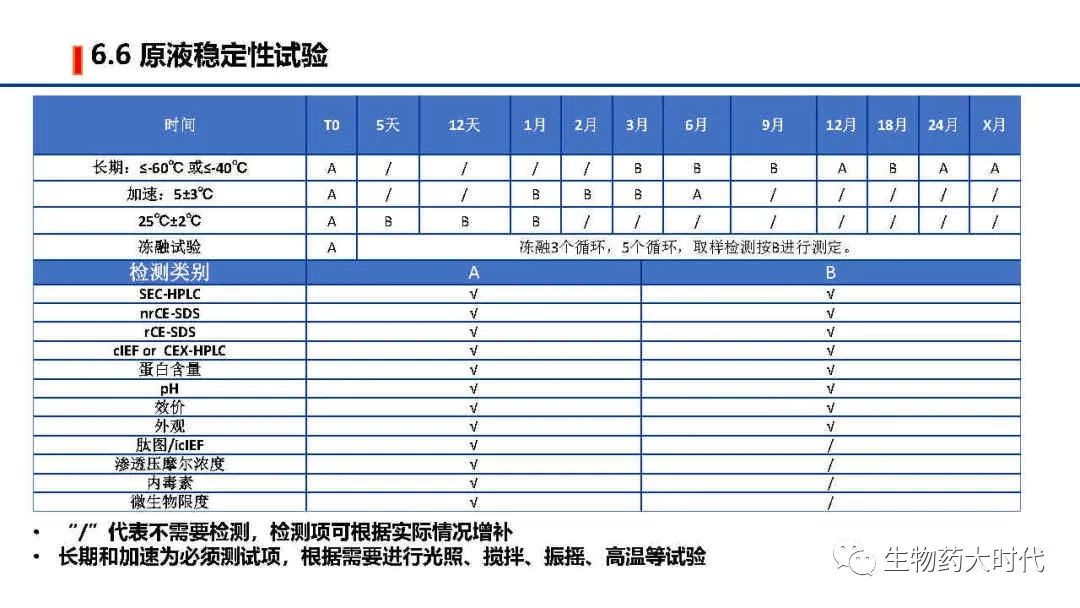
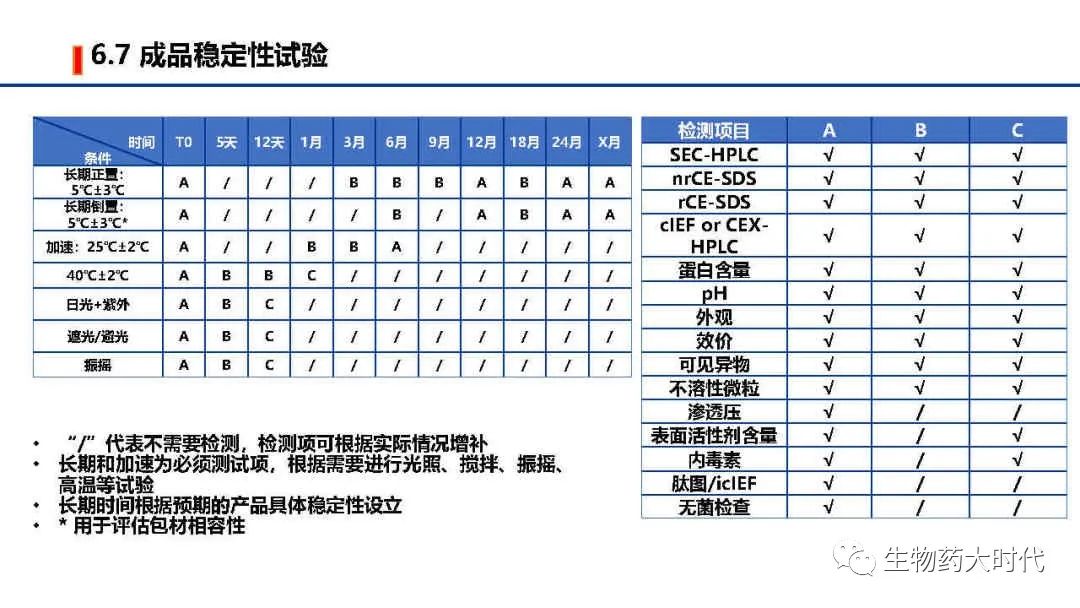

自此IND阶段CMC研究部分总体概览已经完成,IND阶段的cmc研究相比于NDA会简略很多,对于某些工艺开发的操作范围摸索的不会很细致,在临床期间会完成工艺优化、表征、验证,已使工艺、分析方法等更加稳健。另每家公司的具体操作细节和对法规的理解不同,实施方案会略有差异。同时本文只是概述,希望各位能对最初的流程图有了一个更详尽的认识。
下篇将继续介绍IND申请时另一个重要的内容,非临床研究,敬请期待。
如有需要本文PPT,可关注“生物药大时代”公众号,编辑发送“抗体药IND阶段CMC研究”,即可获得,仅供参考。
相关阅读:《洪观杰析|最新系统总结—靶向Treg的癌症治疗策略》
洪观杰析专栏简介
专栏主理人:程洪杰——CPU随风而逝
中国药科大学本硕连读,在抗体行业拥有十余年经验,在新药发现、成药性分析、蛋白纯化、制剂开发、分析方法开发和质量控制均有丰富经验。参与过Etanercept、infliximab、dulaglutide等多个生物类似药以及多种单抗、双抗、融合蛋白新药的CMC研究,并成功将多个产品推向临床。
<END>




















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论