
目前肿瘤免疫治疗如火如荼,以PD-1/PD-L1为代表的免疫抑制剂主要作用是解除免疫抑制,激活免疫系统区杀伤肿瘤。而在机体内,也有其他的免疫细胞发挥免疫抑制作用,最具代表的是调节性T细胞(Treg)、肿瘤相关巨噬细胞TAM。这两个也是目前研究较热门的靶点。
2022年7月16号在Trendsin Cancer 刊登了一篇Therapeutictargeting of regulatory T cells incancer,系统阐述了目前靶向调节性T细胞的癌症治疗策略,对于入门者和资深研究者均有较好的价值。
01 T细胞分类
介绍正文前,先介绍下T细胞的分类:如图1所示
- 根据成熟时间,可分为初始T细胞(Na图片ve T)、效应T细胞(Effector T)、记忆T细胞(Memory T) ;
- 根据TCR(T细胞(抗原)受体),可进一步分为αβ T细胞和γδ T细胞;
- 根据T细胞表面特征蛋白,又可进一步CD4+、CD8+、CD8αα等。CD8+中主要为细胞毒性T细胞(cytotoxic T cell),简称Tc细胞,也有少量CD8+Treg细胞;CD4+细胞中主要可细分为辅助性T细胞(Thelp)和Tre。Treg可主要分为两类,Natural Treg(nTreg),胸腺产生,通过接触或非接触机制,介导免疫抑制和耐受性反应),Inducible Treg(iTreg),由Na图片ve T诱导产生,通过接触或非接触机制,介导免疫抑制和耐受性反应)
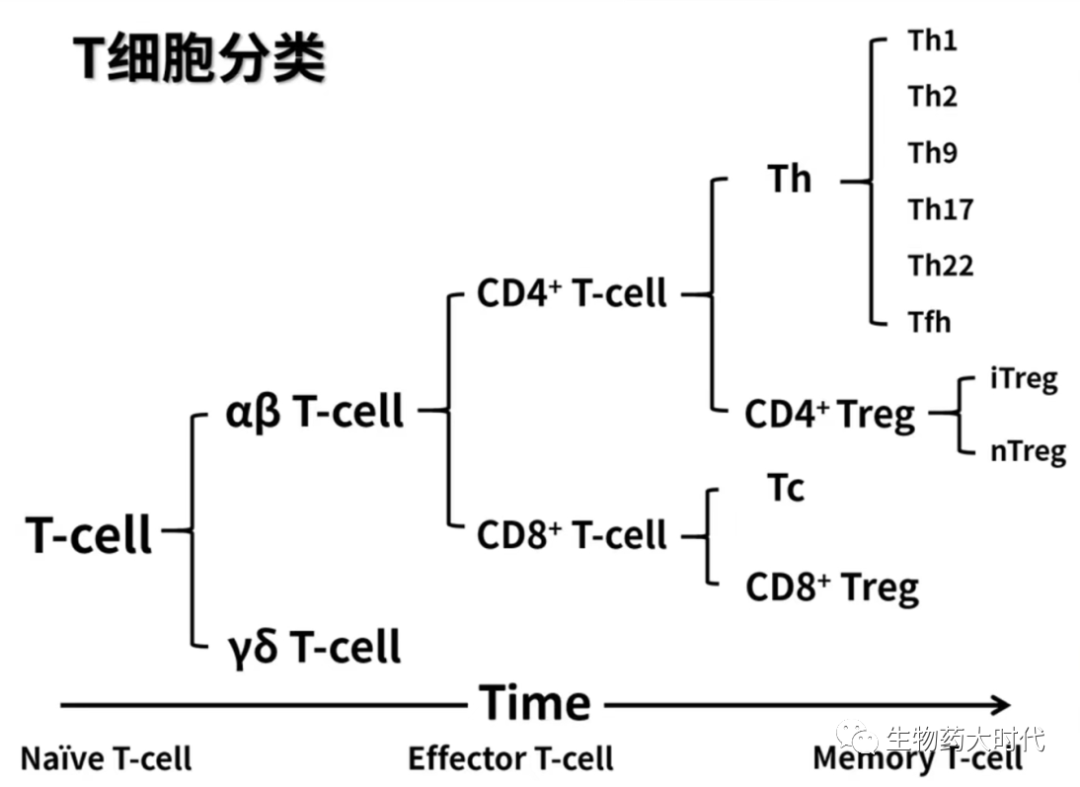
图1 来源于《人卫版免疫学》—学免疫的姚小姚
02 调节性T细胞的作用
在肿瘤微环境(TME)中,Treg是主要的治疗靶点。他们是一小群(5–15%)具有强大抑制活性的CD4+T细胞。虽然Treg可以限制炎症并维持免疫稳态,但也可以促进外周对肿瘤的耐受。
Treg抑制活性取决于转录因子叉头盒蛋白3(FOXP3),但也与其他受体表达相关,如TNFR2、IL7R、CD45A、CD25等。缺乏FOXP3表达的个体会出现免疫失调、多内分泌疾病、肠病和X连锁(IPEX)综合征(这是一种严重的自身免疫性淋巴增生性疾病,在没有骨髓移植的情况下是致命的),因而开发激活Treg的作用的药物,可用于治疗自身免疫病。
尽管Treg在维持外周耐受和预防自身免疫方面很重要,但它们也抑制TME内的抗肿瘤免疫。这种免疫抑制作用主要通过图2展示的四个层面发挥:
1.接触依赖性机制包括包括通过穿孔素和颗粒酶A\B直接溶解和破坏树突状细胞(DC)的,通过膜间隙连接转移环AMP发挥免疫抑制作用。
2.非接触性抑制机制包括分泌IL10、IL35和TGFβ等免疫抑制因子、表达的CD39将细胞外ATP转化为腺苷等抑制效应T细胞;剥夺IL2 阻止其激活其他免疫细胞;以及表达CLTA-4、LAG3、TIM3等免疫检查点抑制APC等免疫细胞作用
3.肿瘤细胞可以通过趋化因子(如CXCL12、CCL17、CCL22和CCL1)将外周Treg募集到TME进一步抑制免疫反应。
4.代谢重编程修饰Treg有利于TME而不是效应T细胞,TME中Treg的激活和扩增可由多种机制支持:
(1)肿瘤细胞释放的IL2、吲哚胺2,3-双加氧酶(IDO)和TGFβ;
(2)肿瘤内Treg中可激活替代代谢途径如乳酸消耗途径(常规效应T细胞依赖糖酵解)
(3)肿瘤坏死因子(TNF)家族基因OX40、GITR和TNFR2以及共刺激受体ICOS可在肿瘤内Treg中上调;
(4)神经纤毛蛋白-1(NRP1)可被激活以维持其抑制功能。
在这文,简要概述了TME中的Treg生物学,目前临床上专门针对Treg的方法,以及对未来问题和挑战的展望。
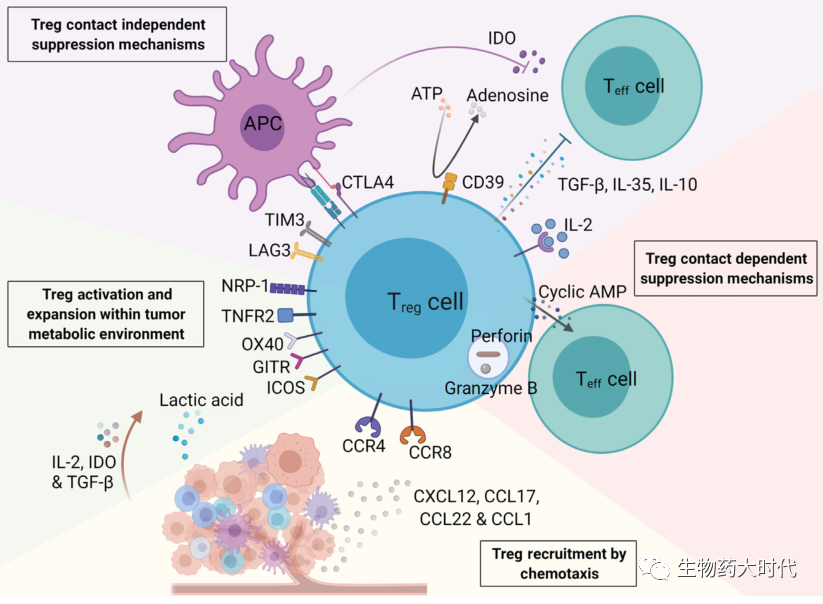
图2肿瘤微环境(TME)中调节性T细胞(Treg)的激活和扩增
03 实体瘤中Treg的募集和功能
- 不良预后相关:肿瘤内Treg数量的增加与许多癌症的预后不良相关,包括乳腺癌、肺癌、卵巢癌和肝细胞癌的预后不良。
- 良好预后相关:肿瘤内Treg与微卫星不稳定性高(MSI-H)结直肠癌(CRC)、雌激素受体阴性乳腺癌、食管鳞状细胞癌和卵巢癌转移部位的良好预后相关。
肿瘤浸润的Treg与临床结果之间的差异相关性可以用三种现象来解释。(图3)。
第一、人类Treg在肿瘤中具有表型和功能异质性。经历激活的CD4+T效应细胞可以暂时表达FOXP3和CD25(IL2受体α链),而无抑制功能,因此不是传统的Treg。此外,免疫组织化学的应用通常通过CD25和FOXP3或单独的FOXP3检测肿瘤内Treg的存在,这比基于流式细胞术的研究定量少,可能需要额外的标记物来识别功能性Treg。例如,CD127(IL7Rα)的低表达被广泛用于鉴定有功能活性Treg。此外,CD45RA表达标志着具有明显抑制能力的Treg亚群,其与结直肠癌患者的生存率呈负相关。此外,TNFR2(TNFRSF1B)优先在小鼠淋巴组织Treg和人类胸腺Treg上表达,是小鼠肿瘤模型和人类癌症中抑制型Treg的标志。因此,不同亚群Treg的存在及其在不同研究中的差异检测可以解释报告结果的差异
第二、将Treg与良好预后联系起来的发现往往是在慢性炎症的环境中发现的。慢性间质炎症促进的大肠癌就是这种情况,在这种情况下存在抑制慢性炎症的Treg是有益的[38]。与激素受体阳性乳腺癌相比,预后良好相关的肿瘤内Treg也与三阴性乳腺癌相关的慢性炎症相一致;相比于食管腺癌或原发卵巢癌食管,鳞状细胞癌(吸烟诱导)与转移型卵巢癌也出现一致现象,Treg与慢性炎症有相关。因此,特定的炎症状态可能对局部肿瘤中Treg的功能产生严重和可变的影响
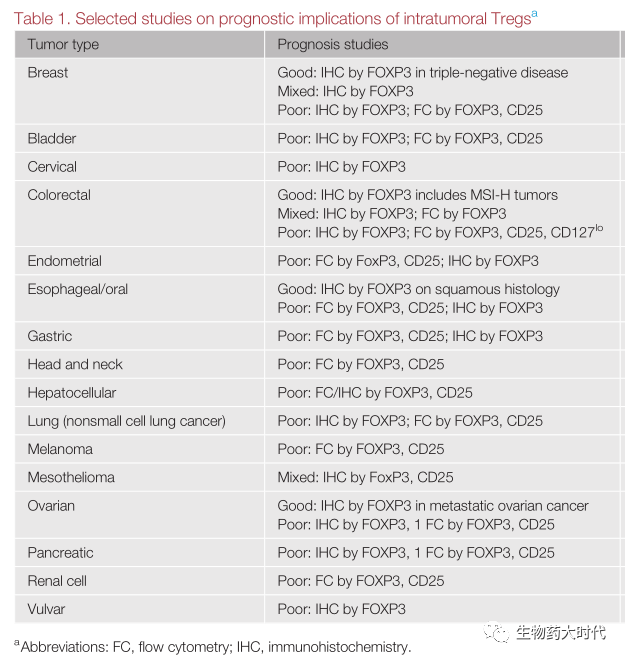
图3Treg的表达与不同癌种预后的关联性(poor表示不良预后,Good表示良好预后)。
第三、针对肿瘤浸润淋巴细胞的癌症治疗可以影响抗肿瘤T细胞和Treg。虽然FOXP3或CD8单独表达不能显示与晚期HER2阳性乳腺癌患者的生存结果显著相关,但高CD8:Treg比率与显著延长的生存结果相关。肿瘤浸润CD8:Treg比率广泛用于预测癌症患者的预后和癌症治疗的治疗反应。因此,不能仅根据绝对细胞数预测癌症患者的预后。
04 靶向Treg在癌症中的治疗意义
通过Treg抑制抗肿瘤免疫反应是肿瘤发展和进展的核心。致力于发现针对Treg的新疗法的重点是恢复抗肿瘤免疫,同时保持外周耐受性。如图4所示,有七个方向针对癌症中Treg的方法:

图4靶向Treg的抗肿瘤治疗
- 1.去除肿瘤内Treg
- 采用如酪氨酸激酶抑制剂TKI可选择性影响Treg的数量、维持和功能,如舒尼替尼通过去除Treg和减少Treg产生的TGFβ和IL10抑制肿瘤生长。
- 使用低剂量环磷酰胺(CTX)的“节律化疗”可消耗Treg。
- Treg表达高水平的IL2受体CD25,但仅产生少量IL2,局部IL2缺失,影响效应T细胞功能,靶向CD25通过ADCC等作用清除Treg。
- 2.阻止Treg迁移到肿瘤中
Treg通过趋化因子和趋化因子受体相互作用的迁移至TME,如CCL22和受体CCR4、CCL1和受体CCR8。
- 通过中和抗体封闭分泌型CCL1或CCL22,如体外数据显示CCL22的中和抗体可显著阻断腹水诱导的Treg迁移。
- 结合CCR4或CCR8,如Mogamulizumab是一种岩藻糖去除的抗CCR4单抗,靶向表达高水平CCR4的恶性T细胞,通过ADCC效应清除Treg。
- 3.使肿瘤内Treg对免疫检查点阻断剂敏感
- 抑制型受体(TIGIT、LAG3、CTLA-4、PD-1)均在Treg表达,检查点阻断对Treg的影响有助于阐明检查点抑制剂在癌症患者中的无反应性和毒性机制。如TIGIT+Treg具有高度抑制活性,在TIGIT介导的CD8+T细胞抑制中起主要作用,可通过TIGIT/PD1的联合阻断来对抗,但不能仅通过PD1阻断,强调了通过靶向TIGIT调节肿瘤内Treg的潜力。
- 化疗、放疗、靶向疫苗等会对抑制性受体致敏,如化疗药物—奥沙利铂、卡铂、顺铂、阿霉素和环磷酰胺,在肺癌小鼠模型中用作检查点阻断疗法时,显示出对肿瘤内Treg和CD8+T细胞的不同敏感性。
- 4.靶向肿瘤内Treg上的共刺激信号
- 肿瘤坏死因子受体家族相关蛋白(GITR)激活可促进效应T细胞功能,而抑制调节性T细胞(Treg)的功能。一项小鼠研究表明,GITR激动剂DTA-1可使肿瘤内Treg减少50%以上,对外周Treg的影响最小。
- OX40(CD134, TNFRSF4)与配体结合后增加效应T细胞和记忆T细胞的存活和扩增,增加细胞因子(例如IL-2、IL-4、IL-5、IFN-γ)的分泌;同时降低Tregs的免疫抑制活性。OX40激动剂(OX86)在B16小鼠黑色素瘤模型中诱导TME中的Treg深度耗竭和效应CD8+T细胞的流入。
- 诱导T细胞共刺激分子(ICOS)作为CD28/CTLA-4家族的第三个成员,介导信号传导来调节T细胞的活化和效应T细胞的功能,同时在维持效应T细胞和Treg稳态中发挥作用。ICOS呈现的双重作用导致其可进一步开发呈激动剂或拮抗剂。ICOS拮抗mAb MEDI-570已在复发或难治性外周T细胞淋巴瘤滤泡变异或血管免疫母细胞性T细胞淋巴瘤患者的1期试验中进行了评估(图4)。治疗耐受性良好,循环ICOS+CD4+T细胞减少。JTX-2011(vopratelimab)是一种ICOS激动剂,可在不影响外周Treg频率的情况下降低小鼠模型中肿瘤内Treg的频率。
- TNFR2(TNFRSF1B)在肿瘤微环境的Tregs中高表达,尤其在人FOXP3+Treg上表达,其与TNF-α结合后,通过激活典型和非典型的 NF-kB 通路来控制细胞的生存和增殖。表达TNFR2的Treg在人类癌症中表现出更强的抑制表型。大量体外数据显示TNFR2拮抗剂可清除TNFR2+Treg和肿瘤相关髓系细胞(MSDC),抑制Treg功能,起到较好的抗肿瘤效果,目前成为潜力靶点。
- 5、靶向Treg细胞因子分泌
Treg是抑制性细胞因子的关键来源,如TGF-β、IL35和IL10,它们是Treg免疫抑制的重要非接触性机制。
- TGF-β通过多个维度同时作用于肿瘤微环境中的肿瘤细胞和免疫细胞而促进肿瘤细胞的侵袭和转移。如图5所示,TGF-β的释放主要有三种机制:(1)LAP结构域的胞外蛋白酶裂解;(2)潜伏复合物通过LTBP1与ECM结合,并在细胞收缩时通过整合素αβ传递张力时释放活性TGF-β;(3)潜伏复合物与细胞表面GARP结合,整合素αβ与GARP复合物相互作用,导致活性的TGF-β释放。
因而目前可通过三个维度抑制TGF-β,(1)直接结合成熟的TGF-β,最知名的为M7824,可以同时与PD-L1及TGFβ1,2,3的三个亚型特异性的结合,在1/2期临床中展现出优于PD-L1单用;(2)作用于GARP,DS1055a是一种无糖基化的抗GARP抗体,可有效消耗肿瘤中的Treg,随后激活效应T细胞,从而在人源化小鼠模型中清除肿瘤。(3)作用于整合素αVβ8,在各种人类癌症中所有表达ITGβ8的肿瘤浸润性T细胞中,65–70%是FOXP3+T细胞,肿瘤浸润性T细胞中ITGβ8a的表达与低存活率相关。在小鼠模型中,阻断整合素αVβ8可以抑制小鼠活动性炎症过程中致病性t细胞的表达。
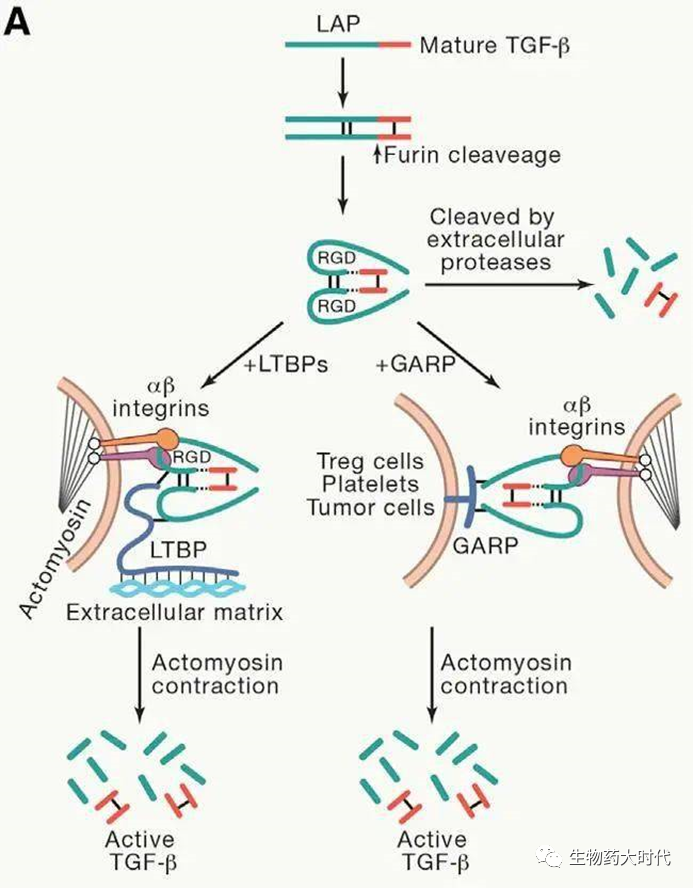
图5TGF-β释放机制示意图
- IL-10是一种多功能的免疫抑制细胞因子,具有免疫调节和血管生成功能。IL-10通过维持FOXP3和TGFβ的表达,有助于Treg的稳定性和表型。IL10现在不仅被认为是最有效的抗炎细胞因子,还因为其能够实现癌症免疫监测和肿瘤排斥。但也有一些报道 IL-10可增加了组织中CD8 T细胞浸润,诱导了IFN-γ的产生,并促进了有效的T细胞记忆反应,目前还未有药物上市,作为一个还需进一步研究的免疫治疗靶点。
- IL-35主要由Treg分泌,由p35和EBi3亚单位组成,是Treg 发挥免疫负调控的主要细胞因子之一。,IL-35可以参与TME中恶性肿瘤细胞与周围免疫细胞之间的相互作用,诱导免疫抑制环境并限制有效抗肿瘤免疫反应的参与。小鼠肿瘤模型显示,IL35拮抗剂或限制性清除IL35的治疗可导致肿瘤生长降低
- 6.改变Treg脆弱性
- 在小鼠模型中研究了磷脂酰肌醇-3-激酶(PI3K)途径在调节Treg维持和稳定性中的重要性,该途径介导TCR下游的信号传导。PI3Kδ亚型的抑制显著降低了Treg中Akt的磷酸化,但对效应CD4+T细胞没有影响,这在突变小鼠中得到了进一步证实具有PI3Kδ非活性激酶。CD4+T细胞中存在PI3Kα和PI3Kβ替代途径使PI3Kδ在冗余,但在Treg中不冗余(即Treg必须依赖PI3Kδ),使TME中的PI3Kδ抑制剂能够选择性去除Treg,并随后抑制小鼠肿瘤模型中的肿瘤生长。此外,Treg中PI3K p110δ的失活释放了CD8+T细胞的抗肿瘤活性,并导致在多个小鼠模型中抑制肿瘤生长和转移
- 神经纤毛蛋白-1(NRP1)-信号素-4A(SEMA4A)轴稳定肿瘤内Treg并帮助维持其抑制功能(图2)。Treg上的NRP1表达也可以通过VEGF结合NRP1促进DC相互作用并促进肿瘤内迁移。与健康组织相比,NRP1+Treg在多种人类癌症中富集。肿瘤内NRP1+Treg的浸润与头颈部鳞状细胞癌的不良预后相关。重要的是,NRP1的缺失不会导致FOXP3表达或Treg特性的不稳定或丧失,而是导致功能丧失,这种表型称为“Treg脆性”。在临床前小鼠模型中,诱导Treg脆性导致肿瘤清除,同时仍保持外周耐受性。进一步分析已确定IFNγ是Treg脆性的主要驱动因素。NRP1拮抗剂Fc(AAG)-TPP11选择性抑制肿瘤内NRP1+Treg功能和稳定性,并增强TME中的抗肿瘤活性
- 7、靶向Treg代谢
肿瘤内Treg具有不同的代谢程序,并通过乳酸摄取维持其抑制功能,而效应T细胞依赖糖酵解,并在TME中与肿瘤细胞竞争。
- 体外研究的数据表明,二甲双胍治疗导致mTORC1激活和Treg代谢重编程,从而导致抑制功能降低并诱导Treg凋亡。二甲双胍的给药证明了小鼠模型中Treg频率的降低,但在外周淋巴组织中没有,这意味着二甲双胺可以靶向TME中的Treg代谢
- TME内的吲哚胺2,3二氧合酶(IDO)和腺苷治疗可促进Treg增殖和抑制。二甲双胍、IDO抑制剂和A2AR抑制剂已在针对多种癌症类型的临床试验中进行了测试,并支持这些Treg代谢抑制剂在不改变效应T细胞功能的情况下的新治疗潜力
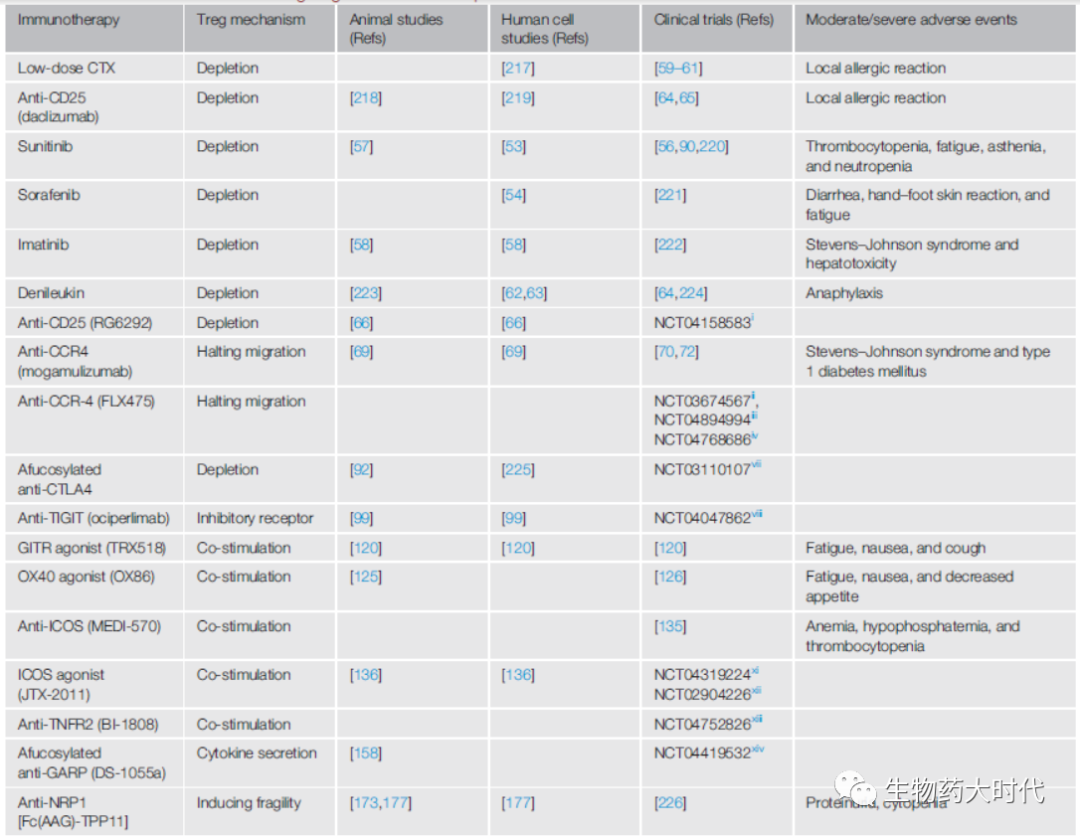
图6靶向Treg药物举例
05 结论和未来展望
Treg是免疫稳态、组织修复、自身免疫疾病和癌症的关键调节因子。一些Treg靶向治疗正在单独或与其他方式联合进行临床研究,如免疫检查点阻断、靶向疫苗治疗、放疗和化疗(图4)。Treg靶向治疗的最新进展突出了以Treg生物学和TME内抑制功能为中心的未来研究对于开发有效癌症治疗的重要性。
- 潜在靶点包括IL35,它是肿瘤模型中重要的Treg抑制机制。
- 此外,TIGIT标志着Treg亚群对Th1、Th17和CD8+T细胞功能具有高度抑制作用。
- 临床前研究发现,与TME中的效应T细胞相比,Treg具有独特的代谢程序。虽然肿瘤内的低糖、缺氧和酸性环境阻碍了效应T细胞的功能,但肿瘤内Treg通过激活乳酸摄取的替代代谢途径维持其抑制功能,这为开发新的Treg靶向干预提供了机会。
- 多个数据表明,在肿瘤模型中,Treg表达CD39以将细胞外ATP转化为腺苷并抑制效应T细胞;然而,进一步的研究,包括人体研究,是值得的,并将提供额外的治疗组合,以提高对癌症的治疗效果。
综上所述,虽然在临床上靶向Treg取得了一些成功,但我们在TME背景下对Treg生物学的理解仍存在许多差距。人类Treg在TME内具有表型和功能上的异质性,这表明可能存在控制TME内Treg维持、代谢和抑制功能的其他机制。免疫系统中的分子信号涉及极其复杂的网络。然而,结合新计算工具的多组学方法可能有助于理解调节Treg功能的基因调控网络,以及识别定义TME内功能抑制Treg亚群的其他Treg生物标记。这些分析可能导致针对对肿瘤逃逸和肿瘤进展至关重要的Treg亚群的新疗法,而不影响各种癌症类型的免疫稳态。
——Shan, Feng et al. “Therapeutic targeting of regulatory Tcells in cancer.” Trends in cancer,S2405-8033(22)00136-4. 16 Jul. 2022
关注生物药大时代公众号,发送“靶向Treg”可获得原文
洪观杰析专栏简介
专栏主理人:程洪杰——CPU随风而逝
中国药科大学本硕连读,在抗体行业拥有十余年经验,在新药发现、成药性分析、蛋白纯化、制剂开发、分析方法开发和质量控制均有丰富经验。参与过Etanercept、infliximab、dulaglutide等多个生物类似药以及多种单抗、双抗、融合蛋白新药的CMC研究,并成功将多个产品推向临床。
END





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论