
近期,外媒Fierce Pharma发布了2023年美国最昂贵药物排名TOP10,其中基因疗法占据半壁江山,最贵的为首款B型血友病基因疗法——UniQure公司的Hemgenix,定价 350 万美元,位居榜首。
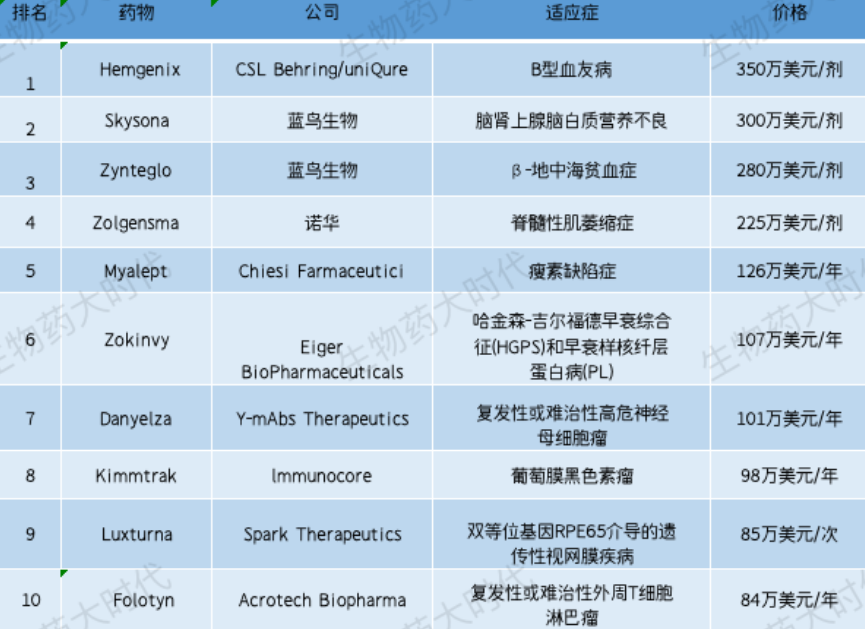
1. Hemgenix
公司:CSL Behring,uniQure
疾病:血友病B
每剂费用:350万美元

Hemgenix是一种基于腺相关病毒载体的基因疗法,通过一次性静脉输注递送B型血友病所缺乏的凝血因子IX,限制出血发作。
Hemgenix基本信息
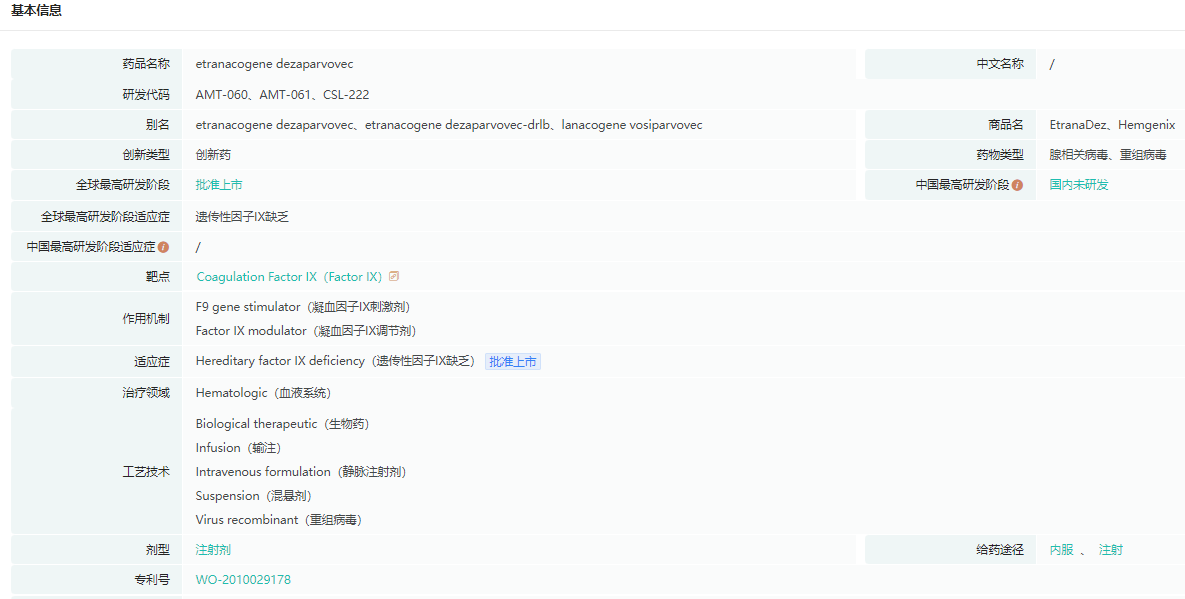
数据来源:药融云全球药物研发数据库
2022年11月获FDA批准上市,是FDA批准的首款B型血友病基因疗法,售价一剂350万美元,为全球最贵药物。
2. Skysona
公司:Bluebird bio蓝鸟生物
疾病:脑肾上腺脑白质营养不良
每剂费用:300万美元

Skysona是一种一次性基因疗法,利用Lenti-D慢病毒载体(LVV)进行体外转导,将ABCD1基因的功能拷贝添加到患者自身的造血干细胞(HSC)中,功能性ABCD1基因的加入能使患者体内产生ALD蛋白,这被认为有助于VLCFA的分解。SKYSONA治疗的目的是稳定CALD的进展,从而尽可能地保留神经功能,包括保留运动功能和沟通能力。
研发进度
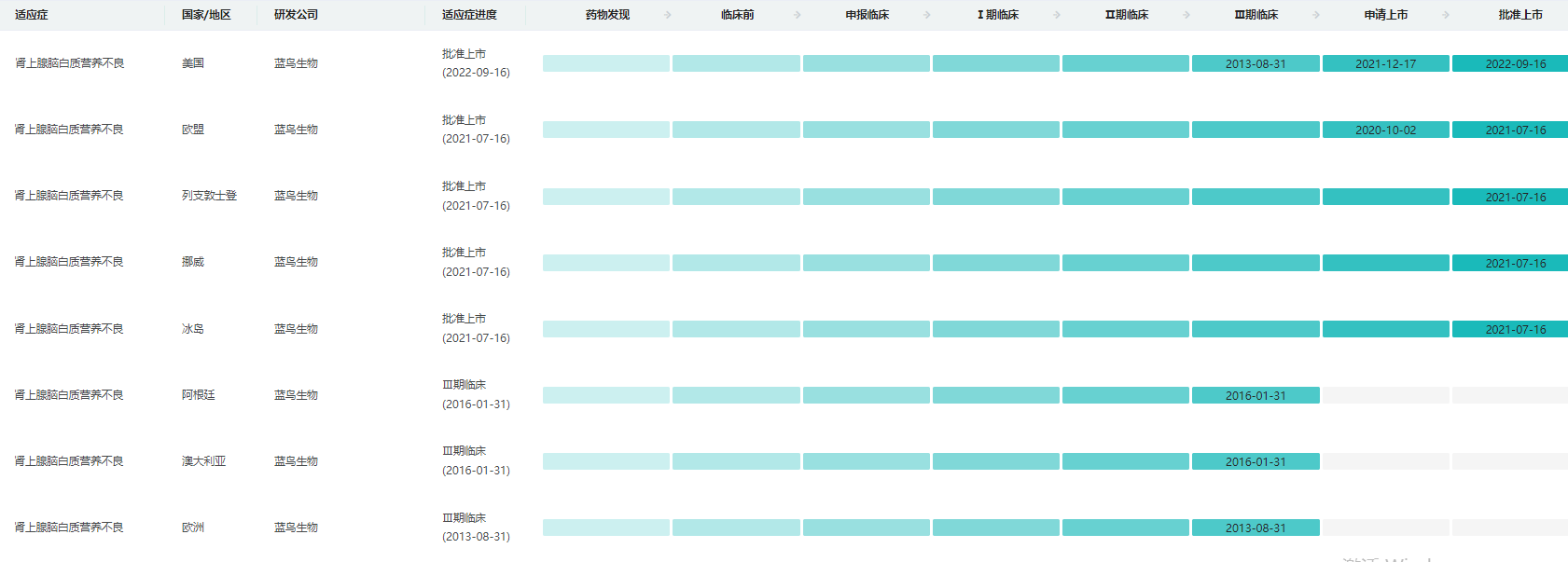
数据来源:药融云全球药物研发数据库
去年9月该疗法获批用于减缓4-17岁患有早期活动性脑肾上腺脑发育不良(CALD)的男性患者的疾病进展。
3. Zynteglo
公司:Bluebird bio蓝鸟生物
疾病:输血依赖性地中海贫血
每剂费用:280万美元

Zynteglo是一种一次性基因治疗产品,通过慢病毒载体将表达正常血红蛋白β亚基的基因(βA-T87Q-珠蛋白基因)在体外植入到从患者体内取出的造血干细胞中,再将这些细胞回输入患者体内,这些造血干细胞在输注回患者体内后,会源源不断地生成具有正常功能的血红细胞,极大减少患者对输血的需求。
Zynteglo基本信息
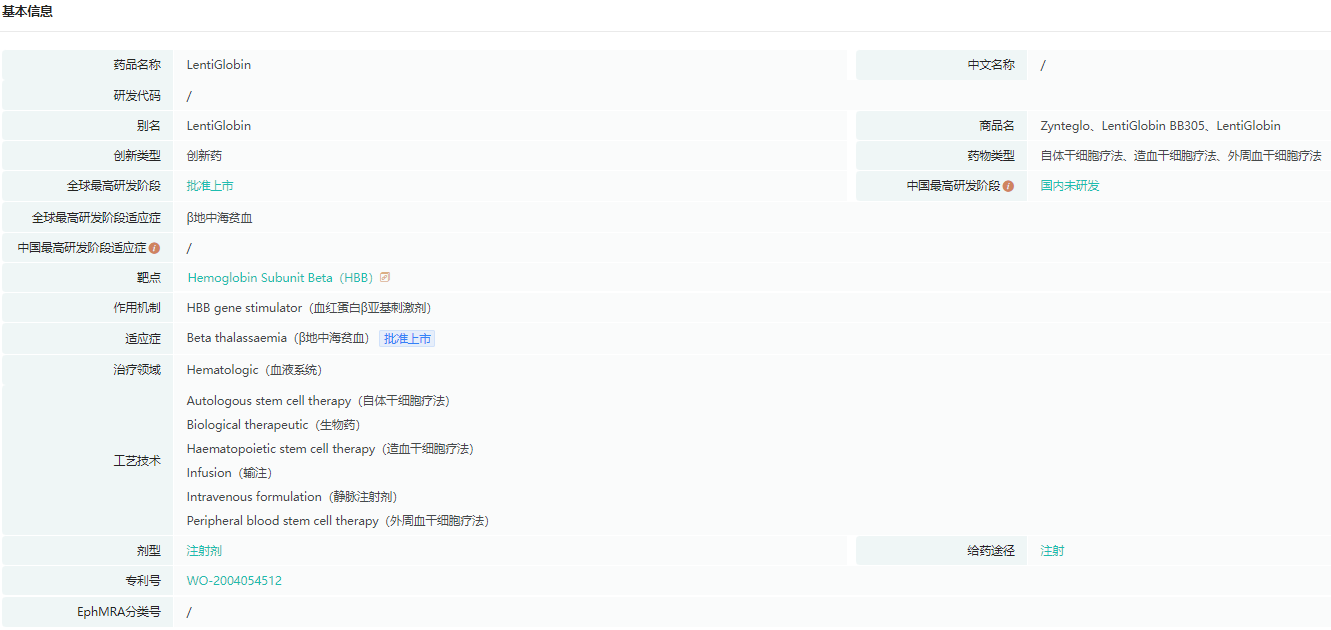
数据来源:药融云全球药物研发数据库
去年8月,该疗法获批上市,用于治疗需要接受常规血红细胞输注的β地中海贫血患者。Zynteglo承诺,如果没有达到治疗效果,将退还80%的治疗费用。
4. Zolgensma
公司:诺华
疾病:脊髓性肌萎缩
每剂费用:225万美元

Zolgensma是一种一次性AAV基因疗法,治疗脊髓性肌肉萎缩症,于2019年在美国获批。目前诺华已经为Zolgensma争取了有利的保险政策,覆盖了约97%的商业保险患者和86%的医疗补助患者。
2022年Zolgensma营收13.7亿美元,其在美国市场销售额为4.34亿美元,同比降低7%;在全球其他区域销售额为9.36亿美元。
5. Myalept
公司:Chiesi Farmaceutici
疾病:瘦素缺乏
每年费用:126万美元

Myalept是一款重组人瘦素蛋白类似物,在患有全身性脂肪代谢障碍的患者中,脂肪组织的损失导致瘦素缺乏进而加剧了代谢异常,皮下注射的myalept通过结合并激活瘦蛋白受体(Leptin Receptor),进而提高患者的胰岛素敏感性以及降低食物的摄入量。
该药首次于2013年在日本上市,2014在美国上市。该药是唯一被批准用于治疗瘦素缺陷症的药物,2021年销售额为1.41亿美元。
6. Zokinvy
公司:Eiger BioPharmaceuticals
疾病:早衰综合征和早衰样核纤层蛋白病
每年费用:107万美元

Zokinvy是一种口服法尼基转移酶抑制剂,通过抑制早衰蛋白的异戊二烯化,进而降低早衰蛋白在细胞核中的积累。
Zokinvy于2020年获得美国FDA批准上市,是美国第一个用于治疗早衰的药物。
7. Danyelza
公司:Y-mAbs Therapeutics
疾病:复发性或难治性高危神经母细胞瘤
每年费用:101万美元

Danyelza是一款GD2单抗,通过靶向高表达于神经母细胞瘤的 GD2 起效。结合 GD2 后,Danyelza可引起抗体介导的细胞毒性反应(ADCC)并激活补体系统,从而杀伤肿瘤。
2020年该药在美国获批用于复发或难治的高危神经母细胞瘤,2022年11月在国内获批。Y-mAbs财报显示,该药物在2022年营收4930万美元,与2021年相比增长50%,预计2023年该产品的收入在6000万至6500万美元之间。
8. Kimmtrak
公司:Immunocore
疾病:葡萄膜黑色素瘤
每年费用:97.55万美元

Kimmtrak是一款融合T细胞受体和抗CD3免疫效应结构域的双特异性融合蛋白疗法,以TCR技术为基础,通过靶向黑色素细胞和恶性黑色素瘤表达的gp100为目标,实现对癌细胞的靶向性杀伤。
2022年1月,Kimmtrak获FDA批准用于治疗HLA-A*02:01基因型、转移性或不可切除的葡萄膜黑色素瘤,这是FDA批准的首款治疗不可切除或转移性葡萄膜黑色素瘤的疗法,也是首款获得监管批准的TCR细胞疗法。2022年,Kimmtrak销售额为1.17亿英镑(约合1.44亿美元)。
9. Luxturna
公司:Spark Therapeutics
疾病:双等位基因RPE65介导的遗传性视网膜疾病
每次费用:85万美元

Luxturna是一款基于AAV的基因疗法,给药方式是视网膜下注射。该法以AAV2作为载体,将正常RPE65基因的功能性拷贝导入患者视网膜细胞,使相应细胞细胞表达正常的RPE65蛋白,从而改善患者视力。
该疗法于2017年美国获批用于用于治疗RPE65基因突变导致的遗传性视网膜疾病。Luxturna的单价为42.5万美元,双眼治疗费用为85万美元。根据Spark财报显示,截止2019年9月Luxturna共取得5500万美元净销售额。2019年10月罗氏宣布收购Spark,此后Luxturna的销售情况未能继续体现在罗氏财报中。
10. Folotyn
公司:Acrotech Biopharma
疾病:复发性或难治性外周T细胞淋巴瘤
每年费用:84.26万美元

Folotyn是一款叶酸代谢小分子抑制剂,于2009年9月获得美国FDA批准上市,后陆续在许多国家上市,是首个用于治疗复发性或难治性外周T细胞淋巴瘤(PTCL)的二氢叶酸还原酶抑制剂。
总结
从整体看,价格TOP 10主要以基因疗法和治疗罕见病的孤儿药为主。基因疗法的价格高不仅是因为该疗法研发制备成本高昂,同时也因为其具有一次性治愈的潜力。罕见病药物定价高是因为罕见病患者少、市场小,开发成本高,企业要想获得与常用药物相同的收益,就势必要提高单价。
参考资料:
1.www.fiercepharma.com/special-reports/priciest-drugs-2023
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论