自2021年《药品上市后变更管理办法》正式实施以来,药品上市许可持有人(MAH)制度全面落地,药品批文转让成为医药资源配置的重要方式。无论是企业并购、资产重组还是单纯的批文交易,准确、及时地查询药品批文转让申请记录,对于交易双方、投资者及行业从业者都至关重要。本文系统梳理当前主流的查询渠道与操作方法,为相关方提供实用指南。
在MAH制度下,药品批文转让实质是药品上市许可持有人的变更,可分为两种情况:
①持有人名称或注册地址变更:不涉及所有权转移的简单信息变更。
②持有人主体变更:完整的所有权转移,需提交转让协议等法律文件。
所有变更均需向国家药品监督管理局(NMPA)或其授权机构提出补充申请,经审批后方可生效。值得注意的是受让方企业通常需先取得《药品生产许可证》(B证),才能作为持有人承接批文。
由于NMPA官网不提供药品转让记录的直接查询,所以查询批文的时候需要技巧,也分为两种情况:
①单个药品的批文转让信息查询,只需要通过NMPA或CDE官网,查询其药品注册信息、审评进度及持有人变更记录等信息来综合判断。
②多个药品的批文转让信息查询,只需通过摩熵医药的中国药品审评数据库或中国药品批文数据库直接筛选查询,相对更高效。
详细查询方法如下:
方法一、官方渠道查询方法
1. CDE官网:查询审评进度与结果
通过国家药审中心(CDE)官网可查询持有人变更补充申请的受理与审批状态。
路径:CDE官网 → 信息公开 → 药品注册相关查询 → 补充申请/备案/变更
操作:使用“药品名称/批准文号 + 持有人名称”等组合查询,关注“承办日期”、“当前状态”等信息。
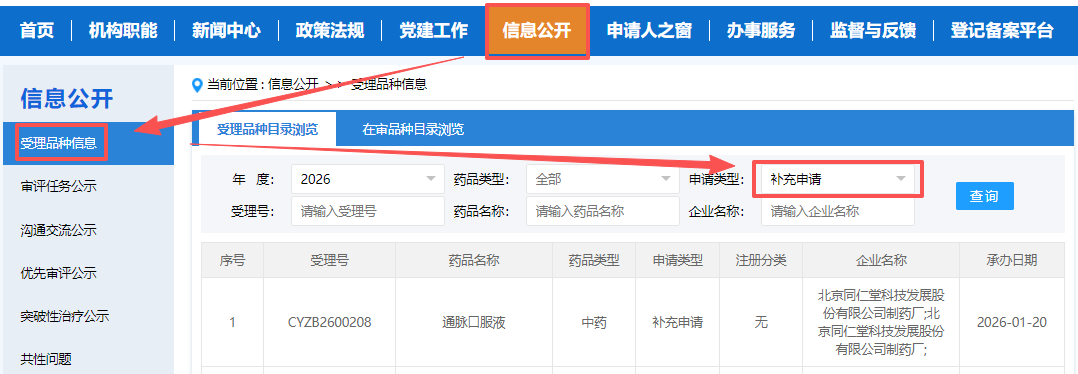
2. NMPA官网:查询批文基本信息
通过国家药监局官网可确认当前批文的持有人与生产企业,是判断转让是否完成的基础。
路径:NMPA官网 → 药品 → 药品查询 → 境内生产药品/境外生产药品
操作:输入药品名称、批准文号等,核对“上市许可持有人”与“生产企业”信息。
方法二、摩熵医药数据库查询(深度分析可选)
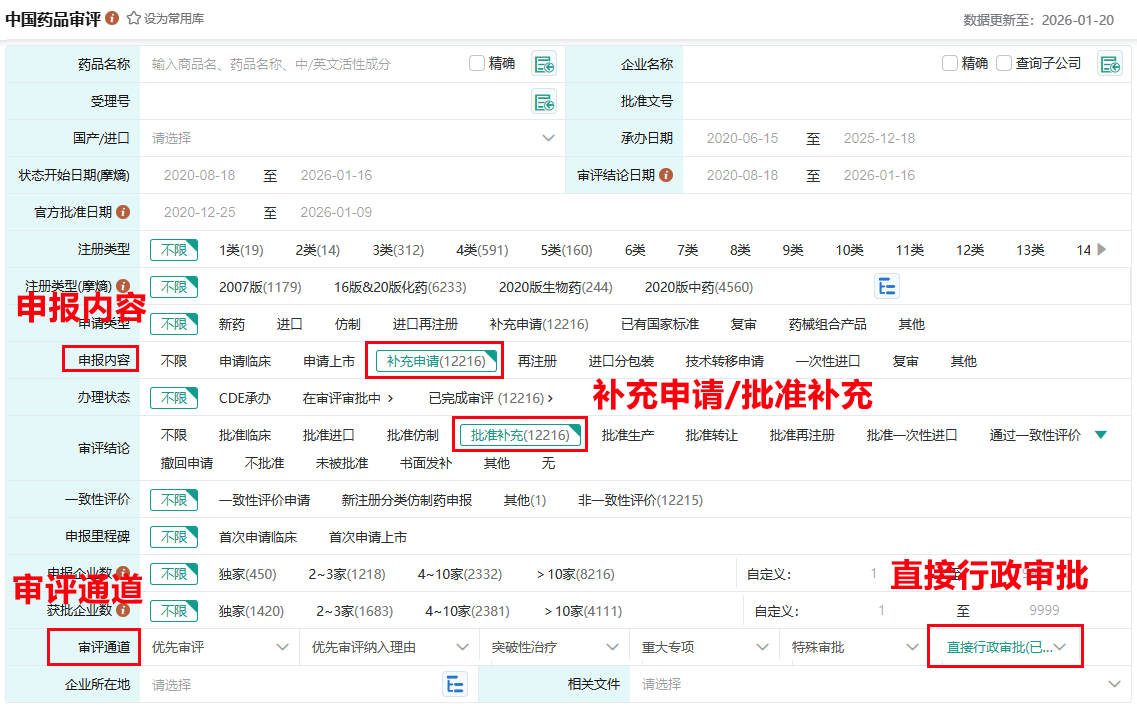
1.中国药品审批数据库(批文转让申请查询-多维度批量筛选)
路径:摩熵医药官网 → 数据库 → 中国药品批文数据库
操作:在筛选条件中选择“审评通道→直接行政审批”&“申报内容→补充申请”检索后,再剔除筛选结果中的单个CDE企业名称数据,这样得到的绝大部分数据都为批文转让申请信息了(已转让批文同理,选择“批准补充”即可),最后再通过中国药品批文数据库核验其批准文号研发历程详情即可得到完全正确的批文转让信息。
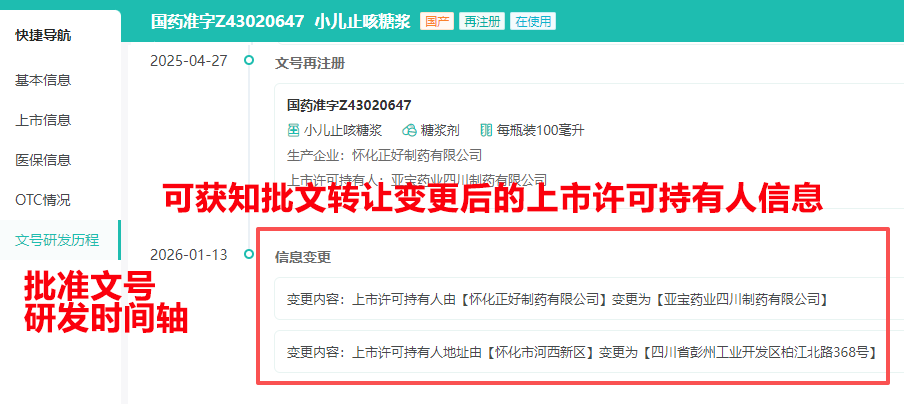
2. 中国药品批文数据库(批文转让结果详情查询-单条文号演变时间轴)
路径:摩熵医药官网 → 数据库 → 中国药品审批数据库
操作:输入药品名称/批准文号/上市许可持有人/生产企业公司名称 → 多维度条件筛选 → 快速了解品种批文现状(包含可获知批文转让后的上市许可持有人),并分析企业批文布局。详情可通过历史文章查看【中国药品批文查询指南】
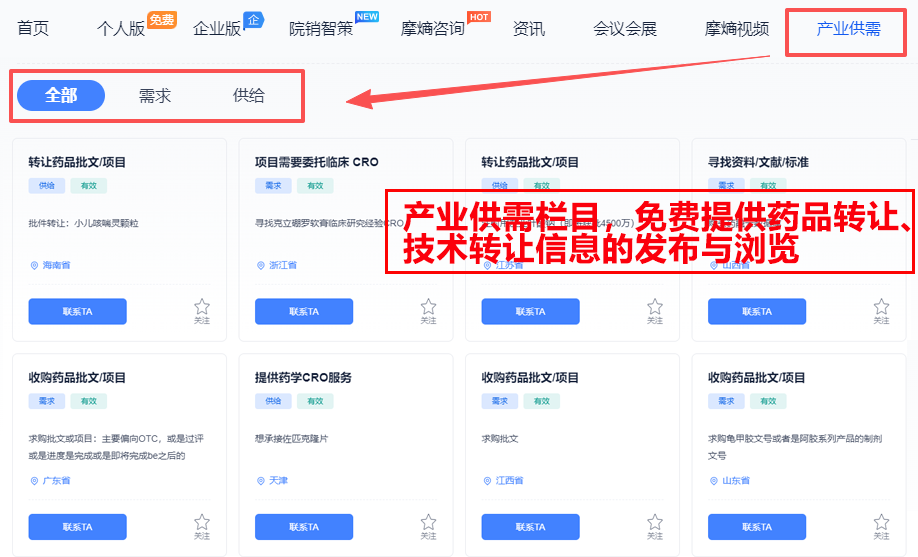
注意:摩熵医药的产业供需栏目,免费提供药品转让、技术转让信息的发布与浏览,对了解市场比较友好。
方法三、其它查询方法
1. 省级药监局官网:查询地方受理情况
部分省份药监局官网会公示或提供持有人变更的受理、审评结果等信息,可补充查询。
路径:搜索“XX省药品监督管理局 药品上市后变更 公示/公告”
操作:在公示列表中查找相关记录。
2. 政府信息公开申请:获取完整变更档案
如需获取历次变更的完整审批结论,可依法向药监部门提交政府信息公开申请。
途径:向NMPA或省级药监局提交书面申请,说明所需信息(如某品种历次持有人变更审批结论)。
注意:涉及商业秘密或个人隐私的信息可能不予公开。
药品批文转让申请记录的查询是一项需要多维度、多渠道配合的专业工作。使用NMPA和CDE官方渠道获取信息是基础,再结合工具提升查询效率,并根据自身角色(公众、申请人、投资者)选择合适的查询深度。在交易实践中,应将查询工作贯穿于尽职调查、合同谈判、审批跟进的全过程,确保信息透明,降低交易风险。






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论