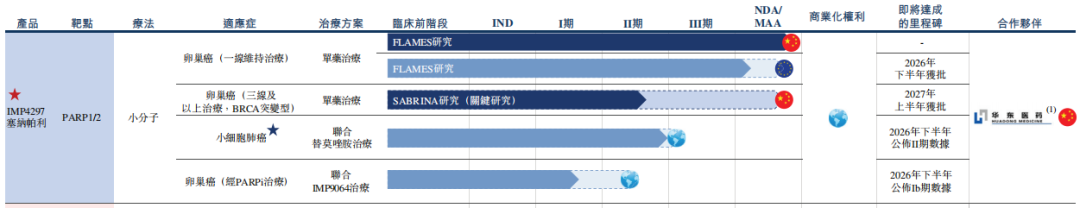
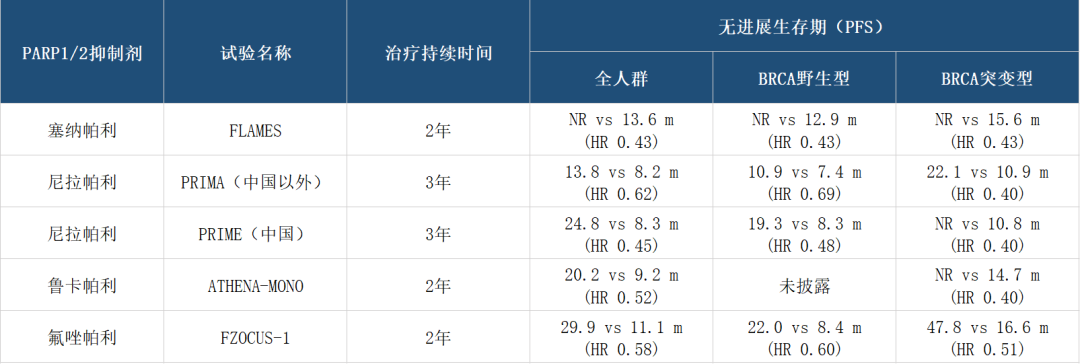
塞纳帕利已于今年9月获得国家医保谈判资格,若顺利纳入2026年医保目录,将直接触达此前因费用受限的患者群体,医保覆盖将成为提升塞纳帕利市场渗透率的核心杠杆。
而英派药业对塞纳帕利的布局远未止步。除中国市场外,塞纳帕利已启动欧洲上市申请(MAA已获EMA受理),预计2026年下半年获批。英派药业通过“自主研发+全球合作”双轮驱动,正在复制其在中国的商业化经验,力求将这一“全人群”疗法推向更广阔市场。
塞纳帕利与英派药业自研ATR抑制剂 IMP9064 的联用(Ib期),是公司基于合成致死概念深度理解的精准设计。此外,塞纳帕利联合替莫唑胺治疗小细胞肺癌的II期研究,已获得美国FDA孤儿药认定。临床前数据显示,该组合可通过双重破坏DNA修复机制,实现对恶性肿瘤的协同杀伤,尤其对化疗耐药患者潜力显著。此举标志塞纳帕利正从卵巢癌向肺癌等高发瘤种扩张,为其市场天花板打开新空间。
来源:招股书
二、下一代PARP1选择性抑制剂:从“广谱”走向“精准”
在肿瘤治疗领域,PARP抑制剂的研发正经历一场从“广谱”到“精准”的范式转移。英派药业新一代的PARP1选择性抑制剂 IMP1734 和 IMP1707 代表着公司向“精准调控”战略迈进的关键布局。
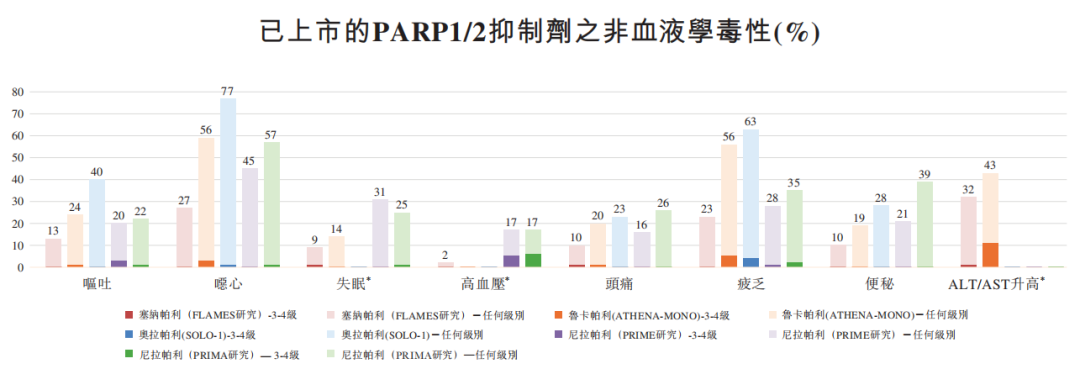
传统PARP抑制剂在延续患者生命的同时,也因其“广谱抑制”特性埋下了临床隐患。研究表明,其对PARP2的抑制是导致血液学毒性的关键因素之一,甚至可能引发治疗相关的髓系白血病风险。这不仅迫使患者频繁进行血常规监测、药物减量或暂停治疗,更严重限制了与其他抗癌疗法(如化疗、靶向药)的联合应用空间。
而新一代PARP1选择性抑制剂的研发,标志着该领域从“广谱杀伤”迈向“精准靶向”的关键转折。其核心突破在于,能够精准抑制PARP1并保留PARP2功能。这从机制上规避了因PARP2功能受限导致的血液学毒性,为患者带来了更优的安全性和更宽的治疗窗口。
从市场前景看,凭借其在安全性、药效和联合治疗潜力上的优势,PARP1选择性抑制剂在乳腺癌、前列腺癌及胶质母细胞瘤等实体瘤领域展现出巨大的市场潜力,有望开拓出超越传统PARP抑制剂的广阔市场空间。
英派药业自主研发的 IMP1734 实现了PARP抑制剂领域的重大技术突破,其对PARP1的选择性高达PARP2的648倍以上。这一数据在全球已披露的同类在研药物中位居前列。
根据已完成的I期剂量爬坡试验结果,IMP1734 单药治疗展现出优异的药代动力学特征和良好的耐受性。其在晚期实体瘤患者中的药代动力学特征支持一天一次的给药方案,有助于提高患者依从性。
试验特别关注了 IMP1734 在多线治疗失败的同源重组修复(HRR)突变患者中的表现,并观察到令人鼓舞的抗肿瘤活性。这一发现意义重大提示 IMP1734 可能为既往治疗选择有限的患者提供新的希望。与第一代PARP抑制剂相比,IMP1734 的安全窗显著扩大。这一特点使得患者有望能够接受更长时间的有效治疗,从而为改善长期疗效创造有利条件。
IMP1734 的临床布局精准聚焦于乳腺癌、前列腺癌、卵巢癌等全球高发且对PARP抑制剂治疗敏感的实体瘤领域。目前正通过全球I/II期临床试验评估其在晚期实体瘤与乳腺癌中的单药疗效,以及与阿比特龙联合治疗前列腺癌、紫杉醇联合治疗卵巢癌与乳腺癌的潜力,相关数据预计于2026年陆续公布。

来源:招股书
更令人瞩目的是 IMP1707,IMP1707 作为全球少数能高效穿透血脑屏障的PARP1选择性抑制剂,其核心优势在于对PARP1的选择性高达PARP2的800倍以上。这一特性从机制上规避了传统PARP抑制剂因抑制PARP2导致的血液学毒性,同时通过血脑屏障穿透能力,直接靶向颅内肿瘤微环境。非临床研究显示,IMP1707 在脑癌模型中实现肿瘤完全消退,最小有效剂量为0.2mg/kg,其潜力不仅限于外周实体瘤,更有望攻克胶质母细胞瘤等传统PARP抑制剂难以企及的颅内病灶。
临床前研究显示,IMP1707 在小鼠和大鼠模型中的脑部游离药物浓度(Kpuu=0.5)已达到治疗相关水平。这一数据表明IMP1707能够高效穿越血脑屏障,在脑组织中达到有效治疗浓度。这种高选择性特性与其卓越的血脑屏障穿透能力相结合,使其成为治疗原发性脑瘤和肿瘤脑转移的理想候选药物。
英派药业凭借 IMP1734(非脑部渗透性)与IMP1707(脑部渗透性)两款PARP1选择性抑制剂的协同布局,成为全球极少数同时覆盖中枢神经系统(CNS)与非CNS适应症的创新药企。这一双重布局直击肿瘤治疗领域的两大核心难点:外周实体瘤的广谱治疗需求与脑瘤/脑转移患者的血脑屏障穿透难题。
2023年,英派药业与美国生物技术公司Eikon Therapeutics达成独家授权协议,授予后者 IMP1734 与 IMP1707 在大中华区以外的全球权益,潜在交易总额高达9.56亿美元。通过将海外权益授权给Eikon,英派药业既降低了自身在全球开发中的资金与风险,又保留了大中华区的自主商业化权,形成“以技术换市场、以合作促研发”的全球化路径。Eikon将加速两款抑制剂的全球临床开发,若两款药物在海外临床中验证成功,英派药业还可获得里程碑付款及销售分成,实现长期收益。此外,这一合作模式为中国创新药企提供了范本:通过聚焦前沿技术差异化,在国际合作中最大化资产价值。
公开资料显示,Eikon Therapeutics由前默沙东全球研发负责人Roger Perlmutter联合创立并担任CEO,其曾主导大名鼎鼎的“K药”Keytruda(帕博利珠单抗)的获批上市。更值得一提的是,Eikon核心团队在PARP1/2抑制剂领域拥有深厚经验,曾参与阿斯利康的奥拉帕利与葛兰素史克的尼拉帕利的全球开发。其选择与英派药业合作,凸显了对这两款分子技术优势与市场潜力的高度认可,这无疑是对英派药业分子设计能力的强力背书。
三、合成致死生态:ATR抑制剂开启联合治疗新范式
PARP抑制剂的临床应用无疑是肿瘤治疗领域的重要突破,它通过“合成致死”机制有效杀伤BRCA1/2突变肿瘤细胞。然而,随着临床应用的扩大,耐药难题逐渐显现,成为限制其长期疗效的主要障碍。
在众多克服PARP抑制剂耐药的策略中,ATR抑制剂展现出独特优势。ATR是DNA损伤应答通路中的关键激酶,在应对复制应激和DNA损伤中起核心作用。尤其值得注意的是,ATR抑制剂对高复制应激或ATM缺失等修复缺陷的肿瘤特别有效。这种靶向性治疗策略使其成为PARP抑制剂耐药患者的理想“救援”疗法。
英派药业的 IMP9064 是潜在中国首个、具备同类最佳潜力的ATR选择性抑制剂。目前正通过全球I/II期试验评估其单药治疗及联合治疗用于晚期实体瘤的效果。
在I期剂量爬坡试验中,IMP9064 单药治疗于子宫内膜癌患者中观察到持久的部分缓解(PR),且间歇给药方案下安全性可控、耐受性良好。这一结果印证了ATR抑制剂在复制应激高负荷肿瘤(如子宫内膜癌)中的治疗潜力。其“间歇给药”设计尤具巧思——通过给药间歇期允许正常细胞修复DNA损伤,既维持抗肿瘤活性,又规避了持续给药可能叠加的血液学毒性,为后续联合用药留出安全窗口。
基于I期积极信号,IMP9064 的II期临床试验重点探索其在晚期子宫内膜癌的单药疗效。若II期数据进一步验证疗效,IMP9064 有望成为该领域首个获批的ATR靶向疗法,抢占差异化市场。
ATR抑制剂的价值远非简单的“协同增效”,其核心在于精准靶向PARP抑制剂耐药的核心机制,ATR也被业界认为是继PARP后最有希望的合成致死靶点之一。2025年9月NMPA对 IMP9064(ATRi)与塞纳帕利(PARPi)联合疗法IND的批准,标志着英派药业成为全球极少数实现“自有PARPi+自有ATRi”内部协同的生物技术公司。IMP9064 这一ATR抑制剂的出现,为PARPi耐药后的晚期卵巢癌治疗带来了新的曙光,或将成为打破当前困境的关键力量。

来源:招股书
英派药业凭借在合成致死领域的系统性靶点布局,已构建全球生物医药公司中覆盖面最广的DDR产品组合之一。其管线涵盖PARP、WEE1、ATR、ATM、CHK1/2等关键靶点,并拓展至ADC及蛋白降解剂等新兴疗法。这种布局并非简单堆叠项目,而是旨在形成内部联合用药的闭环生态。这种“自有PARPi+自有ATRi”的组合,不仅规避了跨企业合作的权益分割难题,更通过协同机制(如逆转耐药、扩大适应症)加速临床开发,为商业化争取黄金时间窗口,掌握定价与市场主导权。

来源:招股书
四、平台驱动长期竞争力:不止于管线,更是体系
英派药业在合成致死领域的持续创新,并非偶然,而是源于其精心构建的独特战略体系。这套体系不仅支撑了塞纳帕利、IMP1734、IMP9064等核心产品的诞生,也决定了其在行业竞争中的独特地位。
英派药业的靶点布局始终遵循 “未满足临床需求导向”原则,其决策核心在于识别现有疗法的关键缺陷(如毒性、耐药性)并针对性设计突破路径。在分子设计上,融合CADD、AIDD等前沿技术,采用“机制优先、结构引导”的方法,成功开发出多个突破性药物。
英派药业技术平台战略:以合成致死为基石,构建下一代抗癌疗法生态:
ADC连接子-载荷平台:以“合成致死”为基石的精准递送革命
英派药业的ADC技术平台并非简单跟随行业热点,而是基于其在合成致死领域积累的高活性分子库进行差异化布局。传统ADC载荷多源于经典化疗毒素(如MMAE、DM1),而英派药业则从其PARP、ATR、WEE1等抑制剂管线中筛选高活性小分子作为新型载荷,形成“合成致死机制+靶向递送”的双重优势。这种策略不仅提升ADC的疗效特异性,更通过内部管线协同降低研发成本,形成“一鱼多吃”的杠杆效应。
靶向降解平台:攻克“不可成药”靶点的系统性解法
英派药业在靶向蛋白降解领域的布局覆盖PROTAC、分子胶等多条技术路径,其核心优势在于自有E3连接子配体库与分子胶化合物库的积累。与传统抑制剂相比,降解技术可直接清除致病蛋白而非仅抑制功能,尤其适用于转录因子、支架蛋白等传统“不可成药”靶点。英派药业通过合理设计PROTAC分子(如优化连接子长度与刚性),平衡细胞渗透性与降解效率,并在临床前模型中验证了对BRCA突变恢复导致的PARPi耐药细胞的显著活性。此外,其分子胶平台聚焦于CRBN、DDB1等E3连接子调节剂,探索与合成致死靶点的协同效应(如分子胶+WEE1抑制剂的联合方案),为后续联合疗法拓展基础。
通过这三大核心优势,英派药业构建了“上市产品-临床开发-前沿探索”三级联动的生态模型。已商业化的PARP抑制剂塞纳帕利为早期研发提供现金流支持;临床阶段的PARP1选择性抑制剂IMP1734等资产通过对外授权(如与Eikon Therapeutics的潜在交易总额达9.56亿美元交易)反哺资金池;而ADC、靶向降解等前沿平台则依托内部协同降低试错成本。这种结构使研发投入形成自我造血循环,而非单纯依赖外部输血。
2024年生物科技领域融资规模收缩40%的背景下,英派药业连续完成D+轮(4亿元)与D++轮(2.5亿元)融资。这一表现背后是资本市场对其平台化稀缺性的认可:英派药业已成为全球仅有两家同时拥有脑部渗透性与非脑部渗透性PARP1选择性抑制剂的公司之一,且其“自有PARPi+自有ATRi”的闭环联合策略(如塞纳帕利+IMP9064方案获NMPA批准IND)难以被竞争对手复制。投资者押注的并非单一产品,而是其将科学洞察转化为临床方案的体系化能力。
五、现金储备与BD收入:初步验证商业模式
英派药业在财务策略上展现出了前瞻性的布局和稳健的变现能力,其资金储备与收入结构清晰地反映了公司正处于从研发投入向商业化成果转化的关键爬坡期,且势头强劲。截至2025年6月30日,公司持有的现金及现金等价物等金融资产约3.9亿元。这笔资金为公司核心产品 塞纳帕利(Senaparib) 的进一步市场推广,以及包含PARP1选择性抑制剂在内的多个化合物的全球临床开发提供了坚实的财务基础。
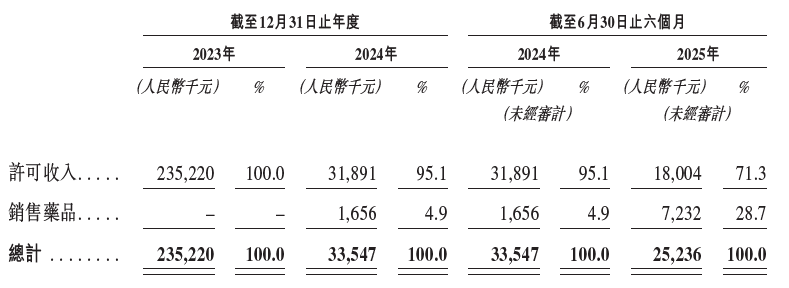
英派药业在产品商业化前,已能通过对外授权实现显著的许可收入。2023年与美国生物技术公司Eikon Therapeutics就PARP1选择性抑制剂 IMP1734 与 IMP1707 达成全球授权合作,带来了数千万美元的首付款。
随着其核心产品 塞纳帕利 在2025年1月正式获批用于中国卵巢癌“全人群”一线维持治疗后,药品销售收入开始贡献业绩。2025年上半年,药品销售收入已达到723万元,占总收入比重升至28.7%,同比增长超300%,标志着公司的商业化进程取得了实质性进展。随着核心产品进入国家医保谈判阶段、后续管线持续推进临床,英派药业的收入来源有望从“单一授权”向“授权+销售”双轮驱动演进。这一转变,初步验证了其以自主研发为基础、全球合作与本土商业化并行的可持续商业模式。
六、商业化激励与压力共存?
综合来看,英派药业在合成致死赛道的确展现出差异化布局。一方面,“全人群”策略打开了最大患者池,新一代分子设计亦具备机制创新性;另一方面,核心产品已通过战略合作验证初步价值。
不过,也要看到,PARP抑制剂市场已进入高度竞争阶段。公开数据显示,2025年上半年,阿斯利康的 奥拉帕利 全球销售额达15.6亿美元,再鼎医药的 尼拉帕利 中国销售额约合人民币5.8亿元,恒瑞医药、齐鲁制药等本土企业也已入局这一赛道。而在ATR抑制剂领域,也有阿斯利康、罗氏、拜耳等跨国药企布局其中。
对已实现产品上市、全球授权与联合管线并行的英派药业来说,赛道的热度既是压力,也可能成为将多年技术积累转化为商业价值的转折点。
港股交表之际,英派药业这场关于机制、分子与临床洞察的长跑——才刚刚进入加速区。
参考来源:
[1] 企业招股书/官方披露
[2] 摩熵医药(原药融云)数据库
扩展阅读:
1. 英派药业:PARP抑制剂塞纳帕利国内获批卵巢癌治疗!
2. 恒瑞医药:新型口服PARP抑制剂氟唑帕利胶囊新适应症上市申请获批
3. 强生:国内首款PARP抑制剂组合癌症新药泽倍珂获批上市
想要解锁更多药企信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论