
你是否也听过这样的说法:人就像一台旧机器,用久了零件总会出问题。年龄越大,细胞分裂次数越多,基因突变的“错误”积累也就越多,得癌症的风险自然水涨船高。这听起来合情合理,对吧?毕竟,大多数癌症确实是在中老年阶段被诊断出来的。
但科学总是喜欢打脸“常识”。不知你是否留意过,流行病学数据显示,癌症发病率在达到一个高峰后,在最年长的人群(例如超过85岁)中,其增长势头反而会减缓甚至下降——难道活到一定岁数,身体反而开启了“抗癌模式”?
这篇来自斯坦福大学团队的最新研究,正是在探索这个反直觉的现象。他们不再局限于“突变积累”这个传统视角,而是直接拷问:衰老本身,这个复杂的身心变化过程,对肿瘤的“诞生”和“成长”究竟产生了怎样的直接影响? 他们的发现或颠覆了我们的认知:衰老,不仅能抑制某些癌症的发生发展,甚至还重塑了肿瘤内部的“游戏规则”!

为了排除现实生活中老年人诊断不足、共患病多等干扰因素,研究人员祭出了他们的拿手实验对象——基因工程小鼠模型。他们培育了一种特殊的小鼠,其肺部细胞在接触到一种特定病毒(携带Cre重组酶)后,会激活一个强力的致癌基因——KRAS(这是人类肺癌,尤其是腺癌中最常见的驱动基因之一)。
这样一来,研究人员就能在年轻鼠(4-6个月,相当于人类青壮年)和老年鼠(20-21个月,相当于人类古稀之年) 身上,于完全相同的时间点、以可控的方式“点燃”肺癌的火种——KRAS基因。随后观察肿瘤的生长轨迹、基因响应以及细胞状态,最终得出令人意外的结论:衰老不仅延缓了肿瘤的发生,还显著削弱了某些致癌突变的“破坏力”。
👀 核心发现一:衰老反而是“肿瘤减速剂”
在通过气管给年轻组(4-6个月大)和年老组(20-21个月大)的小鼠注射相同剂量的携带有Cre重组酶的慢病毒(Lenti-Cre)后,研究人员等待了15周让肿瘤发展。
结果,两组小鼠的肺部呈现出截然不同的景象:年轻小鼠的肺内布满了红色荧光蛋白标记的肿瘤灶,数量多、体积大,导致肺重明显上升;而年老小鼠的肺部则“冷清”许多(下图b)。
定量分析显示,年老小鼠的肿瘤负荷比年轻小鼠足足低了2到3倍(下图c-d)!
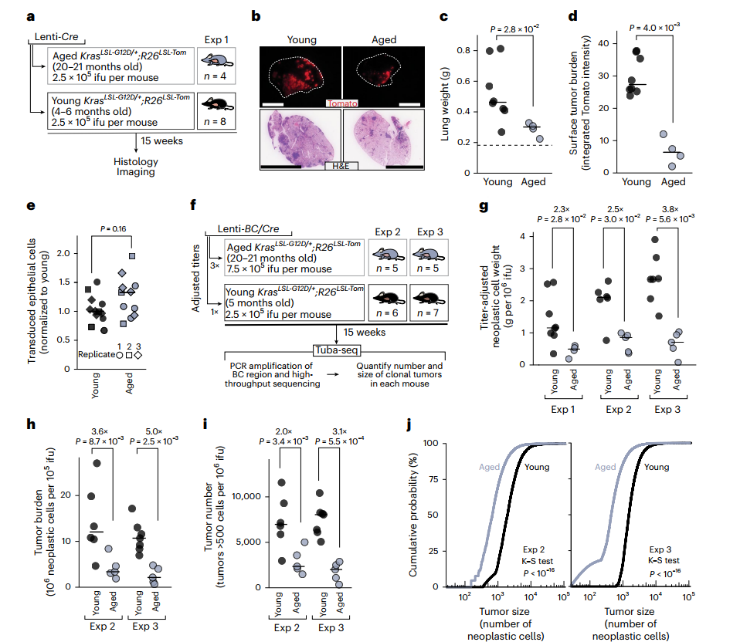
图1:衰老抑制了KRAS驱动的肿瘤发生与生长
👀 是不是感觉很不可思议?
这一反直觉的现象也同样促使研究人员思考:这种差异是否源于年老小鼠的肺细胞更不容易被病毒感染?为了排除这种可能性,他们设计了对照实验,给年轻和年老的小鼠注射了一种表达绿色荧光蛋白的慢病毒,然后通过流式细胞术和免疫组织化学来量化被成功转导的上皮细胞比例。
实验证实,年轻和年老小鼠的肺上皮细胞被病毒成功“转导”的效率并无差异(上图e)。因此,年老小鼠肿瘤负荷显著降低这一现象是实打实的,源于衰老的肺部环境本身对肿瘤的强烈抑制。
但科学家并未止步于此。他们想知道,衰老究竟是通过减少肿瘤的起始,还是抑制了其后续生长,或是两者兼有?为了精确解答这个问题,他们借助了一种名为 Tuba-seq 的高通量肿瘤条形码技术。这种技术能给每一个由单细胞起源的肿瘤克隆打上独特的“DNA条形码身份证”。
Tuba-seq的分析结果清晰地揭示:年老小鼠不仅成功起始的肿瘤数量更少,而且每个肿瘤的平均体积也显著小于年轻小鼠(上图h-j)。这表明,衰老既抑制了肿瘤的“诞生”(起始),也拖慢了它们“扩张”的脚步(生长)。
👀 核心发现二:老了,“刹车”失灵也不慌
接下来,研究团队进一步探究了衰老是如何影响肿瘤的“进化”。他们设计了一个巧妙的“多重基因敲除”实验,利用一个包含25个已知或潜在肿瘤抑制基因的 CRISPR/Cas9 慢病毒库来同时诱发肿瘤并敲除这些“刹车”基因。
在这些“刹车”基因中,包括 Pten, p53, Nf1 等众所周知的强效抑癌基因。在年轻小鼠中,失活这些基因(尤其是Pten)会为肿瘤生长提供巨大的优势,因为PTEN是 PI3K-AKT 这条核心促生存、促增殖信号通路的关键负调控因子。然而,在年老小鼠中,这种因基因失活而获得的“生长优势”被普遍且显著地削弱了。
其中,PTEN的失活效应表现出了最显著的年龄依赖性削弱。研究人员甚至使用了三种不同的向导RNA来靶向Pten,并在不同的实验中都一致地观察到:在年老的小鼠体内,即使拆除了Pten这个“刹车”,肿瘤也“飙”不起来,其促瘤效果远不如在年轻体内那么猛烈(下图2e;下图3h)。这表明,衰老的组织环境不仅整体抑制肿瘤,更深刻地改变了特定致癌通路的“游戏规则”!
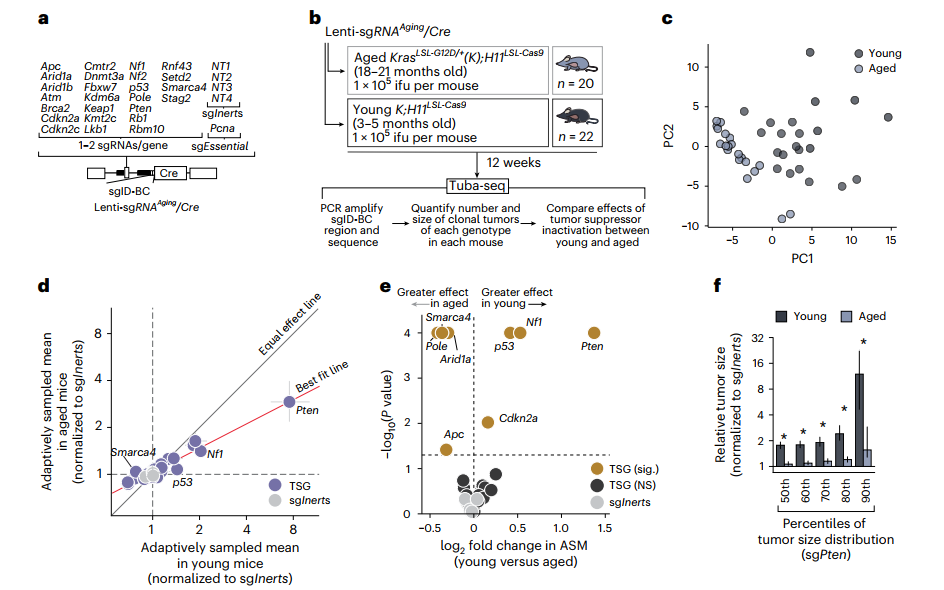
图2:衰老削弱了肿瘤抑制基因失活的促癌效应
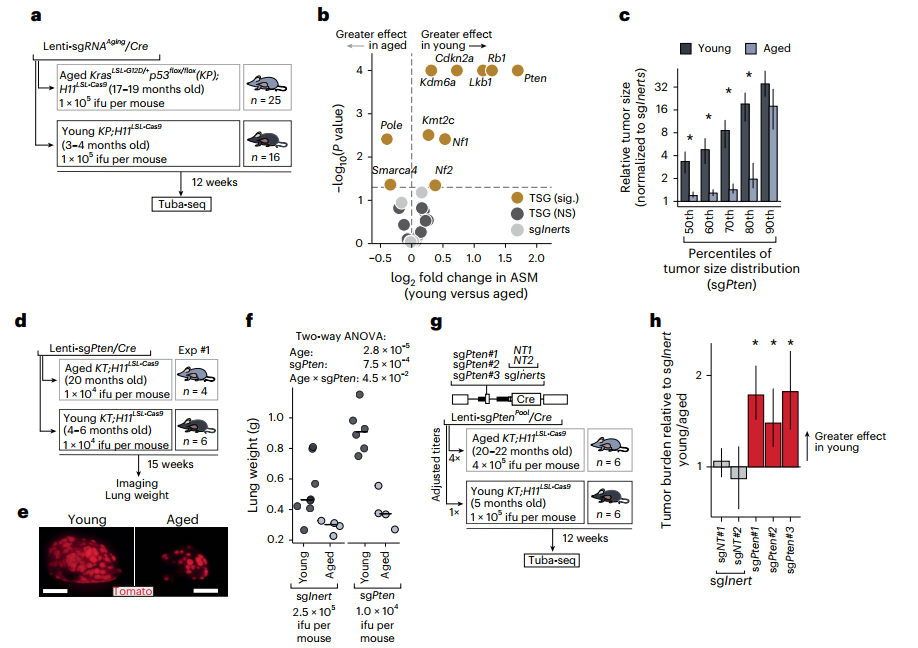
图3:Pten介导的肿瘤抑制功能随年龄变化的差异验证
👀 核心发现三:机体老了,癌细胞也“服老”了
这一发现引发了更深层的疑问:是老年小鼠的癌细胞“本身”变了,还是其周围的“微环境”不再支持其生长?为了在分子层面解答这个问题,研究团队动用了单细胞RNA测序技术,对肿瘤组织进行了解析,精确绘制了年轻与年老小鼠体内癌细胞及其周围所有免疫和基质细胞的基因表达图谱。
分析结果非常明确:即便已经癌变,那些在老年小鼠体内长出来的癌细胞,依然清晰地保留着正常老年细胞的典型分子特征。这些“老年”癌细胞表现出MAPK信号通路(KRAS驱动的核心生长信号)活性下降(下图f),这解释了其为何增殖缓慢。与之形成鲜明对比的是,年轻小鼠的癌细胞则充满活力,生长信号强劲。简单来说就是,癌细胞即使“变坏”了,也摆脱不了其所在宿主的“年纪大、跑不动”的生理宿命。
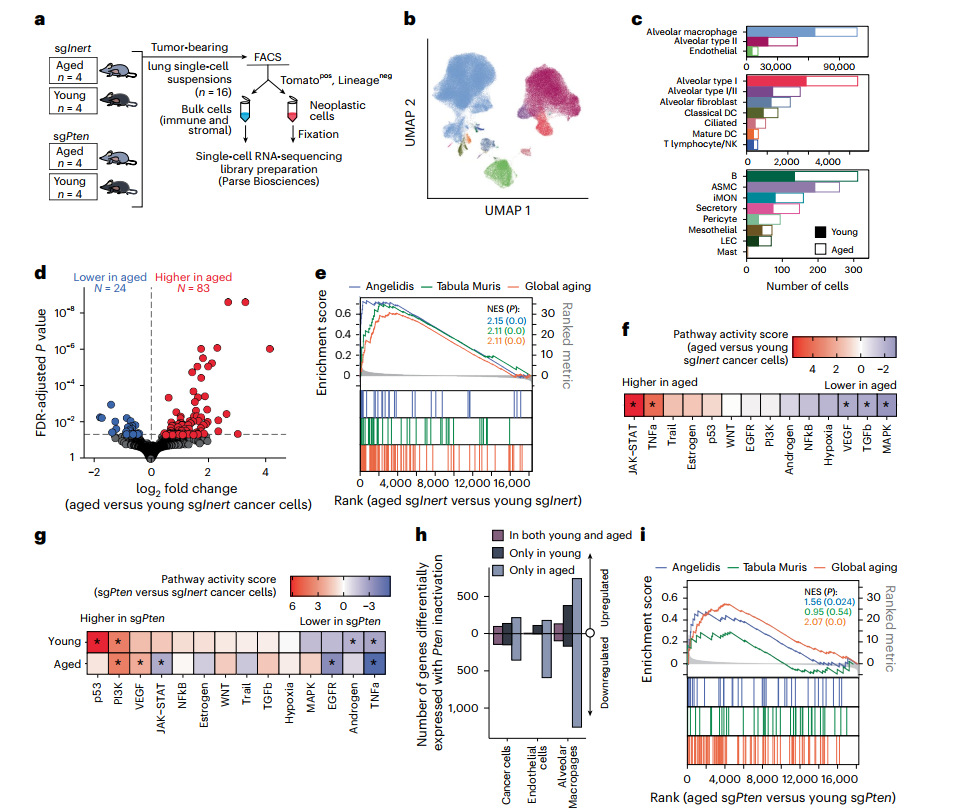
图4:单细胞转录组揭示衰老与Pten失活对癌细胞状态的影响
更神奇的现象出现在比较PTEN缺失对年轻与年老癌细胞的影响时。尽管PI3K通路在两者中都同样被强烈激活,但其下游的效应却大相径庭——在年轻癌细胞中,PTEN缺失如同踩下油门,激活了大量与生长相关的基因程序;而在年老癌细胞中,许多下游基因的反应却相对迟钝。
研究人员甚至发现,Pten失活后,老年小鼠的癌细胞在某些方面变得“更年轻”——当直接比较年轻和年老小鼠中PTEN缺失的癌细胞时,它们之间的差异远小于正常癌细胞之间的年龄差异,一些衰老相关的基因特征被逆转了。然而,这种“装年轻”并未带来实际的增长优势,这就好比一位老年人换上了年轻人的行头,外表虽显年轻,但身体的机能和活力却再也无法真正回到青年时代。
👀 核心发现四:老了,肿瘤“邻居”也不配合
肿瘤的生长不仅取决于癌细胞本身,也离不开其周围的“邻居”——肿瘤微环境。 研究发现,衰老同样深刻地改变了这个微环境。单细胞测序分析揭示,PTEN缺失对肿瘤微环境中各种细胞(如肺泡巨噬细胞、内皮细胞)的基因表达影响,强烈地依赖于宿主的年龄。
在年轻宿主中,微环境会积极响应PTEN缺失的肿瘤,为其生长“供血供能”;而在年老宿主中,微环境则显得“反应冷淡”,支持力度大打折扣。免疫组化分析甚至发现,年老小鼠的肿瘤内部免疫细胞浸润更多,但这些细胞像一群“反应慢但巡逻勤”的老保安,虽未发动猛烈攻击,也可能形成了一种抑制性的氛围。
值得一提的是,研究人员还专门设计实验来检验“免疫衰老”是否是主导因素。他们敲除了一系列免疫相关基因,结果发现:即使失活这些基因中的大多数,在年轻或年老小鼠中都没有效果或效果极弱。
这说明,衰老对肿瘤的抑制作用,主要并非通过免疫系统的老化实现,而更可能是癌细胞本身及其微环境固有的“老化状态” 共同构建了一道防线。
👀 小结
综上,这项研究彻底颠覆了我们所认为的“衰老=癌症高风险”的简单等式,实验表明:衰老在多个层面上构建了一种综合的“抗肿瘤状态”。从肿瘤的起始、生长,到关键致癌突变(如PTEN缺失)的效能,再到微环境的支持力度,老年机体都表现出更强的“抵抗力”。
原来,不是老人“容易得癌”,而是老人“患癌了也更不容易被癌打败”,因为衰老在某种程度上“钝化”了癌症的锋芒。
参考文献:Shuldiner EG, Karmakar S, Tsai MKet al. Aging represses oncogenic KRAS-driven lung tumorigenesis and alters tumor suppression. Nat Aging. 2025 Nov 4. doi: 10.1038/s43587-025-00986-z. Epub ahead of print. PMID: 41188600.
文章来源:生物谷
原文链接:https://mp.weixin.qq.com/s/lbQ9oLGIWvWZzXrMLqybyg
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论