声明:因水平有限,错误不可避免,或有些信息非最及时,欢迎留言指出。本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及);本文不构成任何投资建议。
真实世界数据标准化的挑战
FDA 认识到将来自RWD真实世界数据来源的研究数据标准化以纳入适用的药物提交所涉及的挑战。这些挑战包括但不限于:(1) RWD 来源的多样性及其不一致的格式(例如 EHR(电子健康档案)、注册表);(2) 使用不同的标准、术语和交换格式来表示相同或相似的数据元素,在区域和全球范围内捕获的源数据的差异;(3) 用于创建旨在聚合数据的数据集的广泛方法和算法;(4) 医疗保健数据的许多方面会影响数据的整体质量,包括业务流程和数据库结构、不一致的词汇和编码系统,以及用于在共享时保护患者数据的去标识化方法。
真实世界数据管理流程文档
在数据管理和数据转换期间,应采取适当的流程来增加对结果数据的信心。这些过程的文档可能包括但不限于从源数据系统到最终研究分析数据集的数据添加、删除或更改的电子文档(即源数据驱动的审计跟踪、质量控制程序等)。申办者还应在其适用的药物提交中记录数据更改,以符合当前 FDA 支持的数据标准,以及这些更改的潜在影响。
真实世界数据符合当前支持的 FDA 研究数据标准的注意事项
FDA 计划发布进一步的指导和/或更新目录,其中包含来自 RWD 来源的研究数据的标准。目前,在没有豁免的情况下,申办者在提交FD&C 法案第 745A(a) 节要求提交的临床和非临床研究数据(包括那些来自 RWD 来源的数据)必须使用研究数据指南中描述的格式和支持的格式。目录中列出的研究数据标准。申办者在向 FDA 提交适用的药物研究数据时,应参考研究数据技术一致性指南中(Study Data Technical Conformance Guide)要求的规范、建议和一般注意事项。在寻求使 RWD 符合 FDA 支持的数据标准时,申办者应考虑在适用的药物提交中以所需格式生成研究数据集可能需要的相关数据转换、转换或映射。
申办者应尽早与适当的 FDA 审查部门讨论任何计划提交的适用药物提交中源自 RWD 来源的研究数据及其将数据转换为当前 FDA 支持的数据标准的方法。申办者应描述这些方法,包括在方案、数据管理计划和/或最终研究报告中。
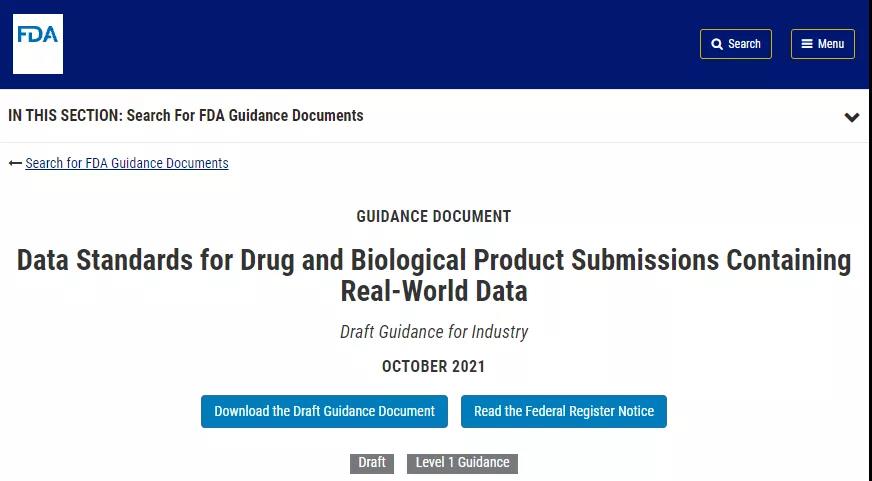
FDA 认识到可以使用一系列方法将当前支持的数据标准(例如,临床数据交换标准联盟 (CDISC, Clinical Data Interchange Standards Consortium) 的研究数据列表模型 (SDTM, Study Data Tabulation Model))应用于 EHR 或claims data医保数据等 RWD 来源。
通过对所用一致性方法及其原理的充分记录,从 RWD 得出的研究数据可以转换为 SDTM 数据集,并在适用的药物提交中提交给 FDA。
将真实世界数据映射到研究数据提交标准的注意事项
FDA 意识到,对于几乎每个数据领域,RWD 来源和 FDA 支持的数据标准之间使用的术语及其精确含义存在很大差异。示例包括用于种族/民族的含义和特定术语、药物术语系统以及对重要测量的医疗保健记录的解释。即使对于看似相同记录的变量(例如,男性/女性),这些变量在 RWD 来源和 FDA 支持的数据标准之间的定义方式也可能存在差异。例如,作为变量的性别可能在 CDISC 的术语中被编纂为基于身体特征的概念,而 EHR 可能使用性别。在这种情况下,申办者应记录将性别变量或其他变量映射到 CDISC 术语对研究结果的潜在影响。
申办者为 RWD 选择特定 CDISC 数据元素的理由的文档以及两者之间差异的文档是至关重要的。申办者应提供数据映射的一般方法和预期影响的描述,作为研究数据审查者指南的一部分或附录,以突出所涉及的领域。此外,发起人应包括一个数据字典,其中记录了所使用的每个数据元素的定义以及有关该元素的所有相关信息,例如其与其他数据的关系、来源、用途和格式。技术细节最好不要包含在研究数据审阅者指南中,可以通过指导审阅者到定义 XML 文件(见附录)和相关数据集/域中的详细映射来引用。
数据转换的注意事项
申办者在将 RWD 转换为符合 FDA 支持的数据标准的数据时可能会遇到挑战。这些挑战包括(但不限于)健康记录中多个位置存在的语义概念(术语)的管理(例如药物信息)、概念的不一致编码或错误编码(例如药物或诊断)、研究期间发生的数据收集或编码规范(例如,国际疾病分类-9 (ICD-9) 和 ICD-10 代码)的变化,或信息缺失(因为信息通常没有记录在医疗保健要求中或由于不一致的数据输入)。
申办者应记录在转换为 FDA 支持的数据标准期间遇到的数据挑战,以及他们的方法的理由,以支持 FDA 支持的数据标准的应用。可以使用Define-XML(见附录)和域数据文件处理标准和术语的映射。鉴于描述用于协调源数据中任何挑战的方法的基本原理和理由可能需要自由文本描述,此外,应在研究数据审查者指南中以正文或附录形式提供叙述,如果需要,为审阅者提供有关定义 XML 和数据集/域的适当说明以获取更多详细信息。
更多可以进群交流


































































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论