
低密度脂蛋白胆固醇(LDL-C)
据统计,中国心血管疾病患者人数已高达 2.9 亿,平均每年约 350 万人死于心血管疾病。低密度脂蛋白胆固醇(Low Density Lipoprotein Cholesterol,LDL-C)升高被确认为是心血管疾病的重要发病因素之一,尤其对于那些 1 年内罹患过心血管疾病的极高危患者,若未能有效干预,可能会引起复发,威胁健康和生命。数据显示,在极高危患者群体中,80% 患者通过现有治疗无法充分控制其 LDL-C 水平,这意味着这类患者亟需创新治疗措施。其中,对于已经应用了他汀类药物治疗,但 LDL-C 水平依然不达标的急性冠脉综合征(包括心梗和不稳定性心绞痛)患者,这种需求更为急迫。
《中国心血管健康与疾病报告2021》显示,2019年农村、城市中心血管疾病(CVD)分别占死因的46.74%和44.26%。每5例死亡中就有2例死于心血管疾病。心血管疾病仍是我国居民“头号杀手”。高血脂是导致动脉粥样硬化性心血管疾病(ASCVD)的主要危险因素之一。研究数据显示,我国18岁及以上血脂异常人群的治疗率和控制率仅19.5%和8.9%。
血脂异常尤其是LDL-C水平升高是导致ASCVD发生、发展的关键因素。研究发现,PCSK9抑制剂(proprotein convertase subtilisin-kexin type 9,前蛋白转化酶枯草溶菌素 9)能促进肝脏清除LDL-C,从而降低LDL-C水平。药融云数据(vip.pharnexcloud.com/?zmt-mhwz)显示:目前全球范围内,PCSK9抑制剂包括单抗、口服环肽、小分子、ASO、siRNA、CRISPR基因编辑等候选药物(《2022年PCSK9抑制剂研发!降脂药中“黑马”,价格硬伤如何突围?》)。
PCSK9抑制剂在研新药(部分)
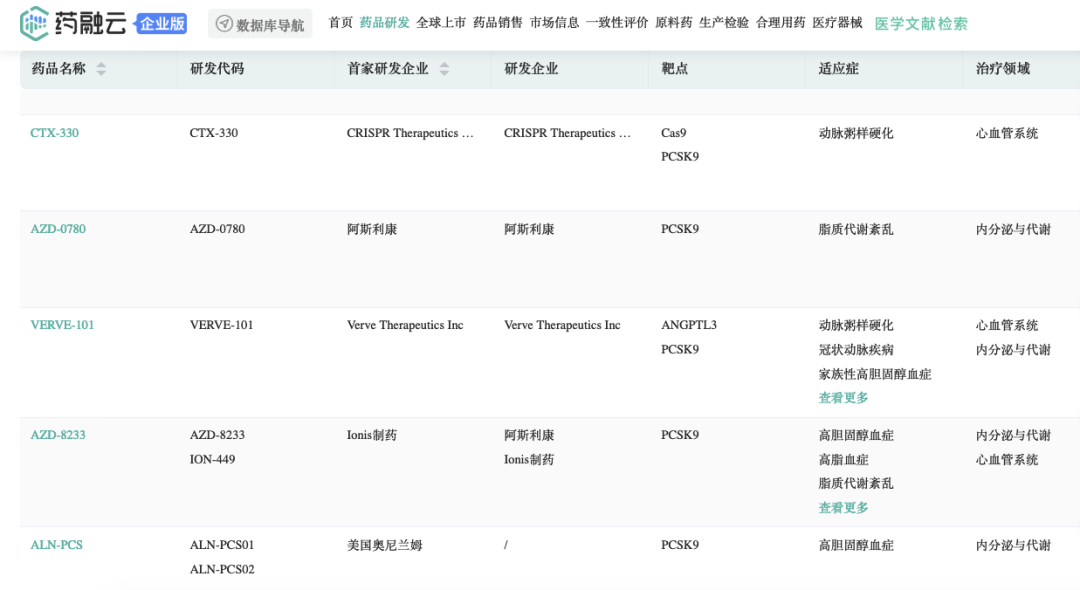
▲药融云数据 www.pharnexcloud.com/?zmt-mhwz;
每年两次皮下注射的小核酸新药

2020年6月28日,诺华首创的PCSK9小分子干扰RNA(siRNA,Small Interfering RNA Drug)小核酸新药inclisiran的临床申请IND首次获得我国CDE受理。诺华于2019年11月通过97亿美元收购The Medicines Company获得其核心产品PCSK9 RNAi产品Inclisiran(最早由Alnylam发现的新药),长效合成的一款在研新药,相关专利:WO-2007134161、WO-2009073809、WO-2014089313。
Inclisiran药物基本信息

截图来源:药融云全球药物研发数据库
2020年3月,Inclisiran治疗成人高脂血症的3项重要III期临床试验结果已发表于《新英格兰医学杂志》(NEJM)。这3项试验均达到了主要终点,结果显示:与安慰剂相比,在接受两次初始剂量注射后,每年两次皮下注射inclisiran治疗能持久和显著地降低LDL-C。inclisiran具有良好的耐受性,其安全性与安慰剂相似。该小核酸新药用于接受最大耐受剂量降脂疗法但LDL-C水平依然升高的ASCVD或HeFH成人患者。
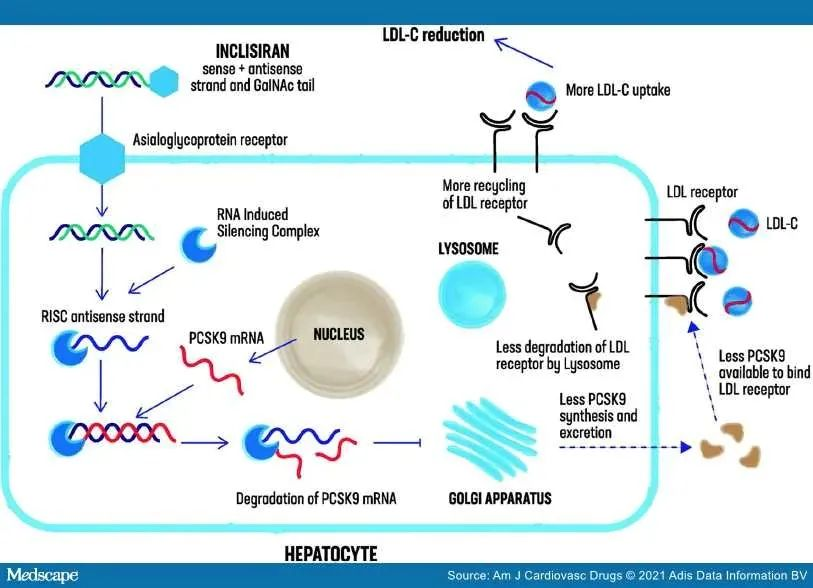
2020年12月11日,Inclisiran(Leqvio®)获欧盟(EC)上市批准,成为首款也是唯一的siRNA类降胆固醇药物。
Inclisiran研发现状
截图来源:药融云全球药物研发数据库
目前本小核酸新药正在中国展开三项3期临床试验(其中一项临床,2021年3月开始入组)。
2021年7月1日,inclisiran全国首针在海南博鳌完成注射,目前有上千例患者使用(博鳌先行区和粤港澳大湾区)。值得注意的是,本品目前适应症针对:
- 服用他汀类药物后,血脂不达标;
- 不能耐受他汀类降脂药;
- 家族性高胆固醇血症的患者。

药融云数据显示:2021年12月22日,美国FDA终于批准本品上市;在2022年1月推向美国市场。2022年第3季度,inclisiran业绩为3400万美元;2022年全年或将接近一亿美元。
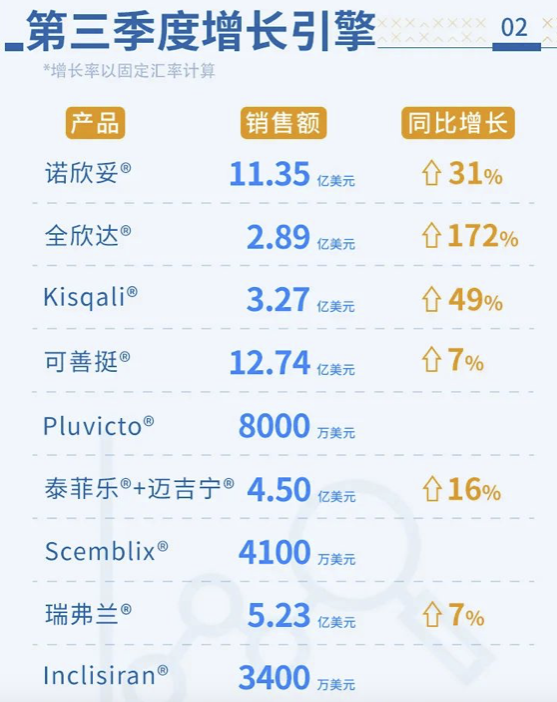

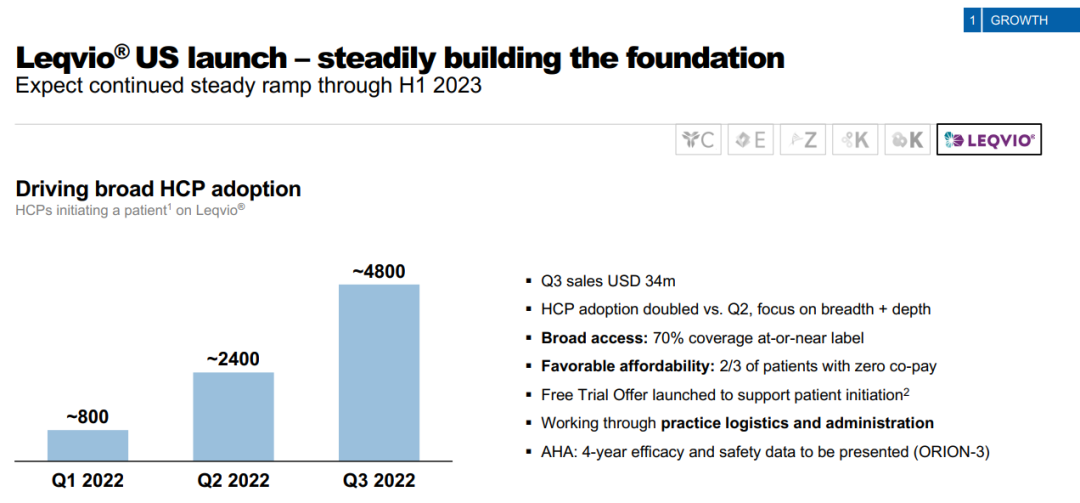
▲https://www.novartis.com/news/novartis-financial-results-q3-2022
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据vip.pharnexcloud.com/?zmt-mhwz;
FDA/EMA/PMDA;
相关公司公开披露;
www.novartis.com;
https://www.leqvio.com;诺华首创小干扰核酸疗法Leqvio®获FDA批准,一年两针持续有效降脂;
European Heart Network. European Cardiovascular Disease Statistics 2017 edition,http://www.ehnheart.org/cvd-statistics/cvd-statistics-2017,November 2020;
Novartis enters into agreement to acquire The Medicines Company, https://www.novartis.com/sites/www.novartis.com/files/novartis-agreement-acquire-medicines-company-investor-presentation.pdf;
Ray K, Wright R, Kallend D, et al. Two Phase 3 Trials of Inclisiran in Patients with Elevated LDL Cholesterol [published online ahead of print March 18, 2020]. N. Engl. J. Med., https://www.nejm.org/;
Raal, F, Kallend D, Ray K, et al. Inclisiran for Heterozygous Familial Hypercholesterolemia [published online ahead of print March 18, 2020]. N. Engl. J. Med., https://www.nejm.org/;等等。
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、申报审批情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论