CAR-T细胞疗法正在全球范围内如火如荼地研发,虽然进入CAR-T领域较晚,但以项目数量来看,我国已成为了仅次于美国的第二大CAR-T细胞疗法研发国家。靶点方面,BCMA逐渐开启神仙打架的局面,浙江康佰裕生物最新入局。
近日,国家药品监督管理局药品审评中心(CDE)官网显示,浙江康佰裕生物科技有限公司(以下简称“康佰裕生物”)提交的CBG002 CAR-T细胞注射液临床试验申请获得受理(受理号:CXSL2300174)。这是康佰裕生物首款申报的生物创新药,目前官方尚未披露信息。
CBG002药物研发信息(部分,微信搜索"药融云小程序"进行相关更多数据查询)
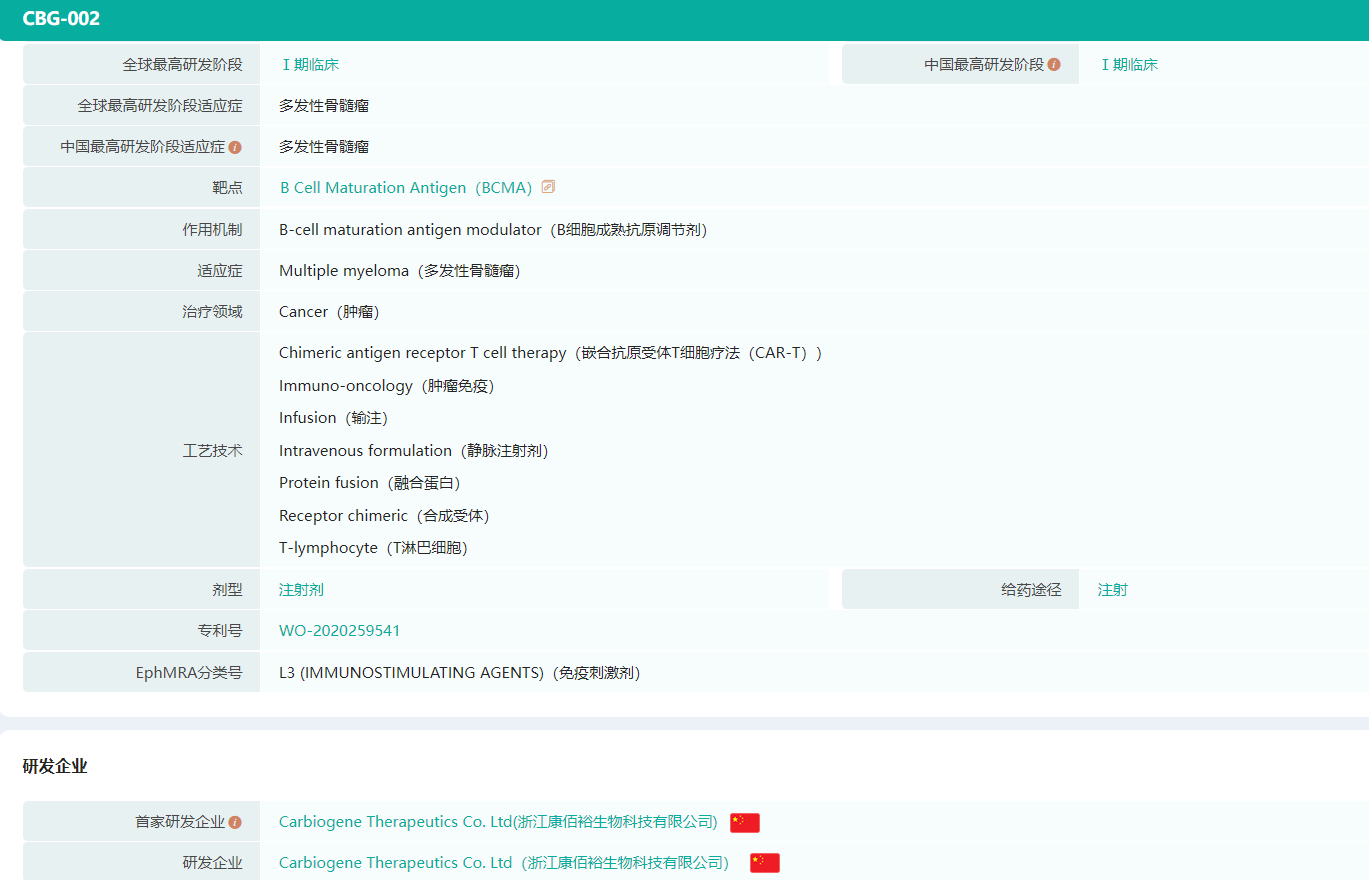
截图来源:药融云全球药物研发数据库
据此前CBG002的临床试验(NCT04706936)显示,CBG002是浙江康佰裕生物科技有限公司自主研发的BCMA靶向的第四代CAR-T细胞疗法产品,适用于多发性骨髓瘤的治疗。截至目前,暂时还没有国产BCMA靶向CAR-T细胞疗法获批上市。不过国内竞争形势已日趋激烈,药企们火力全开,大展身手,国产首款究竟鹿死谁手?(《国产首款BCMA靶向CAR-T疗法,上市在即!信达、科济、传奇...花落谁家?》)
从申请号为CN201910555126.8的专利可以猜测,该BCMA靶向CAR-T细胞疗法可能由人CD8先导肽、BCMA scFv、人CD8铰链跨膜区、人4-1BB胞内区、人CD3ζ胞内区、P2A肽、人CD27所组成。
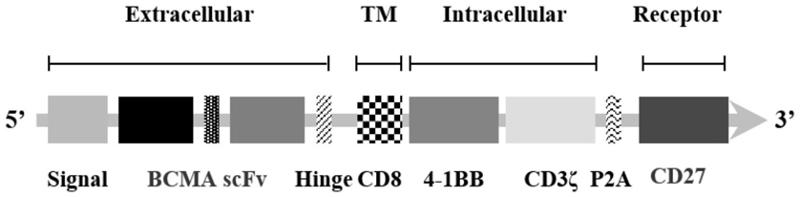
申请号:CN201910555126.8
康佰裕公司官网和其申报的CAR-T相关专利显示,该公司CAR-T细胞疗法产品线的布局广泛,治疗领域覆盖血液瘤和实体瘤。在传统的CAR设计基础上,康佰裕整合了自杀基因和精准调控元件,自主研发创新CAR-T技术。除了第四代BCMA靶向CAR-T细胞疗法,其他CAR-T在研靶点还包括实体瘤靶点GPC3、MSLN、Claudin18.2、血液瘤靶点CLL1,均为拥有自主知识产权的第四代CAR-T细胞疗法。
其中,针对肝癌的GPC3靶点CAR-T细胞疗法与针对急性髓性白血病的CLL1 CART已经开始IND申报过程,Claudin18.2与MSLN靶点也完成了早期研发。除CAR-T,公司还布局的产品包括疫苗,CAR-NK与逆转录病毒业务,康佰裕拥有全球领先的逆转录病毒精纯技术,能控制病毒的残留杂质远超行业标准。

康佰裕官网
一、关于CAR-T细胞疗法
CAR-T (Chimeric Antigen Receptor T-Cell Immunotherapy)疗法被誉为“癌症治疗的第四次革命”,作为肿瘤治疗的革命性疗法,自上世纪90年代被提出以来,就成为了治疗癌症领域最受关注的焦点之一。CAR-T细胞疗法全称为嵌合抗原受体T细胞疗法,是将能识别肿瘤特异性抗原的scFv片段通过基因工程化改造,使之融合在由CD28、4-1BB和CD3-ζ等一系列参与T细胞激活的分子组成的跨膜链段上,通过基因转导的方法转染患者的T细胞,使其表达嵌合抗原受体(CAR),从而识别并击杀自身的肿瘤细胞。
CAR-T细胞疗法在急性淋巴白血病、淋巴瘤等血液恶性肿瘤的治疗中取得了显著的成功,为后线患者带了更多的治疗选择和延长生存期的希望。比较著名的案例是2012年,患有急性淋巴白血病的美国女孩Emily Whitehead,是第一个参与CAR-T细胞疗法的临床试验并被成功治愈的幸运儿。这一里程碑事件加速推动了CAR-T治疗领域的发展。
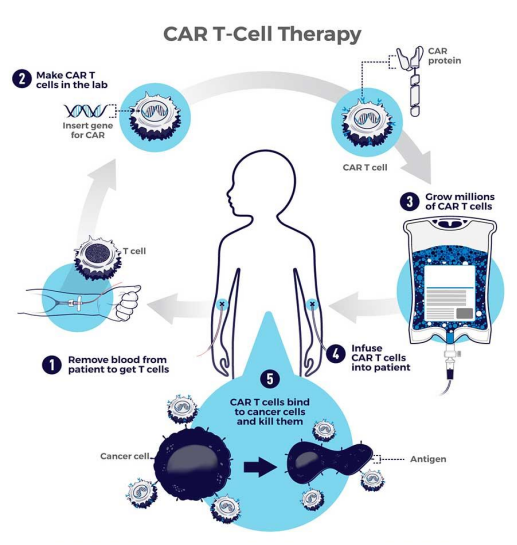
Credit: Brentjens R, et al. “Driving CAR T cells forward.” Nat Rev Clin Oncol. 2016 13, 370–383.
CAR-T细胞疗法相比于其他的细胞疗法具有以下几点优势:
1)更精准的治疗:应用病人自体的T细胞,无需抗原递呈,靶向性克服免疫逃逸;
2)更持久的杀瘤效果:与传统的化学药物和生物制剂相比,CAR-T细胞可在患者体内维持长达数周或数月,减少用药频次和相应副作用,有效提升了患者的治疗耐受性;
3)更广泛的靶点范围:CAR-T细胞作用过程不受MHC限制,达到多靶向的效果。
第一代CAR-T技术自上世纪90年代初诞生,在至今30年的时间里已经历了五次技术迭代,技术的更新主要集中在细胞结构上,包括scFv新靶点的挖掘,复合CAR-T细胞的构建,转换型CAR-T细胞,通用型CAR-T细胞的构建等。但上市的CAR-T细胞疗法普遍为二代CAR-T,且仅适用于血液系统恶性肿瘤,实体瘤领域的发展相对缓慢。
三代、四代、五代的CAR-T技术仍处于研发阶段。康佰裕生物的CBG-002就是基于第四代CAR-T技术设计的,在安全性和有效性方面具有更高的临床获益预期。
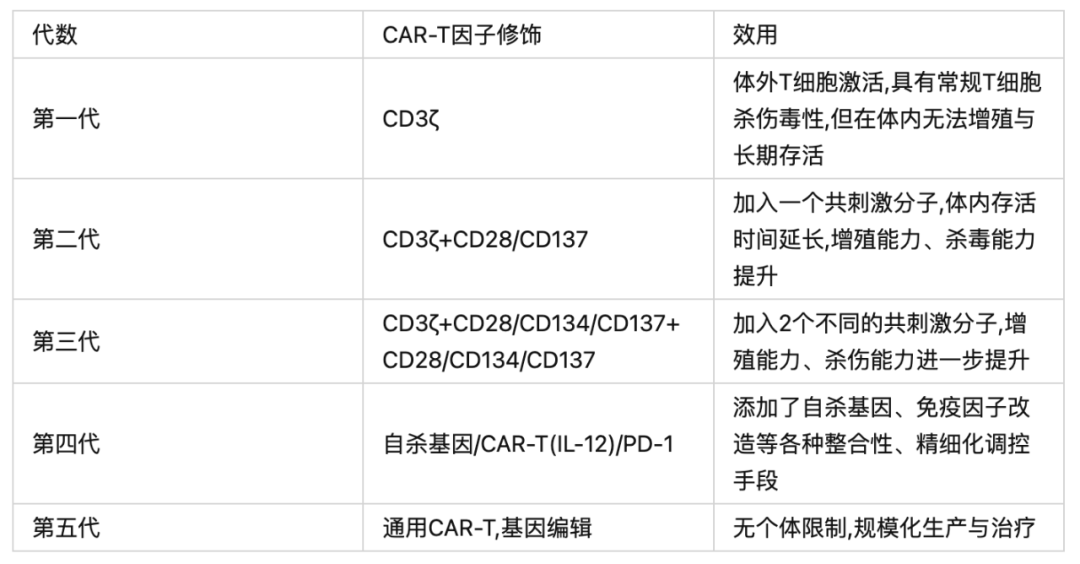
二、CAR-T细胞疗法的研发进展
到目前为止,全球共有8款CAR-T细胞疗法产品获批上市。其中,FDA批准上市的有6款,中国国家药品监督管理局批准上市2款。从布局的国内外靶点和适应症来看,集中度都非常高。
在研的CAR-T细胞疗法靶点主要分布在CD19和BCMA。适应症仅覆盖血液系统恶性肿瘤,而在实体瘤的领域,CAR-T细胞疗法进展缓慢。累计适应症包括急性淋巴细胞白血病、弥漫性大B细胞淋巴瘤、原发纵隔B细胞淋巴瘤、套细胞淋巴瘤、滤泡性淋巴瘤和多发性骨髓瘤。获批产品主要用于患者的后线治疗,包括晚期、复发/难治性以及转移性的肿瘤。
CAR-T细胞疗法药物研发靶点TOP10
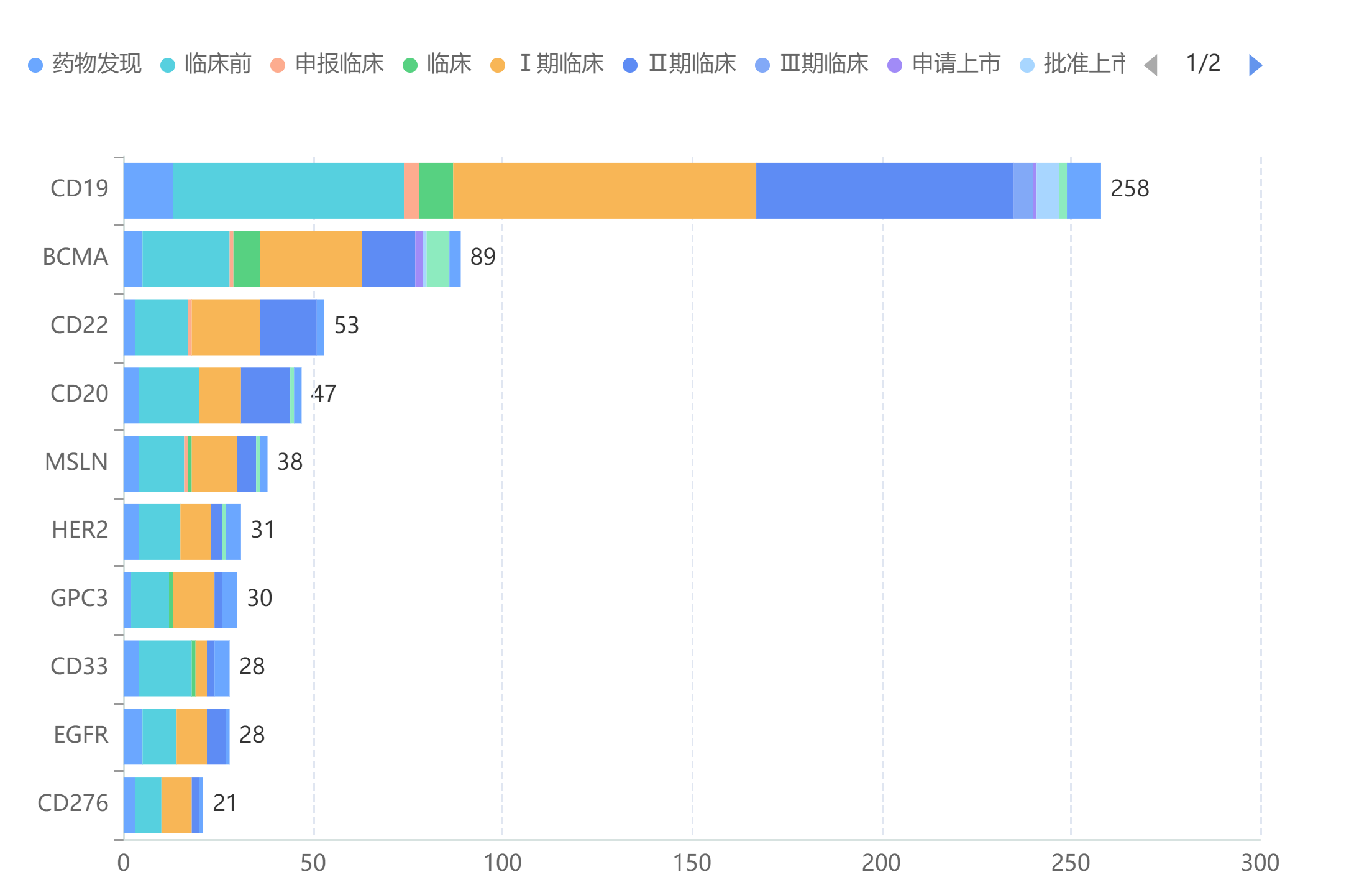
截图来源:药融云全球药物研发数据库
经药融云数据库查询显示,最早获批的CAR-T细胞疗法是于2017年8月上市的诺华的Kymriah®,全球首款用于治疗复发/难治性大B细胞淋巴瘤的CAR-T细胞疗法。紧接着吉利德旗下公司Kite公司的Yescarta®于同年获批。对标国内,2021年6月,中国复星集团复星凯特从Kite Pharma引进Yescarta® 技术,并获得在中国进行本地化生产的授权,使阿基仑赛注射液(即抗人CD19 CAR-T细胞注射液)成为中国首个上市的CAR-T细胞疗法产品。
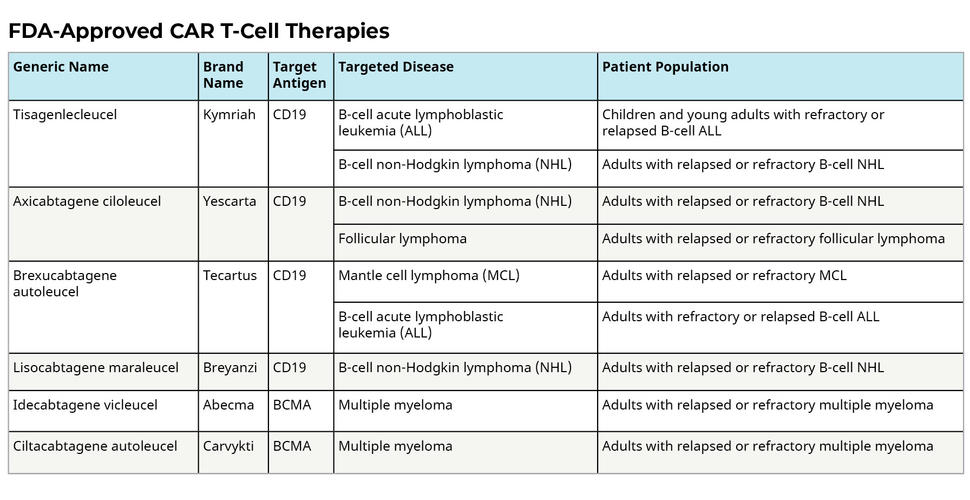
CAR T Cells: Engineering Patients’ Immune Cells to Treat Their Cancers was originally published by the National Cancer Institute.
国内上市CAR-T细胞疗法
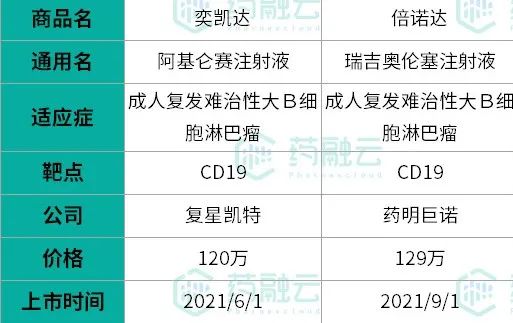
数据来源:药融云数据库
自2017年首批的两款CAR-T细胞疗法开始,全球市场迅速扩大。据Frost&Sullivan统计,到2030年,全球CAR-T市场规模按照销售价值计算将达到218亿美元(约为一千五百亿人民币)。虽然我国进入CAR-T领域较晚,但ClinicalTrials.gov官网显示,目前1349个全球登记在册的CAR-T项目中,我国以675个成为了仅次于美国的第二大CAR-T细胞疗法研发国家。
自2021年6月我国获批了首款CAR-T细胞疗法产品后,国内的CAR-T细胞治疗进入了百花齐放的状态。
除了复星凯特,药明巨诺龙头企业在血液肿瘤上取得的成功,国内多家生物公司相继致力于开发创新型CAR-T实体瘤治疗方法,比如科济药业用于治疗胃癌的CT041,斯丹赛的适应症为结直肠癌的GCC19CART,博生吉公司用于治疗神经母细胞瘤的B7-H3等。
对于新靶点的研究,科济药业在CLDN18.2靶向的胃癌实体瘤中展现了初步疗效。与此同时,南京传奇,科济生物,斯丹赛,北恒生物,凯博生物、科棋、上药集团,上海细胞治疗集团、康佰裕等多家公司已经与国内多家三甲医院合作,针对Claudin18.2,CD4,CD19,CD20,Mesothelin,Her2、GPC3等靶点开展相关临床试验研究。
鉴于目前已获批的大多数CAR-T细胞疗法产品是血液恶性肿瘤的后线疗法加之一些创新性CAR-T药物研发不久,市场还在火热竞争中逐渐培育,预计国内外CAR-T细胞疗法产品市场将维持高增长率。
三、小结
尽管CAR-T细胞疗法在恶性血液肿瘤治疗上的疗效显著,我们还应关注到CAR-T细胞疗法的几点待解决困难:1)CRS和ICANS等不良反应;2)抗原逃逸导致的肿瘤复发;3)由于实体瘤的异质性,CAR-T细胞迁移导致的肿瘤浸润不足,肿瘤免疫抑制微环境,和CAR-T细胞增殖能力不足等问题,实体瘤领域表现未达预期;4)通用型CAR-T如何真正成为治疗方法;5)治疗成本过高使患者望而却步。
自2017年起,我国相继出台了《“十三五”生物技术创新专项规划》、《细胞治疗产品研究与评价技术指导原则(试行)》,在一系列鼓励药企自主创新和加快引进符合临床未满足需求药品的政策环境下,CAR-T细胞疗法正如火如荼地占据中国市场。我国目前有20多家机构正在进行CAR-T的临床申报,超过三分之一正在进行的CAR-T临床试验评估用于治疗实体瘤。
此次递交临床申请的康佰裕是一家由海内外知名医学科学家联合创办的国家高新技术企业,也是政府赴美国签约引进的“5050计划”企业。康佰裕的研发生产中心通过国际标准ISO9001、ISO14001、ISO45001三体系认证,严格按照AABB标准建设,配备GMP标准的万级洁净厂房和国际一流实验设备,研发和生产环境均通过国际认证。
公司致力于推动新一代肿瘤免疫治疗技术的临床应用转化,建立了以新一代CAR-T和CAR-NK为主导的产业格局。核心技术包括以第四代CAR为基础的新型CAR-T技术,新型肿瘤DC疫苗,新型CAR-NK细胞治疗技术,以及基因修饰的干细胞治疗单基因遗传病技术。目前,公司自主研发的专利累计100余项,在权威杂志发表的论文300余篇。
我们期待康佰裕的BCMA靶向CAR-T细胞疗法和其他在研产品能够展现出更高的人体应用安全性和有效性,同时在实体瘤领域取得更多突破,为肿瘤患者带来福音。
参考资料:
[1] 药融云数据库
[2] 相关公司官方披露
[3] https://www.compvss.com/#/officialWebsite/result/details/5
[4] https://www.cancer.gov/about-cancer/treatment/research/car-t-cells
[5] https://www.kitepharma.com/news/press-releases/2022/9/kites-car-t-cell-therapy-tecartus-granted-european-marketing-authorization-for-the-treatment-of-relapsed-or-refractory-acute-lymphoblastic-leukemia
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>
















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论