
2023年5月,卫材宣布已与百力司康生物医药(杭州)有限公司(百力司康)就具有战略合作选择权的抗体偶联药物(ADC)BB-1701达成联合开发协议。根据合作协议,百力司康将获得首付款和里程碑付款,如卫材行使战略合作的选择权,百力司康将获得响应的行权付款,同时将获得总计可能高达20亿美元的开发与里程碑付款,以及销售分成,卫材会获得BB-1701的大中华区外全球权益。
BB-1701是一款由百力司康开发的由抗HER2抗体和艾立布林结合的ADC创新药,旨在为局部晚期和转移性HER2阳性实体瘤患者提供更加安全有效的治疗方案, 具有应用于多种肿瘤适应症的市场前景。BB-1701具有独特的作用机制(MOA),包括有效的旁路杀伤效应以及免疫原性细胞死亡(ICD)活性,目前正在进行中美I/II期国际多中心临床试验。
2023年6月,卫材完成对百力司康的B++轮投资。(注:百力司康是一家专注于抗肿瘤生物创新药的研发和产业化的临床阶段的生物医药企业。拥有独特的自主知识产权技术平台、丰富的ADC产品管线,以及能够支持抗体和ADC生产并应用于临床开发和早期商业化的GMP自有产能。)

百力司康选择与卫材进行相关合作,相信与卫材自身强大的全球肿瘤研发能力分不开,此次合作方之一的卫材除了肿瘤学领域在其他领域又有哪些布局呢?
药融云数据库显示:卫材株式会社(Eisai)是日本一家跨国制药公司,主要专注于神经和肿瘤领域,目标是通过在神经科学和肿瘤学领域创建基于科学和数据的解决方案。作为一家典型的依赖爆品发家的公司,卫材曾经一度跑进全球制药企业前20位列,当前是日本五大制药巨头之一,全球制药巨头排名三十多位。
卫材始于1941年,并在20世纪60年代末开始了公司全面的海外扩张;1982、1989和1992年分别在日本、美国和英国建立了实验室,也就是卫材的三中心研发网络;其中位于日本的筑波实验室在1983年开始进行痴呆症药物的发现研究,并在1987年成立研发小组开发抗癌药物。在之后,卫材虽然推出了新的产品,但由于研发资源的分散,一系列曝光之后卫材面对着无法推出新产品局面,随后卫材将神经病学和肿瘤学领域的资源集中,与神经病学和肿瘤学领域的伙伴合作,共同推出了一系列产品,在公司hhc理念的引领之下,卫材在自我检讨中不断开发创新,目前卫材在全球有40多家子公司,超过万名员工。
hhc理念也就意味着卫材不仅专注于开发药品,还专注于提供药品以外的活动,不仅考虑患者,还要考虑日常生活领域的人,并从客户角度考虑可以提供哪些来增加医疗保健为人们提供的好处,进一步在业务活动中付诸实践,改变社会。
产业布局
01主要产品
卫材的核心业务是处方药,但为了实现销售额规模的延续,卫材也在日本经营OTC、保健品和仿制药。目前公司已有多个产品在全球范围内上市,全球代表性药物有抗癌药物Halaven(甲磺酸艾立布林)和Lenvima(仑伐替尼),抗癫痫药物Fycompa(吡仑帕奈)和抗失眠药Dayvigo(lemborexant)。

Halaven(甲磺酸艾立布林)于2010年首次在美国获批用于转移性乳腺癌患者的治疗,2016年在美国首次获批用于治疗软组织肉瘤,目前已在全球几十个国家获批用于治疗乳腺癌和软组织肉瘤。在中国,Halaven于2019年获得国家药品监督管理局批准,用于治疗既往接受过至少两种化疗方案(包括蒽环类和紫杉类)治疗的局部复发或转移性乳腺癌患者,并于2020年初正式上市。
Lenvima(仑伐替尼)是一种激酶抑制剂,2015年在美国首次获批用于局部复发或转移性、进行性、放射性碘难治性分化型甲状腺癌(DTC)患者,当前已获批的适应症包括:甲状腺癌、肝细胞癌(HCC)、肾细胞癌(二线治疗)、子宫内膜癌等。2018年3月,卫材与默沙东达成战略合作,在全球范围内开发和商业化Lenvima,并在当年先后获得日本、美国、欧盟批准,成为这些市场过去10年来全球获批用于晚期或不可切除性肝细胞癌(HCC)的首个新的一线治疗药物。在中国,Lenvima于2018年获批用于治疗既往未接受过全身系统治疗的不可切除的肝细胞癌(HCC)患者,2019年底获批用于治疗分化型甲状腺癌(DTC)患者。
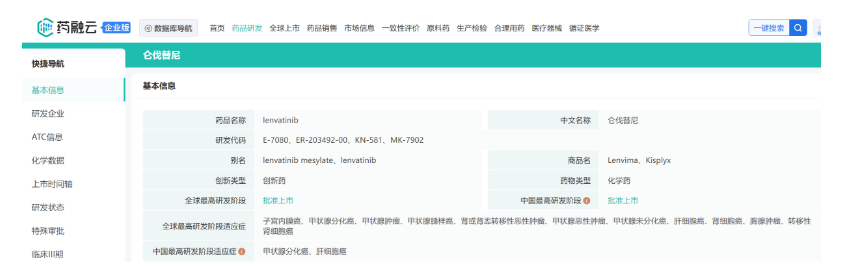
截图来源:药融云全球药物研发数据库
Fycompa(吡仑帕奈)是由卫材发现和开发的首款抗癫痫药(AED),目前已在70多个国家获批用于12岁及以上癫痫患者局部癫痫发作(伴随或不伴随继发性全身癫痫发作)以及原发性全身强直阵挛发作的辅助用药。在日本、美国和中国,该药物被批准用于单药治疗和辅助治疗4岁及以上癫痫患者的部分性癫痫发作(伴或不伴继发性全面性癫痫发作);在欧洲,部分性癫痫发作(伴或不伴继发性全身性癫痫发作)的辅助治疗的批准年龄范围为4岁及以上,原发性全身强直阵挛发作的辅助治疗的批准年龄范围为7岁及以上。在中国,该药物于2019年获批。
Dayvigo(lemborexant)于2019年底在美国获批用于治疗失眠症,并于2020年正式上市,在中国香港和中国台湾分别于2021年2月和2022年5月获批。
除了以上提到的四种具代表性的全球产品之外,卫材获批的产品还有神经病学类药物Aricept(donepezil) Methycobal(mecobalamin)抗肿瘤类药物Tazverik(tazemetostat)、Goofice (elobixibat)、Remitoro (denileukin diftitox [genetical recombination]),适用于风湿性关节炎和中重度溃疡性结肠炎的Jyseleca ( filgotinib),针对溃疡性结肠炎的Carogra (carotegrast methyl)以及消费保健品ChocolaBB Plus等。
02研发管线
卫材的研发管线有神经病学、肿瘤学、胃肠道和健康类的产品。
神经病学
在神经病学方面,卫材有其独特的研究方式,比如针对阿尔兹海默病研究时实现连续的脑健康小组诊断,该诊断对病理生理生物标志物进行定量和连续的测量,以精确诊断疾病连续体中的每个人的阶段,旨在提供基于精确诊断确定药物的最佳治疗(药物或非药物)。该领域研发管线情况如下:
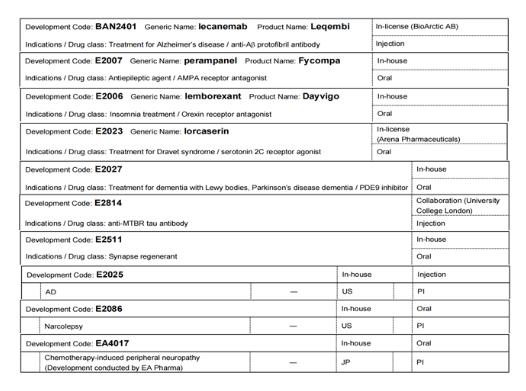
Leqembi(lecanemab)是一种靶向β淀粉样蛋白(Aβ)原纤维的lgG1抗体。通过消除神经毒性Aβ原纤维,降低疾病进展速度并减缓成人阿尔茨海默病(AD)的认知和功能下降。2023年7月,卫材和Biogen宣布FDA已批准补充生物制品许可证申请(sBLA),支持Leqembi(lecanemab-irmb)100 mg/mL注射液用于静脉使用的传统批准,Leqembi成为第一个也是唯一一个被批准用于AD的治疗方法。卫材还在日本、欧盟、中国、加拿大、英国和韩国提交了Lecanemab的批准申请。在日本和中国,这些申请已被指定为优先审查,在英国,lecanemab已被指定为创新许可和获取途径(ILAP),旨在缩短创新药物的上市时间。在日本、美国和欧盟针对临床前期阿尔兹海默病的研究进行到临床试验三期。
Fycompa(perampanel)可以选择性地抑制谷氨酸的AMPA受体(谷氨酸受体亚型)活化。在超过75个国家(包括日本,中国以及欧洲和亚洲国家)被批准作为部分性癫痫发作的辅助疗法,在日本和中国获批用于单药治疗,在包括日本在内的70多个国家以及欧洲和亚洲国家也被批准作为原发性全身强直阵挛发作的辅助治疗。口服混悬剂已在欧洲和中国获得批准。细颗粒配方已在日本获得批准。Fycompa的美国权利于2023年1月转让给Catalyst pharmaceuticals(催化剂制药)公司。在日本、美国和欧盟针对附加适应症——Lennox-Gastaut综合征(LGS)的研究进行到临床试验三期。
Dayvigo(lemborexant)是一种食欲素受体拮抗剂,可阻断参与睡眠和觉醒调节的受体,有望缓解清醒,从而促进更快的进入和维持睡眠。已被日本,美国和亚洲国家等超过15个国家批准用于治疗失眠。在中国针对失眠障碍的研究进行到临床试验三期;在日本和美国针对不规则睡眠-觉醒节律障碍和阿尔茨海默病痴呆的研究进行到临床试验二期。
Lorcaserin通过选择性地激活大脑中的5-羟色胺2C受体,通过激活GABA能抑制神经元间神经元,预期通过增加GABA能的突触抑制来抑制Dravet综合征的癫痫发作。尽管肥胖适应症的批准已被自愿撤回,但由于Dravet综合征患者团体的要求,美国仍在继续延长访问计划,并且该适应症的III期临床研究正在进行中。FDA已将其指定为Dravet综合征的孤儿药。(由Arena Pharmaceuticals开发)
(注:GABA是一种大脑内最普遍最常见的抑制性神经递质)
研发代码为E2027的药物是一种选择性磷酸二酯酶(PDE)9抑制剂,可减少环状GMP的降解,环状GMP对细胞之间的信号转导至关重要。通过帮助维持大脑中循环GMP的浓度痴呆,该药物有望成为路易体痴呆和帕金森病的新疗法。该药物在美国针对路易体痴呆和帕金森病痴呆的研究进行到临床试验二期。
研发代码为E2814的研究药物是一种抗微管结合区(MTBR)tau抗体,是卫材与伦敦大学学院研究合作的一部分,有望阻止Tau种子在脑内扩散。显性遗传性阿尔茨海默病网络试验单位(DIAN-TU)已选择E2814作为其DIAN-TU tau研究的抗Tau药物中的第一个研究药物,目前正在进行显性遗传性阿尔茨海默病的Tau NexGen的IB/II期研究和II/III期研究。
研发代码为E2511的研究药物有望促进受损胆碱能神经元的恢复和突触重塑,并抑制由神经变性引起的脑萎缩,该研究目前在美国地区进行到临床试验一期;代码为E2025的研究主要针对AD,在美国地区进行到临床试验一期;代码为E2086的研究在美国地区进行到临床试验一期,适应症为发作性睡病;研发代码为EA4017的研究在日本进行到临床试验一期,适应症为化疗诱导的周围神经病变(由EAPharma公司开发)。
肿瘤学
在肿瘤学领域,卫材的目标是通过对血液中循环肿瘤细胞的连续DNA分析和下一代DNA序列分析,更深入地了解癌症的演变,实现基于基因组信息的早期诊断,并实现个性化医疗,从而为每位患者选择最佳治疗方法。当前肿瘤学领域的研发管线情况如下:
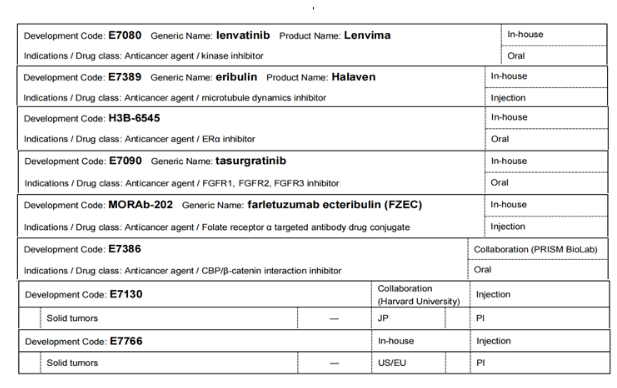
Lenvima(lenvatinib)是一种可口服的多激酶抑制剂,其选择性地抑制血管内皮生长因子受体(VEGFR1、VEGFR2和VEGFR3),以及成纤维细胞生长因子受体(FGFR1、FGFR2、FGFR3和FGFR4)的激酶活性,此外还抑制病原性血管生成、肿瘤生长和癌症进展相关的受体酪氨酸激酶。通过附属公司与默克公司联合开发:①与抗PD-1治疗帕博利珠单抗联合使用的研究,在日本、美国、欧盟和中国针对子宫内膜癌、非小细胞肺癌(非鳞状肺癌)、头颈部癌症、肝细胞癌(联合经导管动脉化疗栓塞)、食管癌(联合化疗)和胃癌(联合化疗)的研究进行到临床试验三期;在日本、美国和欧盟针对非小细胞肺癌(二线治疗方法)的研究进行到临床试验三期;在美国和欧盟针对结直肠癌(三线治疗)进行到临床试验三期,针对黑色素瘤(二线治疗)、选定的实体肿瘤(胃癌、结肠直肠癌、胶质母细胞瘤、胆道癌和胰腺癌)和头颈部癌症(二线治疗方案)进行到临床试验二期。②与抗癌药物依维莫司联合使用,在日本、美国和欧盟针对肾细胞癌(一线研究)的研究进行到临床试验三期。与小野制药联合开发,与抗PD-1抗体纳武利尤单抗联合开发,在日本针对肝细胞癌的研究进行到临床试验一期。
Halaven(eribulin)是从海绵Halichondria okadai中提取的软海绵素B的合成类似物,通过抑制微管的生长来阻止细胞周期,从而显示出抗肿瘤作用。已在日本、美国、中国、欧洲和亚洲等85个国家获批用于治疗乳腺癌。在日本、美国、欧洲和亚洲等80多个国家获批用于治疗脂肪肉瘤(在日本为软组织肉瘤)。目前作为单药抗癌的研究在日本和欧洲进行到临床试验一期;在日本与抗pd-1抗体纳武利尤单抗联合用药的研究进行到临床试验一/二期,与小野制药公司联合开发。
研发代码为H3B-6545的研究药物为口服选择性雌激素受体(ER)α抑制ERα野生型/ERα突变体的共价拮抗剂,预期显示出对ER阳性/HER2阴性乳腺癌的抗肿瘤作用。在美国和欧洲针对乳腺癌的研究进行到临床试验一/二期,联合CDK4/6抑制剂palbociclib针对乳腺癌治疗的研究进行到临床试验一期。
tasurgratinib是一种口服成纤维细胞生长因子受体(FGFR1、FGFR2、FGFR3)选择性酪氨酸激酶抑制剂。在日本和中国针对胆管癌的研究进行到临床试验二期;在日本针对乳腺癌的研究进行到临床试验一期。
Farletuzumab ecteribulin是卫材开发的首款抗体偶联药物(ADC),由卫材自主研发的靶向叶酸受体α(FRα)的farletuzumab(一种人源化IgG1单克隆抗体)、酶可裂解的连接子和卫材自主研发的抗癌药艾立布林组成。卫材已与百时美施贵宝签订全球独家战略合作协议,以共同开发和商业化farletuzumab ecteribulin。目前在美国和欧洲针对非小细胞肺癌的研究进行到临床试验二期;在日本、美国和欧洲针对卵巢癌、腹膜癌、输卵管癌的研究进行到临床试验二期;在美国和欧洲针对实体瘤的研究进行到临床试验一/二期;在日本针对实体瘤的研究进行到临床试验一期。
研发代码为E7386的研究药物是一种CREB结合蛋白(CBP)/β-连环蛋白抑制剂,可阻断CBP和β-连环蛋白之间的蛋白质相互作用,并调节Wnt信号依赖性基因表达,抑制Wnt信号传导依赖性肿瘤生长,与PRISM BioLab进行合作研发。在日本、美国和欧洲地区,用于实体瘤的研究进行到临床试验一期,与帕博利珠单抗联合使用用于实体瘤的研究进行到临床试验一/二期,与lenvatinib联合使用用于实体瘤治疗进行到临床试验一期。E7130和E7766均是针对实体瘤的注射剂研究,分别是在日本和美国/欧洲进行,均进行到临床试验一期。
财务状况
通过2002~2021年的收入和营业利润趋势来看,虽然有几次较大的起伏,但是从2022年的财政营收报告来看,2022财年(2022.04.01~2023.03.31)的营收是超出之前的预期的。
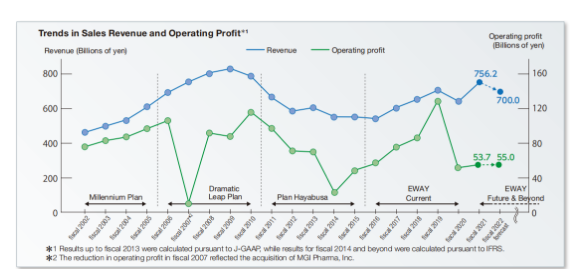
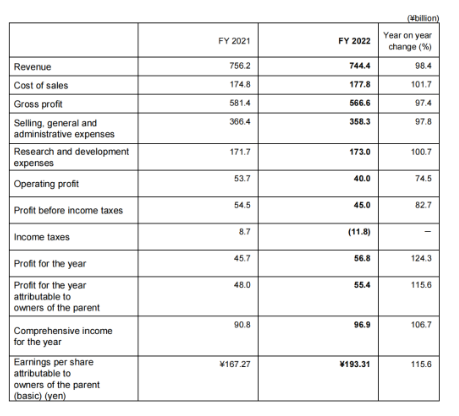
2022年收入7444亿日元(50.43亿美元,1.00美元=147.62日元),营业利润400亿日元(2.71亿美元)。虽然抗癌剂Lenvima(仑伐替尼)等全球品牌持续增长,但收入减少主要是由于默克公司的销售里程碑付款减少(本财政年度为167亿日元,上一财政年度为692亿日元),上一财年百时美施贵宝根据战略合作就抗体药物偶联物MORAB-202支付的预付款(496亿日元)虽然营业利润有所下降,但医药业务的分部利润大幅增长。
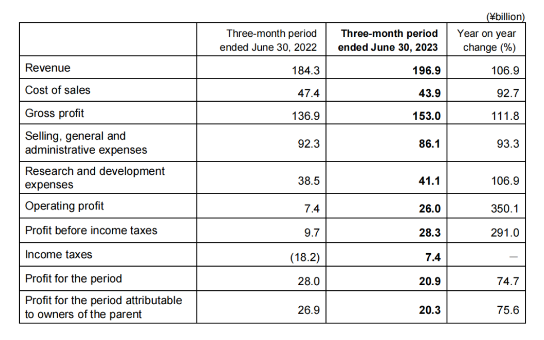
2023年第一季度收入1969亿日元(13.34亿美元),与上一年同期相比增加6.9%;营业利润260亿日元(1.76亿美元),与上一年同期相比大幅增加。收入增加主要是由于收到选择性雌激素受体降解剂elacestrant未来经济权利转让的预付款,以及抗癌剂Lenvima和失眠治疗药物Dayvigo的持续增长。
尽管AD治疗药物Leqembi在美国上市后的销售费用增加,以及支付给默克公司的共享利润随着Lenvima的收入增长而增加,由于不再产生与阿尔茨海默病(AD)治疗药物Aduhelm相关的费用,销售、总务和管理费用为861亿日元(5.83亿美元),与上年度同期相比下降6.7%。通过合作模式提高效率的同时,由于对Leqembi的积极资源投资以及美国合并子公司研究设施的简直损失记录等因素,研发费用有所增加。所得税前利润大幅增加,但由于上衣财年同期的临时因素导致所得税减少的影响,本期利润有所下降。截至2023年6月30日,卫材的现金及现金等价物为2693亿日元(18.24亿美元)。
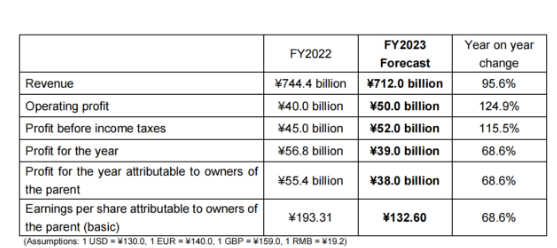
基于以上财务报告,以下是卫材对2023年度的财政预测,虽然预期收入有所下降,但是预期的营业利润与上年相比还是有所增长,可见卫材对新的一年还是充满乐观。
近日,日本卫材宣布成立数字业务公司Theoria Technologies,以构建痴呆症生态系统,同时,Theoria Technologies将与卫材一起开发和提供Sasaeru,该应用程序通过记录痴呆患者的日常生活活动(ADL),帮助促进痴呆,医生和护理人员之间的交流。此外,Theoria技术将通过加强与其他公司的合作来促进数字服务的发展。

相关资讯
早在2020年,卫材中国就与京东集团公司京东健康成立合资公司,这是一个覆盖用户全生命周期健康管理场景的健康管理平台,提供基于有效供应链、数字技术驱动的医疗服务,旨在为中国老年人打造一个新的一站式健康服务平台,让用户可以从各种信息和医疗服务中选择和使用最适合的个性化服务。作为一家成立八十多年的药企,这家早就把人类医疗保健(hhc)作为企业理念的公司也用实际行动告诉行业,研发生产药物固然重要,站在病患及日常生活领域客户角度进行问题的预防和解决也不可或缺。
参考:
NMPA/CDE;
药融云数据库
FDA/EMA/PMDA;
相关公司公开披露(除标注外,正文图片均来自企业官网);
https://www.eisai.com/index.html;
https://mp.weixin.qq.com/s/0fQgNax5jGJA6q5y0U4tEg;
https://news.bioon.com/article/6748937.html;
https://www.bioon.com/article/6729950.html;
https://mp.weixin.qq.com/s/f_euAQU-ZfsRecDkntDmEA;
https://www.blissbiopharma.com/page95.html?article_id=111。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论