本文标题问题的存在基础是,有的方法学验证设计了4个水平的加标回收试验,比如定量限、50%、100%、150%,对于那些仅设置50%、100%、150%或者80%、100%、120%等浓度水平,不考虑更低浓度水平的验证而言,问题就不复存在了。
那到底这种做法来源于哪儿?有一个但不唯一的来源可能是ICHQ2(R1)中关于定量限验证时的“Recommended Data”:
原文:The limit (quantitationlimit)shouldbe subsequently validated by the analysis of a suitable number of samples knownto be near or prepared at the quantitation limit.
译文:定量限需要分析适当数量的样品去验证,这些样品中的杂质浓度应该接近定量限或按定量限浓度进行制备。
因此,在该问题存在的前提下,本文抛砖引玉,浅谈一些想法。
对于这个问题,不得不先说一下方法学验证中的准确度实验,想必大家应该很熟悉了,中国药典2020年版通则9101给出的定义为,准确度系指用所建立方法测定的结果与真实值或参比值接近的程度,一般用回收率(%)表示。
具体做法想必也无需赘述,但具体实施却有变化,有发展。以中国药典为例,2020年版药典相对于2015年版药典,在具体的描述上有很多不同之处,这些不同之处传递的信号表明方法学验证趋向于更加科学和合理,更加贯彻了为使用目的而验证的核心理念。
比如说,对于准确度实验一般做法的描述,两版药典的描述对比如下:

其实并不是从2020版药典开始,不知从何时起,业内有人开始在做准确度实验时,不再局限于低、中、高三个浓度的考察了,进一步设置了定量限水平的回收率,理由当然也很充分。很多人听说了这个做法,也去做了,只是做的有点痛苦。其中明显的区别是2015版药典对于加标水平的描述,在2020版药典里被一句话给概括了:浓度的设定应考虑样品的浓度范围。如此一来,对于浓度水平的设定就说的非常清楚但不具体,这显得非常指导原则。
具体做法不一而足,就业内存在的一种做法示例如下:
1、先做定量限考察:一般以信噪比为10:1时相应浓度或注入仪器的量确定定量限。
2、回收率考察:除了常规的低、中、高三个浓度(比如50%、100%、150%),在定量限浓度设置回收率考察。
3、计算12个加标水平回收率的RSD值。
那么我们简单分析一下上述做法为什么会很痛苦:
1、假设这个方法有10个杂质,如果不幸运的话,因为各个杂质响应的差异,按信噪比为10:1考察,可能出现这10个杂质的定量限浓度各不相同。那么加标试验就需按10个杂质各自的定量限浓度配制,不管怎么设计,想想都挺麻烦。
2、在好不容易把溶液设计配制好,进样分析时,还在担心这个水平的回收率是否能通过拟定的验证要求,毕竟浓度低,误差大。
3、在忐忑中迎来了数据处理的时刻,万幸各个杂质的定量限水平回收率都满足拟定的要求,比如说85%~115%(有人比较聪明,把定量限水平回收率限度放宽了)。确实都在85%~115%范围内没错,但可能出现了偏低或偏高的情况,而正常浓度水平的回收率范围设置的是90%~108%,基本处于100%左右,此时合并计算12个水平的RSD出了问题,超标了!又有聪明人说了,定量限水平的回收率我们不参与RSD的计算,是否可行暂且不论,这个不参与计算的逻辑基础在哪儿呢?因为参与后不合格吗?
何必为难自己呢?下面提供一种“包过”的做法,不过仅供参考,抛转引玉:
定量限浓度的回收率该怎么做?这个问题不妨换一种说法:相对于50%的加标水平,为了把方法验证的更加充分,更低浓度的加标回收率该怎么做?更低浓度不等于信噪比为10:1的定量限浓度,也没有这种要求。
话不多说,先上实施例:
1、假设某有关物质方法需要检测8个杂质,样品浓度为1mg/ml,杂质限度为均不得过0.15%。
2、根据药典一般要求以及一般做法,按信噪比10:1考察各个杂质的定量限浓度,假设考察结果如下:
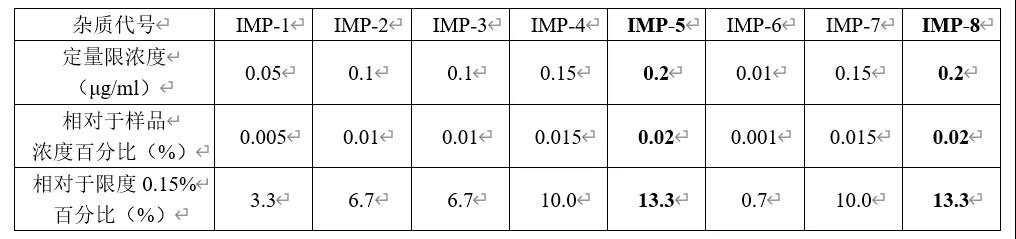
注:1、相对于样品浓度百分比(%):定量限浓度除以样品浓度(1mg/ml),乘以100%。
2、相对于限度0.15%百分比(%):将0.15%作为加标100%的水平时,定量限浓度相对应的加标水平。
3、根据定量限考察结果,8个杂质中灵敏度最差的为IMP-5与IMP-8。那么回收率加标水平除了常规的低、中、高三个点设计外,各个杂质更低水平的加标浓度可以统一设置为15%~20%即可。
上述实施例仅作为一种可参考的具体方式,除此之外,可以更加简单粗暴的进行回收率加标水平的设置。比如,在综合考虑了杂质限度要求以及各个杂质的定量限水平后,可直接设置30%、100%、150%,或者30%、80%、120%三个水平的回收率试验。
我们都是爱学习,勤思考的好同志,所以必须要问一句,上述做法的理论基础在哪儿,内在逻辑是什么,有没有法规支持,有没有审评风险?
下面我们就来找一下这方面的信息,给自己一个安慰,也给他人一个交代。
理论基础及法规支持:
1、各国药典以及ICH说,分析方法验证的目的是证明建立的方法适合于相应检测要求。
2、ICH对于回收率的要求:
原文:Accuracyshould be assessed using a minimum of 9 determinations over a minimum of 3concentration levels covering the specified range (e.g., 3 concentrations/3replicates each of the total analytical procedure).
译文:准确度应该采用至少3个浓度(涵盖拟定的范围)9份样品进行评估(比如3个浓度各3份平行样)。
解析:其中关于加标浓度的描述为“coveringthe specified range”,那么我们进一步看一下“specified range”是如何规定的:
原文:forthe determination of an impurity: from the reporting level of an impurity to120% of the specification。
译文:对于杂质检测而言,范围应该包括杂质的报告限(ICHQ3A、ICHQ3B)至限度的120%。
解析:范围下限一般为0.05%(对于大于2g/天的原料药为0.03%,制剂会更高)。
内在逻辑:
1、满足使用需求:控制需求一般是报告限(0.05%)至限度的120%,且并无加标水平的明确设置要求,理论上可以在该范围内任意设置。
2、定量限的要求:一般情况下杂质的定量限不高于ICH要求的报告限即可满足要求(最多我们自己严格要求一下,再设置一个更低点的忽略限)。因此,假设杂质限度为0.15%,报告限为0.05%,那么定量限做到0.01%~0.02%足以满足检测要求,可据此设置合理的样品浓度或者进样体积。
3、对于杂质限度为0.15%的情况,其加标水平在20%或30%时对应的限度是0.03%或0.045%,可见足以满足产品的质量控制需求。可能有人说了,我们样品实际检出杂质都是0.003%的水平。怎么说呢,信不信把你的样品浓度再加大10倍,还可以看到很多之前看不到的杂质!
由于各个杂质的响应差异,在同一样品浓度和进样体积的情况下,可能某些杂质的定量限异常低,此时如果按该浓度做加标回收,可想而知的难度。
审评风险:
审评并不是一刀切,无需过分担心,有理走遍天下,何况是科学的道理。当然我们可以选择简单但更为保守的做法,比如在杂质灵敏度满足要求的情况下,更低加标水平统一设置为10%,相对于100%的限度水平,已是十分之一,应该足以满足质量控制需求了吧。真的无需对各个杂质在各自的定量限浓度进行加标回收试验。
类似的验证同样如此,满足使用目的和要求即可。比如线性与范围,对于限度为0.15%的杂质,范围验证到10%显然是没有必要的,即使线性良好;再比如,对于忽略限为0.02%~0.03%的杂质检测,把定量限做到0.0001%(信噪比为10)显然也是没有必要的,即使方法灵敏度确实能做到这么高。总之,方法需要合理的设计,验证无需过度。
结语:
本文所述可能不具有普适性,仅代表业内一部分人的实验现象,对于有的团队可能压根不存在上述情况。还是那句老话,本文抛砖引玉以供讨论,哪怕对百里有一能够有所启发已是功德圆满。

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论