SHP2

2020年8月,勤浩医药(苏州)有限公司,一家专注于开发全球领先的小分子抗肿瘤药物的生物技术公司,与沪亚生物国际达成一项独家许可协议。勤浩医药将其SHP2抑制剂GH21中国以外的产品开发和商业化权利授予沪亚生物国际,沪亚生物国际将为此支付首付及里程碑款高达2.82亿美元,勤浩医药还将获得GH21产品在海外上市后的销售提成。
据悉:GH21是勤浩医药自主开发的,具有全球知识产权的小分子SHP2抑制剂,具有极强的生物活性,且对多种SHP2点突变体有效。体内外的研究表明,GH21对SHP2以外的磷酸酶、激酶以及安全性相关的靶点无显著影响,脱靶风险低;同时代谢性质优异,口服生物利用度高,且安全性良好,具有较大的安全窗,是一个极具开发潜力的小分子抗肿瘤药物。
2021年10月,GH21在美国获准开展临床试验。
2021年11月,GH21在中国获批开展临床试验。
KRAS
2021年11月30日,济民可信子公司上海济煜医药科技有限公司(以下简称“上海济煜”)与沪亚生物国际(以下简称“沪亚”)(HUYABIO INTERNATIONAL)达成一项独家许可协议,上海济煜将具有自主知识产权的KRAS抑制剂JMKX1899在大中华区以外的开发、生产及商业化权利独家许可给沪亚,JMKX1899在大中华区域的相关权益仍归济民可信所有。

JMKX1899是上海济煜小分子创新中心自主研发的KRAS抑制剂,临床前研究数据显示,与同靶点产品相比,JMKX1899具有较强的脑通透性,且没有心脏毒性和药物-药物相互作用风险。上海济煜已于2021年10月向国家药监局递交临床申请,上海济煜和沪亚将于近期向美国FDA递交临床申请,以同步推进JMKX1899在中国和美国的临床。
Wee1
2021年10月28日,上海医药以不超过2.925亿美元(除销售提成外)的交易金额将具有自主知识产权的SPH6162的海外权益许可给HUYABIO。SPH6162为上海医药中央研究院自主研发的抗肿瘤小分子抑制剂。通过抑制激酶活性,抑制肿瘤细胞对药物的损伤修复,从而达到对肿瘤细胞杀伤。
SPH6162目前处于临床前开发阶段,已提交两款化合物的国际专利申请。SPH6162为全球同靶点研发快速跟进产品,借助海外合作伙伴的资源和研发力量,有望加快该产品在国内外的同步开发速度。药融云数据(www.pharnexcloud.com)显示,本品是一款Wee1新药。
HDAC
2006年,微芯生物将西达本胺的国际专利使用权以2800万美元的价格授予沪亚生物国际,后者负责“西达本胺”在美国的临床试验。这是中国医药行业史上首次对美国药企进行专利技术授权许可使用和国际临床联合开发,是中国首个获美国FDA核准在美国进行临床研究的中国原创化学新药,实现了中国发现、全球开发的战略目标,和让全球最新创新成果造福中国患者的愿望。
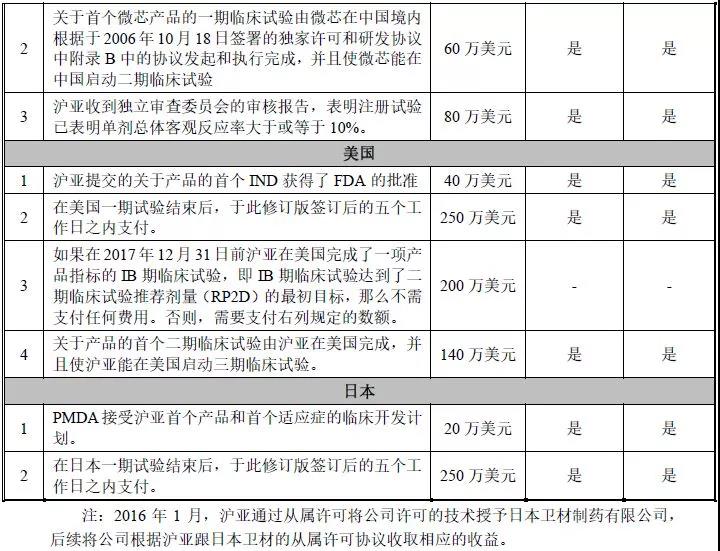
但这笔交易中西达本胺的价值没有被充分体现,2015年HUYA生物以2.8亿美金的价格将西达本胺以再许可的方式转让给日本卫材(日本、韩国和东南亚的开发和商业化权利)。

微芯生物与中国台湾省药企华上生计签订战略合作协议
2021年6月,全新分子实体、全球首个口服、亚型选择性组蛋白去乙酰化酶(HDAC)抑制剂西达本胺(Chidamide;通用名:Tucidinostat;海外编号:HBI-8000)单药治疗成人T细胞白血病/淋巴瘤(ATL)适应症获日本医药品医疗器械综合机构(PMDA)正式批准。这是西达本胺继2014年在中国获批外周T细胞淋巴瘤及2019年乳腺癌适应症之后,在日本获批上市的新的一种肿瘤适应症,也是中国本土企业首个自主研发的原创新药在海外获批上市。本次获批是基于一项在日本完成的2b期临床试验数据,该试验入组了23名侵袭性ATL患者。这些患者都经历了莫格利珠单抗(mogamulizumab)单抗治疗后复发或耐药,没有其他有效治疗选择。在经过一周两次40mg口服西达本胺后,相当比例的临床患者产生疾病应答并具备可接受的安全性。(药融云数据www.pharnexcloud.com显示,此前在2020年初,明治制药(Meiji)成为本品血液瘤适应症在日本的独家分销商。)

北京时间2021年12月1日,微芯生物收到沪亚生物电文通知,其获微芯生物专利授权开发的全新分子实体、全球首个口服、亚型选择性组蛋白去乙酰化酶(HDAC)抑制剂西达本胺(Chidamide;通用名:Tucidinostat;日本商品名:Hiyasta®;海外编号:HBI-8000)单药治疗外周T细胞淋巴瘤(PTCL)适应症获日本药监局批准。这是西达本胺继成人T细胞白血病/淋巴瘤(ATL)之后,第二个在日本获批上市的肿瘤适应症。
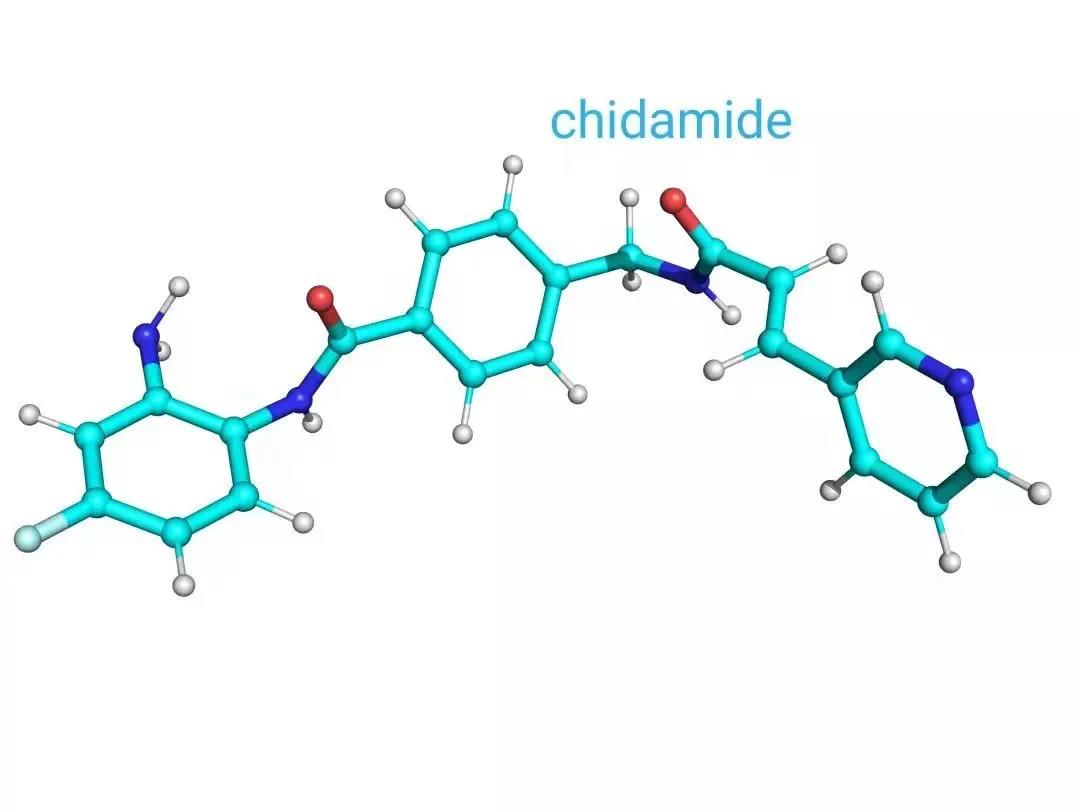
Sulcardine sulfate(硫酸苏氨酸)HBI-3000

药融云数据(www.pharnexcloud.com)显示:本品为一款改良新药,源自于中国上海药物所。目前正在开展Atrial fibrillation(心房颤动) 2期临床试验。
IDO
2016年3月,复旦大学将具有自主知识产权的用于肿瘤免疫治疗的IDO抑制剂许可给沪亚。根据协议,沪亚将采用里程碑付款方式向复旦大学支付累计不超过6500万美金,以获得该药物除中国大陆、香港、澳门和台湾地区以外的全球独家临床开发和市场销售的权利。本品由杨青教授课题组早期开发。

沪亚生物国际CEO兼执行主席
Mireille Gillings博士
关于沪亚生物国际
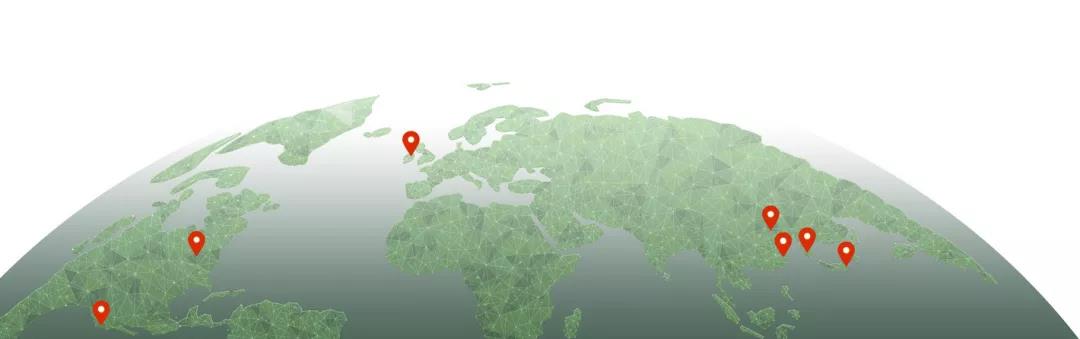
沪亚生物国际是加快源自中国的创新药产品全球开发的领导者,促进在国际市场上更快、更具成本效益和更低风险的药物开发。通过与生物制药、学术和商业机构的广泛合作,沪亚生物国际已经建立了覆盖所有治疗领域的最大的中国来源的化合物组合。Hiyasta®(西达本胺)(HBI-8000)是沪亚的首个商业化品种,已在日本上市。公司在美国、日本、韩国、加拿大、爱尔兰及中国八个战略城市设有办公室,已成为加快产品开发和实现全球价值最大化的首选合作伙伴。
参考:
NMPA/CDE;
药融云数据 www.pharnexcloud.com;
FDA/EMA;
www.huyabio.com;
https://huyabio.com/pipeline/;
勤浩医药完成超2亿元A轮融资,推进新一代抗肿瘤药的开发;
上海医药变革:频频产生新交易、走近创新;
创新药的大江大河:微芯生物与中国医药二十年变迁;
微芯生物官网及投资者调研记录;
等等。
<END>





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论